不同孵化方式、培育密度和附着基对瘤背石磺人工繁育的影响
2013-06-26沈永龙黄金田戈贤平王爱民蔡万存沈楠楠
沈永龙,黄金田,戈贤平,王爱民,吕 富,蔡万存,沈楠楠
(1.盐城工学院 江苏省滩涂底栖生物重点实验室,江苏 盐城 224051;2.南京农业大学 无锡渔业学院,江苏 无锡 214081)
瘤背石磺(Onchidium struma)是一种栖息于海滨潮间带的腹足纲贝类,具有极高的营养、药用和生态价值[1-2],主要分布于我国江苏、上海等沿海滩涂地区。近年来,由于环境污染和人为滥捕等原因,瘤背石磺资源量急剧下降,甚至已经濒临灭绝。虽然瘤背石磺的室内养殖已获得初步成功[3],但苗种繁育仍存在“瓶颈”,因此,探索瘤背石磺苗种繁育的关键技术迫在眉睫。
目前,国内外对石磺研究主要集中于生理形态[4-5]、生态习性[6]、生殖繁育[7]以及神经生物学[8]等方面,繁育技术方面的研究也相对较多,如沈和定等[9-10]研究了不同温度和盐度对石磺胚胎发育的影响,滕炜鸣等[11]和金春华等[12]分别报道了瘤背石磺滩涂生态繁殖和人工繁育的关键技术,王金庆等[13]研究了石磺胚胎和幼虫发育的过程及特点,Ruthensteiner[14]和Smith 等[15]对戴氏石磺(Onchidium damelii)、Deshpande等[16-17]和 Nanaware 等[18]对沃氏石磺(Onchidium verruculatum)的繁殖生物学进行了研究,但迄今为止,对瘤背石磺的繁育尚未形成稳定、成熟的技术体系。鉴于此,本试验旨在进一步探索瘤背石磺受精卵的最佳孵化方式、最适培育密度以及其变态所需的最适附着基,进而提高瘤背石磺受精卵的孵化率和幼虫存活率,为深入开展瘤背石磺的人工繁育积累经验。
1 材料和方法
1.1 受精卵的采集和处理
在瘤背石磺自然繁殖季节选择来源于盐城射阳滩涂的规格均一的瘤背石磺性成熟个体作为亲贝,用盐度 5的海水洗净后于养殖箱内暂养驯化并淘汰品质低劣的个体后,采用铺设底泥、搭置瓦片等方式模拟生态环境进行人工饲养[19],期间饲喂拌有海泥的螺旋藻(m: M/5: 1),并通过喷洒适量盐度18海水的方式刺激其交配产卵。每日定时检查养殖箱中瘤背石磺的摄食情况和产卵情况并清洁养殖箱,控制箱内温度(25~28℃)、盐度(10~15)、相对湿度(80%以上)和光照强度(500 lx左右)。若发现产有新鲜卵块,及时用刀片刮取并洗净后用每升0.12万国际单位的庆大霉素浸泡 3 min,再将其置于盐度 18的海水中进行孵化。
1.2 试验材料及处理
孵化框: 取1 cm×1 cm×20 cm的木条若干,每4只木条用钉子制作成正边形木框,再将与木框一样大小的筛绢网(300目)粘到木框的一侧并进行编号,注意木框和筛绢网之间不要留下缝隙,以免造成受精卵不必要的流失。使用前用150 mg/L KMnO4消毒1~3 h。
孵化池: 孵化池与亲贝养殖箱一样,均为体积150 L的长方体聚乙烯塑料箱(长×宽×高为70 cm×50 cm×40 cm),使用前与孵化框一样消毒。
附着基: 准备孔径为1.0~1.2mm和1.2~1.5mm的海绵条,使用前经过煮沸后,再用1~2 mg/L碘海水溶液消毒5~20 min。
藻种培养: 选取小球藻(Chlorella vulgaris)、球等鞭金藻(Isochrysis zhanjiangensis.Hu.var.sp.)和牟氏角毛藻(Chaetoceros muelleri Lemmerman)等藻种进行扩大培养。开口期投喂小球藻、球等鞭金藻和牟氏角毛藻,饵料密度分别为 22万、4.5万和 4.5万个/mL;当受精卵发育至 8~15 d时,每天投喂量分别增加至17万、9万和9万个/mL;以后各期投喂量分别增加至13万、13万和12万个/mL。
1.3 试验设计及日常管理
1.3.1 不同孵化方式对孵化速率的影响
采用3种不同的方式(“喷淋”、“露空”和“梯笼”)进行受精卵的孵化试验。“喷淋”孵化: 将铺有受精卵的孵化框置于含有盐度18海水的孵化池中,同时用水泵抽提海水至水面上方 20 cm处的软管中,软管每隔5 cm开有小孔,从小孔喷出水流淋于卵块表面,模拟自然条件下雨水的作用,刺激卵块发育;“露空”孵化: 将受精卵置于底部垫有若干纱布的孵化框上孵化;“梯笼”孵化: 将铺有受精卵的孵化框一层层叠加,每5个孵化框一组,每组用浸湿的纱布将孵化框包裹好。每天向“露空”孵化组和“梯笼”孵化组喷洒盐度18的海水,使纱布始终保持湿润。每天定时观察各组受精卵的孵化情况,记录发育至相应时期所需时间及形态变化,并及时除去死亡的胚胎。
1.3.2 不同培育密度对存活率的影响
用虹吸法对孵化出膜的幼虫进行选优,并将选优后的幼虫分为两部分,分别移至A孵化池和B孵化池中进行培育。其中A孵化池用于研究培育密度对存活率的影响试验,B孵化池用于研究附着基对幼虫附着效果和存活率的影响试验。搅动A孵化池水体,使幼虫均匀分布,然后分别在5个不同部位吸取水样1 mL,对水样中的幼虫进行镜检计数。根据计数结果从A孵化池量取一定的溶液并转移至玻璃水族缸中,参照前期探索的结果,用盐度 18的海水将其稀释成不同密度梯度,分别为 30、40、50、60、70、80和90个/mL,每个梯度3个重复。每日换水两次(6:00时和18:00时),每次换水1/2,换水前后水温变化幅度低于 1℃,盐度变化幅度低于 2,换水时用300目筛绢网过滤,防止幼虫的流失。换水后适量添加藻液,同时调节水体盐度,使盐度维持在 18左右。每天 6:00时进行镜检,观察记录匍匐期幼虫密度并计算存活率,存活率 = 匍匐幼虫期密度/初始密度×100%。
1.3.3 不同孔径海绵附着基对幼虫附着效果和存活率的影响
从B孵化池中量取适量的溶液,转移至另外的9个孵化池中,用盐度18的海水稀释使其培育密度为50个/mL,将 9个孵化池平均分为 3组,每组 3 个重复,当有15%~20%的幼虫出现眼点时,在随机两组孵化池中分别加入两种不同孔径的体积为 1 cm3的立方体海绵。经前期大量探索发现海绵孔径过低易使其吸水性能差且易浮于水面,因而海绵孔径分别选取1.0~1.2 mm和1.2~1.5 mm两种规格。海绵占孵化池水面的一半,另一组不加海绵。投放海绵后加大换水量,每天换水3次。每天6:00 时进行镜检,观察记录附着情况并计算存活率,存活率 = 匍匐幼虫期密度/20%幼虫出现眼点时密度×100%。
1.3.4 胚胎发育和幼虫发育的观察以及幼虫在各水层分布的变化规律
从受精卵孵化开始至匍匐幼虫期,连续取样观察胚胎发育和幼虫发育状况,记录发育至相应时期所需时间及形态变化,并进行生物拍照。同时,测定各水层中幼虫的数量,探索不同发育时期幼虫在各水层分布的变化规律,以便更好地了解瘤背石磺幼虫的总体发育状况。具体做法: 待水体静止后,用胶头滴管分别吸取孵化池各水层水(表层水、中层水、底层水)1 mL,镜检观察并记录幼虫数量,同一水层随机选取5个不同方位进行测定。
1.3.5 日常管理
胚胎发育和幼虫发育过程中,通过遮光帘调节孵化室内光照,使之维持在500 lx左右。培育期间所用海水均为盐度18,温度25~26 ℃的人工海水,每升水体中添加3 mg EDTA二钠盐,以防止重金属离子在幼虫体内的富集。由于代谢产物长期积累可能影响水质,因此饵料投喂时遵循“少量多次”的原则,并定时对池底进行吸污换水且每5~6 d倒池清底一次,每次换水前仔细检查筛绢网是否磨损,发现破损后及时用胶布粘紧,以防幼虫漏网。另外,每日水体进行连续微量充气并搅动水体4~5次,同时测定水体中的溶解氧(≥ 4.5 mg/L)、氨氮(≤ 0.1 mg/L)和pH(8.0~8.4),保证苗种正常培育。当培育后期水质较差时,在孵化池中加入 0.08万~0.16万单位硫酸庆大霉素/L,防止水中病原菌的过度繁殖。
1.4 数据统计与分析
原始数据经Excel 2007初步整理后,采用SPSS Statistics V17.0中的单因素方差分析对数据进行统计分析,并进行 LSD多重比较。统计结果采用平均值±标准误(Mean ± SE)的形式表示,P<0.05 认为差异显著。
2 试验结果
2.1 不同孵化方式对孵化速率的影响
采用不同的孵化方式对瘤背石磺受精卵(图 1-1)进行孵化,并连续观察受精卵的孵化状态。结果表明,孵化方式不同,瘤背石磺受精卵的孵化速率相差很大。采用“露空”孵化方式和“喷淋”孵化方式孵化时,发育至囊胚期(图1-2)所需的时间基本一致,均为12 h,但采用“梯笼”孵化方式所需时间较长,为 20 h。当受精卵发育至出膜面盘幼虫期(图1-6)时,采用“露空”孵化方式所需时间最短,仅需6 d,采用“梯笼”孵化方式时所需时间最长,需要9 d。受精卵发育至原肠期(图1-3)、“蘑菇幼虫”期(图1-4)、膜内面盘幼虫期(图 1-5)的孵化速率由高到低均依次为“露空”孵化方式、“喷淋”孵化方式和“梯笼”孵化方式(表1)。
2.2 不同培育密度对存活率的影响
由图2可知,在瘤背石磺幼虫培育过程中,幼虫密度对存活率影响显著(P<0.05)。随着孵化池中幼虫密度的升高,幼虫的存活率呈现先上升后下降的趋势。用二次多项式回归模型分析存活率与幼虫密度之间的关系,得到的回归方程为: Y = −0.0679X2+7.8214X − 147.43 (R2= 0.9351)(图 2),当 X =57.59时,瘤背石磺的存活率最高,且当55≤X≤61时,瘤背石磺的存活率均大于 80%,因此瘤背石磺在幼虫培育过程中,培育密度为55~61个/mL时可最大限度提高存活率。
2.3 不同孔径海绵附着基对幼虫附着效果和存活率的影响
由图 3可知,以海绵作为瘤背石磺的附着基时,附着效果良好,且大孔径(1.2~1.5 mm)海绵的幼虫附着能力明显高于小孔径(1.0~1.2 mm)海绵。由图4可以看出,大孔径海绵组的幼虫存活率较高,为 61.8%,显著高于小孔径海绵组的幼虫存活率(P<0.05);同时,添加附着基的两组孵化池中幼虫的存活率均显著高于不添加附着基组的存活率(P<0.05)。
2.4 幼虫在水层分布的变化规律
由图5可知,瘤背石磺受精卵发育至第5天时,表层水中幼虫含量大幅升高,直至第 10天时,幼虫含量显著下降,而此时底层水的幼虫含量开始显著升高,但升高幅度较表层水低,且在第 14天时开始呈下降趋势。对于中层水中幼虫的数量,仅在第5天至第14天时数量变化较为明显,但变动幅度仍相对较小,说明瘤背石磺幼虫一般不在中层水活动。当受精卵发育至第16天后,表层水和中层水中几乎观察不到幼虫,仅可见于底层水中。

表1 不同孵化方式对受精卵孵化速率的影响Tab.1 Effects of different incubation ways on hatching rate of fertilized eggs of O.struma

图1 瘤背石磺受精卵的孵化Fig.1 Hatching of fertilized eggs of O.struma
3 讨论
3.1 不同孵化方式对孵化速率的影响
瘤背石磺受精卵的孵化速率不仅受孵化期间的温度、盐度、湿度以及光照强度等因素影响[20],还与卵群的阴干刺激和新鲜海水刺激密切相关。Smith等[15]报道戴氏石磺从卵裂期至囊胚期发育所需时间仅为6 h,而瘤背石磺受精卵发育至相同时期时所需时间比戴氏石磺长两倍,这可能是因为瘤背石磺与戴氏石磺所处的纬度不同,有一定的温度差异,从而引起的发育速率不同。本试验中“喷淋”孵化虽可模拟自然雨水的冲洗作用,但所需时间较“露空”孵化方式长,其主要原因可能是“露空”孵化方式在孵化过程中温度相对较高,并伴有一定的阴干刺激,因而发育速率较快,这说明新鲜海水刺激方式和阴干刺激方式对瘤背石磺受精卵的孵化具有协同作用。另外,滕炜鸣等[11]对瘤背石磺的滩涂生态繁殖的研究也表明湿润泥土上的幼虫出膜速度要快于水体中,因此可以推断,阴干刺激对促进瘤背石磺受精卵的孵化作用相对较大。对于“梯笼”孵化方式,其孵化速率从受精卵开始分裂时就显著低于“露空”孵化和“喷淋”孵化,这可能是因为孵化框叠加后,单位空间内受精卵的密度相对较高,从而产生环境胁迫作用,同时其释放的代谢产物不断累积,污染了孵化环境,从而使受精卵孵化速率明显降低。
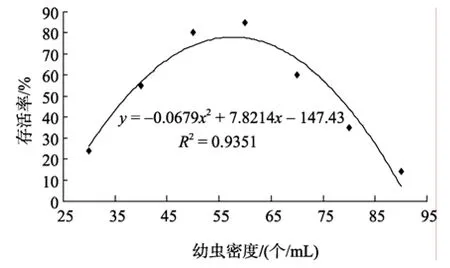
图2 不同培育密度对存活率的影响Fig.2 Effect of different nurture density on the survival rate of larvae hatched

图3 不同孔径海绵附着基附着的幼虫数量Fig.3 The amount of larvae attached to different pore size sponge

图4 不同附着基对存活率的影响Fig.4 Effect of different pore size sponge on the survival rate of larvae hatched

图5 瘤背石磺幼虫在水层中的变化规律Fig.5 The variation of larvae distribution in the water layer
3.2 不同培育密度对存活率的影响
众所周知,密度因子对幼虫培育产生的影响主要表现在两个方面: 一是个体之间直接对空间和食物的竞争;二是影响环境,环境因子又反作用于自身[21],从而对幼虫生长速率、存活率、变态率和存活率等产生影响。赵越等[22]对四角蛤蜊的研究结果显示幼虫的存活率和变态率随着培育密度的增大而降低,发育时间随着密度的增加而延长,本试验与此基本一致。周琳等[23]对青蛤的研究表明其培育密度为6~11个/mL时孵化率最高,生长速率最快;闫喜武等[24-25]对长竹蛏和菲律宾蛤仔以及李华林等[26]对长牡蛎等的研究结果显示,其最适的幼虫培育密度分别为5~10个/mL、6~10个/mL和6~12个/mL,由此可以看出双壳类幼虫培育的最适密度为 6~10个/mL左右。但瘤背石磺幼虫存活率最高时的培育密度与此相差较大,为57.59个/mL左右,显著高于其他贝类的幼虫培育密度,这可能是因为刚出膜的瘤背石磺幼虫卵黄粒充满贝壳,其生物量相对较低;同时其幼虫与方斑东风螺和糙海参等幼虫相比相对偏小(瘤背石磺自由生活面盘幼虫平均壳长×壳高为180.2 μm×177.2 μm[7];方斑东风螺刚出膜幼虫壳长428.7 μm±10.6 μm[27];糙海参初耳幼体体高 350~420 μm[28]),使其耗氧率降低,且在瘤背石磺幼虫培育过程中,及时换水并清除孵化池中的代谢废物,消除了环境胁迫对幼虫影响,从而使培育密度可以达到较高水平。
3.3 不同孔径海绵附着基对幼虫附着效果和存活率的影响
贝类幼虫经过附着变态后,其外部形态、内部构造、生理机能和生活习性等方面都发生了相当大的变化。在附着变态过程中不仅需要消耗大量的能量、适宜的附着基,更重要的是寻找到附着基的时机,一般瘤背石磺眼点出现时,幼虫出现运动迟缓现象,当有 15%~20%眼点出现时即是附着基投放的最佳时机。影响幼虫附着变态的因素很多,主要有生物因子(如幼虫行为)、物理因子[29-31](温度、盐度等)、化学因子[32](如同种个体分泌物)以及微生物膜[33]等。金春华等[12]研究了不同附着基对瘤背石磺幼虫的附着效果,结果显示悬浮球和六角蜂窝对瘤背石磺幼虫的附着效果最好。本试验采用不同孔径的海绵作为附着基,发现大孔径(1.2~1.5 mm)海绵对瘤背石磺幼虫的附着效果较好,其最终存活率可达到 61.8%,显著高于添加小孔径(1.0~1.2 mm)海绵的孵化池的幼虫存活率。这说明大孔径海绵表面更能使瘤背石磺幼虫产生适应性,或者说瘤背石磺幼虫对大孔径海绵的表面结构更具有敏感性,促使其体内分泌有关激素,诱导幼虫完成变态过程。同时,大孔径海绵附着的幼虫多,其分泌的能够诱导同种幼虫附着的分泌物也较多,从而产生了“群聚行为”,诱导更多的幼虫附着变态。另外,大孔径海绵所具有的有效表面积较大,吸湿性较好,更利于幼虫的附着,从这方面看,大孔径海绵的附着效果较小孔径海绵的好。
3.4 幼虫在水层分布的变化规律
贝类浮游幼虫在水体中的垂直变化规律主要与趋光性、饵料分布等因素有关。瘤背石磺同其他腹足纲贝类一致[34],其幼虫具有阶段浮游性,面盘幼虫期贝壳形成开始,瘤背石磺幼虫的浮游能力减弱,面盘开始退化,足开始发育,幼虫逐渐由浮游生活转变为匍匐生活、正趋光性转变为负趋光性,由此形成幼虫由表层水向底层水转移的现象。对于中层水中的幼虫数量,变动幅度相对较小且无规律,这可能是由于中层水中幼虫数量的变化只是大量幼虫在表层水中活动的结果,当幼虫数量较少时,并不会出现在中水层。因此,瘤背石磺幼虫在水层中的变化规律与幼虫的发育时期密切相关,掌握瘤背石磺幼虫的水层分布状况对瘤背石磺的幼虫发育状况、提高瘤背石磺幼虫成活率具有重要辅助作用。
4 结论
综上所述,“露空”孵化方式能显著缩短瘤背石磺受精卵孵化所需时间,从而验证了阴干刺激和新鲜海水刺激对瘤背石磺受精卵的孵化具有协同作用。其次,瘤背石磺幼虫期的最适培育密度与其他贝类相比差别较大,为55~61个/mL。同时,在幼虫附着变态时期,幼虫对大孔径海绵附着基敏感性较强,附着效果较好,存活率较高。另外,瘤背石磺幼虫在水层中的分布变化与幼虫的发育时期具有一致性,观察幼虫的水层分布情况能够更准确的预测幼虫发育状况。
[1]黄金田.瘤背石磺及其物种保护[J].水产养殖,2005,26(6): 40-41.
[2]黄金田,王爱民.瘤背石磺营养成分分析及品质评价[J].海洋科学,2008,32(11): 29-35.
[3]沈和定,陈汉春,陈贤龙,等.几种饲料对石磺的暂养效果及其消化率的初步研究[J].上海水产大学学报,2004,13(4): 293-297.
[4]王金庆,成永旭,吴旭干,等.瘤背石磺的形态、习性和生殖行为[J].动物学杂志,2005,40(1):32-40.
[5]Deshpande U D,Nagabhushanam R,Hanumante M M.Reproductive ecology of the marine pulmonate,Onchidium verruculatum[J].Hydrobiologia,1980,83-85.
[6]黄金田,沈伯平,王资生.瘤背石磺的生态习性观察[J].海洋渔业,2004,26(2):103-109.
[7]沈和定,陈汉春,陈贤龙,等.石磺繁殖生物学的实验研究[J].水产学报,2006,30(6):753-769.
[8]Hatsuo H,Satoru I.Chaotic nature of bursting discharges in the Onchidium pacemaker neuron[J].Journal of Theoretical Biology,1992,156(3): 269-291.
[9]沈和定,陈贤龙,陈汉春,等.水温对石磺胚胎发育的影响[J].水产学报,2005,29(6): 776-782.
[10]沈和定,陈汉春,陈贤龙,等.盐度对石磺胚胎发育的影响[J].上海水产大学学报,2006,15(3): 297-302.
[11]滕炜鸣,吴旭干,唐伯平,等.瘤背石磺滩涂生态繁殖的初步研究[J].海洋渔业,2007,29(3): 214-219.
[12]金春华,郑忠明,华建权,等.瘤背石磺人工繁育关键技术的研究[J].水产科学,2010,29(10): 597-600.
[13]王金庆,成永旭,吴旭干,等.瘤背石磺的胚胎和幼虫发育[J].上海水产大学学报,2005,14(2): 108-115.
[14]Ruthensteiner B,Schaefer K.The cephalic sensory organ in veliger of pulmonates (Gastropoda: Mollusca)[J].Journal of Morphology,2002,251(1): 93-102.
[15]Smith A,Kenny R.Reproduction and development of Onchidium dameliiSemper[J].J Malac Soc Aust,1987,8: 37-39.
[16]Deshpande U D,Nagabhushanam R,Hanumante M M.Reproductive ecology of the marine pulmonate,Onchidium verruculatum[J].Hydrobiologia,1980,71:83-85.
[17]Deshpande U D,Nagabhushanam R.Annual reproductive cycle of the marine pulmonate,Onchidium verruculatum (Cuvier)and its control by environmental factors[J].Indian Journal of Marine Sciences,New Delhi,1983,12(2): 122-124.
[18]Nanaware S G,Gonjari G R.Studies on the reproductive physiology of molluscs: 6 Histochemical observations on the mucosubstances of spermatheca of marine slug Onchidium verruculatum(Cuv.)[J].Comparative Physiology and Ecology,1989,14(3): 149-154.
[19]黄金田,张余霞.瘤背石磺室内温箱养殖试验[J].海洋科学,2004,28(10): 14-16.
[20]包永波,尤仲杰.几种环境因子对海洋贝类幼虫生长的影响[J].水产科学,2004,23(12): 39-41.
[21]李长松,房斌,王慧,等.青蛤稚贝放养密度与地质中硫化物相关性研究[J].水产学报,2006,30(6):796-800.
[22]赵越,王金海,张丛尧,等.培育密度及饵料种类对四角蛤蜊幼虫生长、存活及变态的影响[J].水产科学,2011,30(3): 160-163.
[23]周琳,于业绍,陆平,等.青蛤受精卵和幼虫密度对孵化和生长的影响[J].海洋渔业,1999,21(4):157-159.
[24]闫喜武,赵生旭,张澎,等.培育密度及饵料种类对大竹蛏幼虫生长、存活及变态的影响[J].大连海洋大学学报,2010,25(5): 386-390.
[25]闫喜武.菲律宾蛤仔养殖生物学、养殖技术及品种选育[D].青岛: 中国科学院海洋研究所,2005.
[26]李华琳,李文姬,张明.培育密度对长牡蛎面盘幼虫生长影响的对比试验[J].水产科学,2004,23(6):20-21.
[27]吴进锋,陈利雄,张汉华,等.2种东风螺繁殖及苗种生长发育的比较[J].南方水产,2006,2(1): 39-42.
[28]严俊贤,王世峰,周永灿,等.糙海参胚胎和幼体发育的形态观察[J].水产学报,2012,36(7): 1073-1080.
[29]Bonar D B,Coon S L.Control of oyster settlement and metamorphosis by Endogenous and exogenous chemical cues[J].Bull of Mart Sci,1990,46(2): 454-495.
[30]Barker S M,Mann R.Effect of hyPoxia and anoxia on larval Settlement juvenile growth,and juvenile survival of the oyster Crassostrea virginica[J].Biol Bull,1992,182: 265-269.
[31]Parsons G J,M J Dadswell M J,Roff J C.Influence of biolfilm on settlement of Sea seallop,Plaeopeeten magellanieus (Gmelin,1791)in Passamaquoddy bay,new brunswieh,Canada[J].J Shellfish Res,1993,12(2):279-283.
[32]Rodriguez S R,Ojeda F P,Inestrosa N C.Settlement of benthic marine Invertebrates[J].Marine Ecology Progress Series,1993,97: 193-207.
[33]Hadfield M G.Settlement and recruitment of marine invertebrates: a PersPective and some ProPosals[J].Bull of Mari Sci,1986,39(2): 418-425.
[34]黄渤,邓中日,王小兵,等.中国海耳鲍胚胎发育特征[J].海洋科学,2007,31(4): 68-72.
