卡培他滨治疗肿瘤引起手足综合征的Meta分析
2013-06-12蒲绘华王洪源
蒲绘华 王洪源 *
(北京大学公共卫生学院,北京 100191)
卡培他滨治疗肿瘤引起手足综合征的Meta分析
蒲绘华 王洪源 *
(北京大学公共卫生学院,北京 100191)
目的 对卡培他滨治疗肿瘤引起手足综合征的系统综述,评估卡培他滨引起手足综合征的发生情况。方法 根据关键词检索出文献共 689 篇,纳入 21 篇文献进行系统评价。结果 针对手足综合征,以相对危险度 LnRR 为效应指标进行系统评价,与对照组相比,不同给药方案的卡培他滨引起手足综合征的风险不同,以 RD 为分析指标与 LnRR 得到的结果相同。结论 与对照组相比,Meta 分析结果显示卡培他滨不同给药方案发生手足综合征的风险不同。
卡培他滨或希罗达;手足综合征或掌跖红斑样变手足皮肤反应
临床常用的氟尿嘧啶类抗肿瘤药物有5-氟尿嘧啶(5-FU),其通过静脉滴注或动脉灌注给药,常见的不良反应为胃肠道毒性和骨髓抑制及注射部位的局部刺激性[1],卡培他滨是一种口服氟尿嘧啶类药物,主要不良反应为恶心,呕吐,腹泻,手足综合征(HFS),口腔炎等,HFS虽不会危及生命,但易导致停药或减量[2],妨碍化疗正常进行,影响患者的生活质量[3]。国内外已有卡培他滨引起HFS的相关报道和防治研究,但没有对其发生风险进行正式评估,因此进行本研究,以确定卡培他滨相关的HFS的发生情况,为临床和科研提供参考数据。
1 资料与方法
1.1 文献检索
根据关键词检索PubMed数据库[(1995~2012),检索式:(Capecitabin OR Xeloda OR Xelodar) AND (Hand Foot Syndrome OR Palmar Plantar Erythrodysesthesia Syndrome or Hand Foot Skin Reaction),Cochrane图书馆,CNKI,CBMDisc,万方和维普数据库。采用1995年至2012年6月的文献。对已检索文献的参考目录进行回顾,以获取更多文献。
1.2 文献筛选
纳入标准:①卡培他滨单药或联合其他化疗/靶向治疗为其中一个治疗组的随机对照试验或非随机对照试验,5-FU单药或5-FU联合其他化疗为对照组,并有足够的安全性数据;②适应证为肿瘤;③数据报告包括治疗组及对照组例数;④给药方案包括治疗药物,剂量及治疗周期;⑤有终点观察结果:HFS的发生例数或百分比。排除标准:①重复发表的文献,保留总报告,排除分报告;连续发表的文献,保留末次发表的文献;②排除卡培他滨联合其他氟尿嘧啶类药物或联合其他已证实易导致HFS的药物(多柔比星,环磷酰胺,长春瑞滨和多西他赛)或联合其他已证实易导致手足皮肤反应的药物(索拉非尼和舒尼替尼)的文献;③排除治疗期间针对HFS进行干预的文献,如涂抹尿素霜等;④排除联合放疗,免疫治疗,中医药治疗的文献。
1.3 文献的质量评价与资料提取
随机对照试验采用改良后的Jadad评价方法进行质量评估;非随机对照试验采用质量指数(Quality Index,又称Downs & Black清单)进行质量评估。摘录内容包括:给药方案,给药时间和肿瘤类型,受试者中位年龄,体能状况评分,HFS发生例数或发生率。
1.4 统计分析
用STATA 12.0完成统计分析,以相对危险度(RR)为Meta分析的效应指标。①计算各研究的效应值,效应值的方差及权重;②采用DerSimonian and Laird法对效应值进行齐性检验;③根据齐性检验的结果,不存在异质性,用固定效应模型;如存在异质性,探讨异质性来源:以肿瘤类型和给药方案为指标进行亚组分析,以患者中位年龄,区域,肿瘤类型,给药方案和治疗时间为指标进行Meta回归;如仍无法解决异质性,用随机效应模型。④采用Begg’s test 和绘制漏斗图的方法考察发表偏性;⑤当存在发表偏性时采用Trim and Fill法对合并效应值进行估计。
2 结 果
2.1 纳入文献概况
共检索到689篇,初筛出41篇文献进行全文精读,按照入选和排除标准,排除不合格文献14篇,最终纳入meta分析的共21篇文献,包括18项随机对照试验和3项非随机对照试验,见表1。
2.2 数据分析
2.2.1 效应值齐性检验
计算效应值LnRR,效应值的标准误和权重,经齐性检验,发现χ2=107.38,P<0.001,存在异质性。按肿瘤类型,分乳腺癌组,结直肠癌组和胃癌组,齐性检验结果分别为χ2=0.80,P=0.671; χ2=78.26,P<0.001;χ2=2.81,P=0.422;结直肠癌组P<0.05,仍存在异质性;按给药方案,分为单药和联合方案组,结果分别为χ2=10.66,P=0.059和χ2=29.26,P=0.010;联合方案组P<0.05,仍存在异质性。
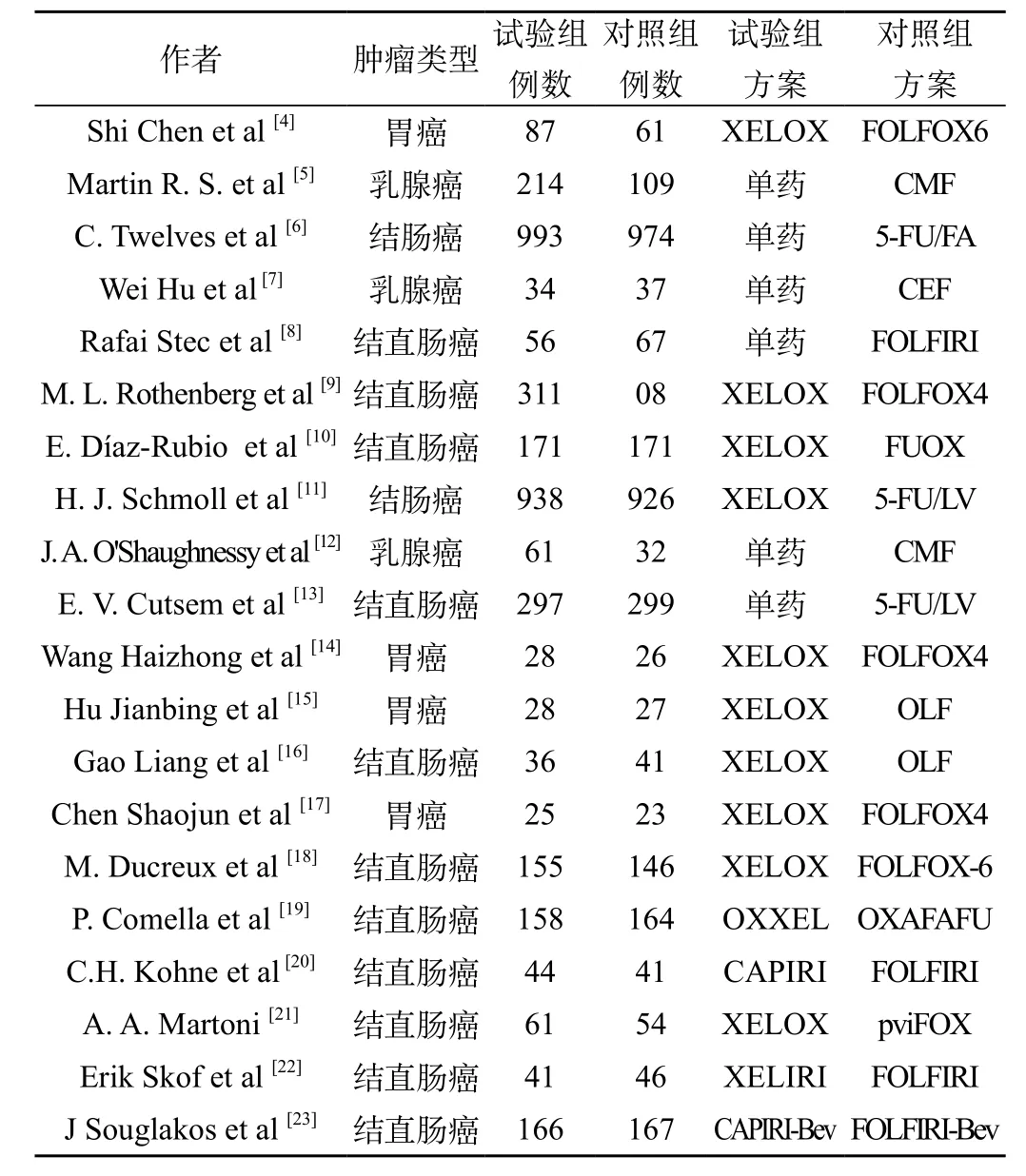
表1 纳入Meta分析的文献特征
2.2.2 合并效应值
肿瘤类型分组时方差不齐,仍存在异质性,用随机效应模型分析。胃癌组LnRR为10.586,95% CI(4.553,24.615);结直肠癌组LnRR为3.364,95%CI(2.458,4.605);乳腺癌组LnRR为20.603,95%CI(8.660,49.015)。经u检验,三组P值均<0.05,说明卡培他滨治疗胃癌,结直肠癌或乳腺癌时引起HFS的发生率与对照组的差异有显著性。
给药方案分组时方差不齐,仍存在异质性,用随机效应模型分析,卡培他滨联合方案LnRR为2.949,95% CI(2.309,3.765);单药方案LnRR为8.919,95%CI(5.542,14.353)。经u检验,两组P均<0.05,说明卡培他滨采用联合或单药方案引起HFS的发生率与对照组的差异有显著性。
发表偏性检验,绘制漏斗图发现对称性较好,并采用Begg’s检验对纳入的研究进行出版偏性的检验,Z=1.54(continuity corrected),Pr>|z|=0.124 (continuity corrected),说明收集的文献不存在发表偏性,见图1。
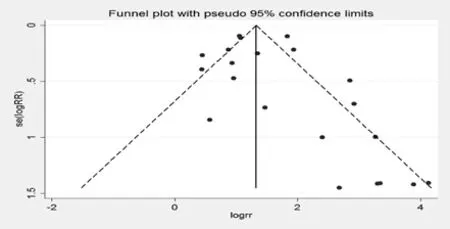
图1 卡培他滨治疗肿瘤引起手足综合征的漏斗图
2.2.3 Meta回归的分析结果
以效应值LnRR为因变量,将患者中位年龄,区域,肿瘤类型,给药方案和给药时间拆分为哑变量进行Meta回归,在不同患者中位年龄,不同肿瘤类型和不同给药时间,卡培他滨治疗肿瘤引起HFS的LnRR在各组之间,差异无显著性,P值分别为:0.597,0.708和0.383,均>0.05;在不同给药方案之间,与对照组相比较,卡培他滨引起HFS的发生风险不同(P=0.002)。
3 讨 论
因卡培他滨最早于1998年上市,故检索采用上市前3年至今的相关文献,检索较全面;分析评价的指标是不良反应,但不是最被关注的致命不良反应,被隐蔽的机会少。本研究仅针对中文及英文文献,非英语及非中文文献未收录可能造成因收录不全引起的结果偏倚;本研究针对肿瘤的治疗涉及一线,二线,新辅助和辅助治疗多种情况,肿瘤的类型也较多,各组合缺乏一定数量的原始文献,无法进行细分;本研究从试验所在区域进行分析,但纳入的亚洲区域的文献均来自中国,且仅有3篇,数量有限,因此不同区域对卡培他滨引起HFS的风险是否有显著差异,有待于进一步的研究。
4 结 论
不同给药方案发生HFS的风险不同。
[1]Chabner BA,Lynch TJ Jr,Longo DJ.HARRISON’S Manual of Oncology[M].The McGraw-Hill Companies,Inc,2008.
[2]Aru WS.The Use of Capecitabine in Cancer:Management of the Hand Foot Syndrome[J].Acta Med Indones,2005,37(3):174-176.
[3]Lassere Y,Hoff P.Management of hand-foot syndrome in patients treated with capecitabine (Xeloda)[J].Eur J Oncol Nurs,2004,8(Suppl 1):S31-S40.
[4]Chen S,Feng X,Li Y,et al.Efficacy and safety of XELOX and FOLFOX6 adjuvant chemotherapy following radical total gastrectomy[J].Oncol Lett,2012,3(4):781-786.
[5]Stockler MR,Harvey VJ,Francis PA,et al.Capecitabine versus classical cyclophosphamide, methotrexate,and fluorouracil as first-line chemotherapy for advanced breast cancer[J].J Clin Oncol,2011,29(34):4498-4504.
[6]Twelves C,Scheithauer W,McKendrick J,et al.Capecitabine versus 5-fluorouracil/folinic acid as adjuvant therapy for stage III colon cancer:final results from the X-ACT trial with analysis by age and preliminary evidence of a pharmacodynamic marker of efficacy[J].Ann Oncol,2012,23(5):1190-1197.
[7]Hu W,Shi J,Sheng Y,et al.Clinical study of adjuvant capecitabine monotherapy in Chinese elderly patients (aged 55-70) with stage IIa breast cancer[J].Onkologie,2010,33(8/9):433-436.
[8]Stec R,Bodnar L,Szczylik C.Feasibility and efficacy of capecitabine and FOLFIRI in patients aged 65 years and older with advanced colorectal cancer:a retrospective analysis[J].J Cancer Res Clin Oncol,2010,136(2):283-392.
[9]Rothenberg ML,Cox JV,Butts C,et al.Capecitabine plus oxaliplatin(XELOX) versus 5-fluorouracil/folinic acid plus oxaliplatin (FOLFOX-4) as second-line therapy in metastatic colorectal cancer:a randomized phase III noninferiority study[J]. Ann Oncol,2008,19(10):1720-1726.
[10]D íaz-Rubio E,Tabernero J,G ó mez-Espa ñ a A,et al.Phase III study of capecitabine plus oxaliplatin compared with continuous-infusion fluorouracil plus oxaliplatin as firstline therapy in metastatic colorectal cancer:final report of the Spanish Cooperative Group for the Treatment of Digestive Tumors Trial[J].J Clin Oncol,2007,25(27):4224-4230.
[11]Schmoll HJ,Cartwright T,Tabernero J,et al.Phase III trial of capecitabine plus oxaliplatin as adjuvant therapy for stage III colon cancer:a planned safety analysis in 1,864 patients[J].J Clin Oncol,2007,25(1):102-109.
[12]Oshaughnessy JA,Blum J,Moiseyenko V,et al.Randomized,openlabel,phase II trial of oral capecitabine (Xeloda) vs.a reference arm of intravenous CMF(cyclophosphamide,methotrexate and 5-fluorouracil) as first-line therapy for advanced/metastatic breast cancer[J].Ann Oncol,2001,12(9):1247-1254.
[13]Van Cutsem E,Twelves C,Cassidy J,et al.Oral capecitabine compared with intravenous fluorouracil plus leucovorin in patients with metastatic colorectal cancer:results of a large phase III study[J].J Clin Oncol,2001,19(21):4097-4106.
[14]王海忠,王湘辉,吕志诚.XELOX与FOLFOX4方案治疗进展期胃癌的随机对照临床研究[J].现代肿瘤医学,2010,18(5):947-950.
[15]胡建兵,文芳,翁 洁.XELOX和OLF方 案 治疗晚期胃癌的随 机 对照临床研究[J].中国实用医药,2009,4(15):25-26.
[16]高亮,王永向,卢丽琴,等.卡培他滨 联合方案治疗老年晚期结直肠癌的临床研究[J].中国医师进修杂志(综合版),2008,31(8):20-23.
[17]陈 绍 俊 ,黄 海 欣 ,李 桂 生.卡 培 他 滨 与 氟 尿 嘧 啶/亚叶 酸 钙 联 合奥沙利铂治疗晚期胃癌的随机对照临床研究[J].中国癌症杂志,2007,17(6):483-486.
[18]Ducreux1 M,Bennouna J,Hebbar M,et al.Capecitabine plus oxaliplatin (XELOX) versus 5-fluorouracil/ leucovorin plus oxaliplatin (FOLFOX-6) as first-line treatment for metastatic colorectal cancer[J].Int J Cancer,2011,128(3):682-690.
[19]Comella P,Massidda B,Filippelli G,et al.Randomised trial comparing biweekly oxaliplatin plus oral capecitabine versus oxaliplatin plus i.v. bolus Xuorouracil/ leucovorin in metastatic colorectal cancer patients:results of the Southern Italy Cooperative Oncology study 0401[J].J Cancer Res Clin Oncol,2009,135(2):217-226.
[20]Kohne CH,De Greve J,Hartmann JH,et al.Irinotecan combined with infusional 5-fluorouracil/ folinic acid or capecitabine plus celecoxib or placebo in the first-line treatment of patients with metastatic colorectal cancer.EORTC study 40015[J].Ann Oncol,2008,19(5):920-926.
[21]Martonia AA,Pinto C,Di Fabio F,et al.Capecitabine plus oxaliplatin(xelox) versus protracted 5-fluorouracil venous infusion plus oxaliplatin (pvifox) as first-line treatment in advanced colorectal cancer:A GOAM phase II randomised study (FOCA trial)[J].Eur J Cancer,2006,42(18):3161-3168.
[22]Skof E,Rebersek M,Hlebanja Z,et al.Capecitabine plus Irinotecan (XELIRI regimen) compared to 5-FU/LV plus Irinotecan (FOLFIRI regimen) as neoadjuvant treatment for patients with unresectable liver-only metastases of metastatic colorectal cancer:a randomised prospective phase II trial[J].BMC Cancer,2009,9:120.
[23]Souglakos J,Ziras N,Kakolyris S,et al.Randomised phase-II trial of CAPIRI (capecitabine, irinotecan) plus bevacizumab vs FOLFIRI (folinic acid,5-fluorouracil,irinotecan) plus bevacizumab as firstline treatment of patients with unresectable/metastatic colorectal cancer (mCRC)[J].Br J Cancer,2012,106(4):453-459.
Capecitabine-Induced Hand Foot Syndrome: A Meta-analysis
PU Hui-hua, WANG Hong-yuan (Peking University School of Public Health, Beijing 100191, China)
ObjectiveThe purpose of the study was to conduct a Meta-analysis to focus on hand-foot syndrome (HFS) for Capecitabine in treatments of cancers.MethodsA comprehensive literature search identified 689 articles published from 1995 to 2012 with key words. Total 21 eligible articles entered the meta-analysis.ResultThe risks of HFS induced by capecitabine in different treatment regimens were different.The result by RD was the’ same. Among different tumors,median ages and treatment duration,HFS induced by capecitabine was not significantly different.ConclusionCompared with controlled arm,different capecitabine containing regimens had different potential to induce HFS.
Capecitabine OR Xeloda OR Xelodar; Hand Foot Syndrome OR Palmar Plantar Erythrodysesthesia Syndrome or Hand Foot Skin Reaction
R73
:B
:1671-8194(2013)05-0031-03
*通讯作者:
