c-Jun氨基端激酶对亚急性帕金森病小鼠黑质神经元凋亡的影响
2013-05-29杨国海张宇新张作凤河北联合大学解剖学教研室河北唐山063000
刘 江 李 冉 李 磊 杨国海 张宇新 张作凤 (河北联合大学解剖学教研室,河北 唐山 063000)
帕金森病(PD)是一种常见的中老年人神经系统变性疾病,其主要病理改变是中脑黑质多巴胺(DA)能神经元变性缺失。迄今为止,PD的发病机制仍不清楚。有研究认为,c-Jun氨基端激酶(JNK)可能与PD发病机制密切相关〔1,2〕。本研究采用 1-甲基-4-苯基-1,2,3,6-四氢吡啶(MPTP)制备 PD 小鼠模型,观察模型动物中脑黑质磷酸化c-Jun(p-c-Jun)与dUTP缺口标记技术(TUNEL)阳性神经元数量的关系,以及给予JNK特异性抑制剂SP600125对上述指标的影响,探讨JNK通路在MPTP诱导的黑质神经元凋亡中的可能作用,为制定有效的PD防治策略提供线索。
1 材料与方法
1.1 材料
1.1.1 主要试剂 MPTP(Sigma,USA),兔p-c-Jun单克隆抗体(Ser63,Cell Signaling Technology,USA),预染蛋白 Marker(天津灏洋生物),TUNEL试剂盒(美国IBM 公司)。
1.1.2 实验动物 健康雄性C57BL/6N小鼠45只(购于北京维通利华实验动物技术有限公司〔SCXX(京)2002-0003〕),6~8周龄,体质量18~23 g,清洁级(SPF),饲养于华北煤炭医学院人体解剖学实验室动物房,自由进食饮水,室温(25±2)℃,单笼喂养,自然光照,饲养1 w后进行实验。
1.2 方法
1.2.1 分组和MPTP小鼠PD模型制备 取C57BL/6N小鼠45只随机分成模型组、JNK抑制剂组和对照组,每组15只小鼠。①模型组:腹腔注射MPTP(30 mg/kg,盐水溶),1次/d,连续5 d;②JNK抑制剂组:在MPTP注射前6~8 h经侧脑室注射SP600125(30 μg/5 μl,溶于 10 g/L DMSO);③对照组:注射与模型组和抑制剂组等体积的生理盐水和10 g/L DMSO。于每次注射药物后观察小鼠行为变化,以判断PD模型是否成功。
1.2.2 标本采集 分别于末次注射后24 h以20%乌拉坦麻醉,经左心室生理盐水灌洗后,再行4%多聚甲醛磷酸盐缓冲液灌注固定,迅速开颅取脑,4%多聚甲醛后固定48 h(4℃),石蜡包埋、切片。用于免疫印迹法检测的动物,取黑质置于4℃预冷的全细胞裂解液0.6 ml冰水浴中匀浆,12 000 r/min 4℃离心5 min,取上清液。以考马斯亮蓝 G 250结合法蛋白定量,-80℃保存备用。
1.2.3 组织学检查 切片行苏木素-伊红(HE)染色,光镜下(×400)观察缺血侧皮质区病理改变。
1.2.4 免疫组织化学检测 脑组织切片常规脱蜡至水后,用Tris盐酸缓冲液(TBST)(pH 7.4±0.2)洗3次,每次3 min;组织抗原行水浴法热修复;30 ml/L过氧化氢阻断内源过氧化物酶,TBST洗3次;用正常非免疫动物血清室温孵育10 min;同一组织相邻切片加入兔p-c-Jun单克隆抗体(1∶100),4℃过夜;TBST洗3次后,加入生物素标记第二抗体室温孵育20 min;TBST洗3次,加入链霉素抗生物素蛋白-过氧化酶室温孵育20 min,二氨基联苯胺(DAB)显色,中性树胶封固,所有切片在同一条件下采用Motic Med 6.0数码医学图像分析系统分析其平均光密度值。
1.2.5 TUNEL染色检测凋亡细胞 按原位细胞凋亡检测试剂盒提供的实验步骤进行,DAB显色。细胞核中有黄褐色颗粒者为TUNEL阳性细胞。于光镜下(×200)随机计数阳性细胞数,与形态学分类作为分析对象进行比较。
1.2.6 免疫蛋白印迹检测 蛋白定量后加入4倍体积样本缓冲液,95℃变性5 min。取20μg样品在10%十二烷基硫酸钠聚丙烯酰胺凝胶上电泳,电转至硝酸纤维素膜,加入p-c-Jun单抗(1∶200)4℃过夜,TBST冲洗后,分别与生物素标记的羊抗兔/小鼠IgG抗血清(1∶200)室温震荡孵育2 h,TBST洗涤后,与卵白素-辣根过氧化物酶复合物室温下孵育0.5 h,DAB显色。将特异性蛋白条带用扫描仪扫描,在同一条件应用CMIAS真彩医学图像分析系统测定条带平均灰度值。
1.3 统计学方法 应用SPSS12.0统计软件进行分析,实验结果以±s表示,两指标间相关性用简单相关分析。
2 结果
2.1 PD模型小鼠行为学变化 对照组未出现任何行为学变化;模型组小鼠于MPTP首次注射20 min后,均出现不同程度的震颤、竖毛、弓背、翘尾、活动减少、动作变慢等症状,四肢肌张力增高,协调性差,并伴有烦躁、呼吸急促等精神症状;抑制剂组与模型组比较上述行为学症状明显减轻。
2.2 中脑黑质区组织病理学结果 对照组小鼠中脑黑质区神经元排列整齐,神经元结构完整,未见异常改变。与对照组比较,模型组正常神经元数目相对减少,少数神经元胞质肿胀,部分神经元胞体皱缩,胞质强嗜酸性、核固缩深染,细胞呈杆状或三角形外观,周边空泡形成,细胞间隙显著增宽。与模型组比较,抑制剂组变性坏死神经元减少。
2.3 免疫组化检测结果 对照组黑质区仅见微量的p-c-Jun表达于胞质。与对照组比较,模型组p-c-Jun免疫反应阳性增强,且主要表达于细胞核内(P<0.05);与模型组比较,抑制剂组p-c-Jun表达下调,且部分表达于胞质(P<0.05)。见表1。
2.4 TUNEL法检测结果 对照组仅有少量TUNEL阳性细胞。与对照组相比,模型组TUNEL染色阳性细胞数显著升高(P<0.05);与模型组相比,抑制剂组TUNEL阳性细胞数明显降低(P<0.05)。见表1,图1。
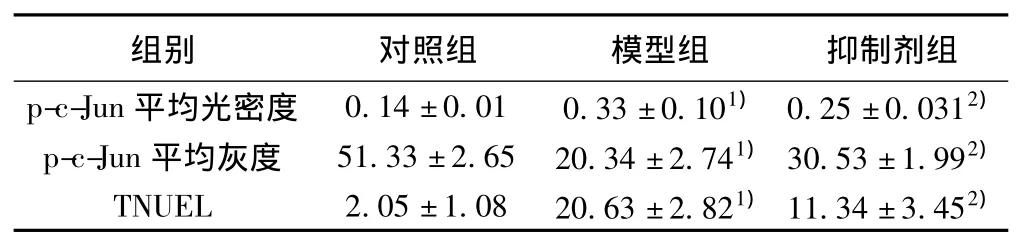
表1 三组p-JNK平均光密度、灰度分析和TUNEL阳性细胞数量(x ± s,n=6)
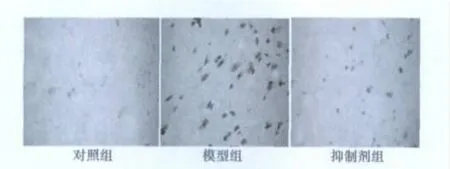
图1 TUNEL法检测结果(×200)
2.5 免疫蛋白印迹法检测结果 在预染蛋白标准约Marker 46 000~48 000处,可见p-c-Jun特异性蛋白条带。灰度分析发现,对照组仅有微量p-JUK蛋白表达;模型组p-JUK蛋白表达增强(P<0.05);与模型组相比,抑制剂组p-JUK表达降低(P<0.05)。见表1。
2.6 相关性分析 p-JUK免疫反应性与TUNEL阳性细胞数呈正相关(r=0.825,P <0.05)。
3 讨论
目前,PD发病的确切机制仍不清楚,尚缺乏有效的、针对性的治疗方法,研究证实细胞凋亡可能在PD发病过程中起重要作用〔3〕。凋亡存在于胚胎神经元的早期发育过程和接受广泛刺激的多种细胞系中,在各种神经退行性疾病中也广泛存在。JNK通路的活化可导致神经性萎缩和死亡,此过程和神经退行性疾病如PD密切相关〔4〕,在MPTP诱导的PD小鼠模型以及在PD病人死后的尸检中,均可以检测到活化的JNK。基因敲除实验亦表明,敲除JNK2、JNK3的小鼠比野生型小鼠更能抵制MPTP的毒性〔5〕。另外,MPTP应用到小鼠黑质纹状体系统中,可使p-JNK和丝裂原活化蛋白激酶4(MKK4)水平分别提高2.5~5倍,JNK抑制剂CEP1347可抑制MPTP介导的MKK4和JNK信号,从而减少DA能神经元的丧失,表明JNK通路参与并促进PD引发的凋亡样细胞死亡。因此,抑制JNK信号通路可望成为治疗PD的一个治疗靶点。本实验中,模型组小鼠黑质p-c-Jun阳性细胞显著增加并核内表达,同时伴有行为学异常、中脑黑质区组织病理学改变及TUNEL表达增高,提示p-c-Jun及其后续级联反应可能与DA能神经元凋亡存在密切关系。研究证实,在上游激活物的作用下,JNK的氨基末端可被磷酸化而激活,激活的p-JNK可使转录因子c-Jun氨基末端磷酸化,使p-c-Jun进入核内影响基因的表达调控〔6〕,从而参与应激或病理刺激引起的细胞凋亡过程。Hunot等〔7〕报道在PD模型动物p-c-Jun显著升高并有时间依赖性,MPTP处理后12 h发生核转位;JNK特异性抑制剂可以减弱MPTP导致的黑质DA能神经元丢失。本课题组前期实验业已证明,MPTP诱导的PD模型小鼠黑质区存在p-c-Jun显著活化,给予人参皂甙治疗后,其表达减少,小鼠行为学症状得到改善〔8〕。p-c-Jun免疫反应性与TUNEL阳性细胞数呈正相关,进一步证实本实验复制的PD模型中p-c-Jun的活化与细胞凋亡可能存在着内在的联系。由此可以推测,当细胞接受上游信号刺激后,黑质神经元产生了应激反应,这种信号由细胞膜上的第一信使传入细胞内,继之由胞内信号转导系统如JNK传入胞核,引起细胞转录一系列反应。
本实验观察到,SP600125可以阻抑p-c-Jun活化及由此引发的细胞凋亡。在抑制剂组逆转黑质细胞p-c-Jun核移位,黑质区p-c-Jun核阳性细胞减少,多数细胞呈胞质阳性。SP600125减少了c-Jun磷酸化,同时发现TUNEL的表达均有显著下降趋势,此结果提示SP600125可能通过调节转录因子的活性,在凋亡启动阶段减缓细胞内一系列的激酶磷酸化,推延PD损伤信号从细胞表面传递至细胞核的过程;神经元丢失现象减轻可能在一定程度上通过阻断JNK通路启动细胞凋亡过程来实现的。
尽管JNK细胞凋亡通路的具体作用机制还需进一步研究,但本实验结果提示,以JNK为靶点的药物在一定程度上可减少PD的DA能神经元凋亡,这对探讨PD的防治举措具有重要的实用价值。
1 Kowalczyk JE,Zabłocka B.Protein kinases in mitochondria〔J〕.Postepy Biochem,2008;54(2):209-16.
2 Jankowski M.The role of JNK pathway in familial Parkinson's disease〔J〕.Postepy Biochem,2007;53(3):297-303.
3 Teismann P,Tieu K,Cohen O,et al.Athogenic role of glial cells in Par-kinson's disease〔J〕.Mov Disord,2003;18(2):121-9.
4 Zhu X,Lee HG,Raina AK,et al.The role of mitogen-activated protein kinase pathway in Alzheimer's disease〔J〕.Neurol Signals,2002;11(5):270-81.
5 Wilhelm M,Xu Z,Kukekov NV,et al.Proapoptotic Nix activates the JNK pathway by interacting with POSH and mediates death in a Parkinson disease model〔J〕.JBiol Chem,2007;282(2):1288-95.
6 Xia XG,Harding T,Weller M,et al.Gene transfer of the JNK interacting protein-1 protects dopaminergic neurons in the MPTP model of Parkinson's disease〔J〕.Proc Natl Acad Sci USA,2001;98(18):10433-8.
7 Hunot S,Vila M,Teismann P,et al.JNK-mediated induction of cyclooxygenase 2 is required for neurodegeneration in a mouse model of Parkinson's disease〔J〕.Proc Natl Acad Sci USA,2004;101(2):665-70.
8 刘 江,李 冉,刘丽娜,等.JNK通路介导帕金森病小鼠黑质神经元丢失及人参皂甙Rg1的保护作用〔J〕.现代预防医学,2008;35(10):1973-5.
