漆酶的逆胶束萃取条件优化的研究
2013-05-23袁兴中黄华军崔凯龙方振敏曾光明湖南大学环境科学与工程学院湖南长沙410082湖南大学环境生物与控制教育部重点实验室湖南长沙410082
彭 馨,袁兴中*,黄华军,崔凯龙,方振敏,曾光明 (1.湖南大学环境科学与工程学院,湖南 长沙410082;2.湖南大学环境生物与控制教育部重点实验室,湖南 长沙 410082)
漆酶的逆胶束萃取条件优化的研究
彭 馨1,2,袁兴中1,2*,黄华军1,2,崔凯龙1,2,方振敏1,2,曾光明1,2(1.湖南大学环境科学与工程学院,湖南 长沙410082;2.湖南大学环境生物与控制教育部重点实验室,湖南 长沙 410082)
研究了生物表面活性剂逆胶束体系萃取纯化漆酶的后萃的过程.在此逆胶束体系中,表面活性剂采用一种阴离子生物表面活性剂鼠李糖脂(rhamnolipid, RL),溶剂采用异辛烷.分别考察了4种不同离子种类(NaCl, NaBr, KCl和KBr)与不同浓度、4种不同助溶剂种类(正丁醇,正己醇,正庚醇及正辛醇)与不同比例、乙醇的含量以及温度对漆酶的后萃过程的影响.结果表明,0.25mol/L KCl或0.20mol/L KBr能够得到较好的萃取效果;在四种助溶剂中,正己醇(比例为0.5)和正庚醇(比例为0.5)效果比较好;乙醇加入量为 9%效果最优;最适宜温度为 35℃.在上述条件下,漆酶的酶活回收率和纯化倍数分别高达 90%,4.7倍.电泳分析结果进一步证实了漆酶的纯化效果较好.研究证明鼠李糖脂逆胶束萃取酶类具有广阔的应用前景.
鼠李糖脂;逆胶束;后萃;漆酶
木质素的分解是细胞内酶和细胞外酶共同作用下的氧化过程,其在自然界中的降解进行困难且缓慢,对环境造成了严重的负担.漆酶(Laccase)在木质素降解的应用中起着重要的作用.因此,研究漆酶的纯化技术已成为热点[1].在目前已经有的漆酶纯化技术中,一般仍采用等电点沉淀、盐析、有机溶剂分级分离等方法对粗酶液进行处理,再用凝胶过滤、离子交换层析、吸附层析、亲和层析等方法进一步分离提纯,操作步骤较为繁杂,酶的活性回收率较低,而且不易规模化生产[2-4].因此,开创具有较高活性回收率,并能获得高纯度漆酶的纯化方法,将推动我国木质纤维素降解酶获得实际应用.
逆胶束分离纯化是针对生物活性蛋白质提出的一种液液萃取技术.逆胶束是表面活性剂在非极性有机溶剂中超过临界胶团浓度(CMC)时自组装形成的纳米尺寸的聚集体,具有良好的热力学稳定性[5].与传统的技术相比,逆胶束萃取具有分离步骤少、操作简易、成本较低、选择性高和不易引起酶蛋白失活变性等诸多优势,在蛋白质及酶纯化方面体现出更大的潜力,在酶等蛋白质的纯化应用领域突显着重要意义和良好的应用前景[6].采用生物表面活性剂(鼠李糖脂)制备的逆胶束体系可有效避免环境中化学试剂大量使用所造成的污染累积,使得工艺流程更具安全性和环境可持续性[7].
逆胶束萃取分为前萃和后萃两个阶段.目前,已经有大量文献报道了关于前萃的研究[8-9],而关于逆胶束萃取的后萃研究较少,特别是漆酶的后萃研究还鲜有报道.基于此,本研究拟采用鼠李糖脂构建逆胶束体系对漆酶进行萃取纯化(包括前萃和后萃),并考察离子种类和浓度,助溶剂种类和浓度以及乙醇的加入量对漆酶萃取纯化后萃过程的影响,从而为漆酶的萃取纯化工业推广提供了实验依据,对酶纯化的工业生产具有重要的意义.
1 材料与方法
1.1 材料
1.1.1 试剂 ABTS(Sigam 公司);鼠李糖脂 RL(实验室自己制备[10]);异辛烷、正丁醇、正己醇、正庚醇、正辛醇、无水乙醇和KCl、KBr等试剂均为市售分析纯.
1.1.2 仪器 紫外分光光度计(Shimadzu UV-2552,Japan);水浴恒温振荡器(WHY-2);超声波清洗仪; pH计(PHS-2F,上海雷磁仪恒温干燥箱.
1.2 方法
1.2.1 漆酶粗酶液的制备 杂色云芝C.Versicolor(ACCC 51171)购自中国农业科学研究院保藏中心.
云芝发酵培养基(L-1):2g/L葡萄糖,1.28g/L酒 石酸 铵 ,2g/L KH2PO4, 0.5g/L MgSO4·7H2O,0.076g/L CaCl2·7H2O, 0.001g/L 维生素 B1,1g/L Tween80, 7mL/L微量元素液,10mmol/L 醋酸缓冲溶液(pH4.5).
微量元素混合液:氨基乙酸 0.585g/L,MgSO4·7H2O 2.952g/L,MnSO4·H2O 0.5g/L,NaCI 1g/L,FeSO4·7H2O 0.1g/L,CoCI20.1g/L, CaCI20.1g/L,ZnSO4·7H2O 0.1g/L, CuSO4·5H2O 0.01g/L,KAI(SO4)2·12H2O 0.01g/L,HBO30.01g/L, NaMnO40.006g/L.
制备方法:500mL锥形瓶中装液体发酵培养基100mL,高压灭菌后接种,28℃,180r/min摇床培养6d.8000r/min离心10min得到粗酶液.
1.2.2 萃取 将一定量的鼠李糖脂经超声振荡溶于以不同比例混合的正X醇/异辛烷的溶液中,形成逆胶束溶液.前萃是将漆酶粗酶液与逆胶束溶液等体积混合,振荡一定的时间后以8000r/min离心10min,静置分相,留取上层有机相.后萃是将前萃后所得的有机相和等体积的含一定离子浓度的 0.1mol/L柠檬酸-柠檬酸钠缓冲液混合,振荡40min,8000r/min离心10min,静置分相,留取下层水相.采用紫外分光光度法分别测定所得水相中的蛋白质含量和 Lac酶活.实验条件与本课题组前期研究一致[11].
蛋白质后萃率(BEE)定义:后萃水相的蛋白质含量与前萃油相中蛋白质含量的百分比.漆酶酶活回收率(AR)定义为:后萃水相中酶含量与初始酶液中酶含量的百分比.纯化倍数(PF)为后萃水相中的比酶活与初始酶液的比酶活之比.
1.2.3 漆酶酶活测定 取 1mL待测酶液,加入2mL 0.05mmol/L的 ABTS溶液,pH=4.5,反应3min,在 420nm 波长下测定吸光度的变化.同反应体系做空白样启动反应.一个酶活力单位(U)定义为每分钟氧化ABTS所需的酶量.
1.2.4 蛋白质浓度的测定 水相中蛋白质浓度采用 Folin-酚法.取 1mL样品溶液,加入 5mL试剂甲混匀,放置10min后加入0.5mL试剂已,立即摇匀,保存 30min,然后于 500nm 处比色,以 1mL代替样品作空白对照.测定后,可从标准曲线中查出未知样品浓度.
2 结果与讨论
2.1 不同离子对后萃的影响
离子种类和浓度在逆胶束萃取技术中是一个很重要的影响因素.在酶纯化中,普遍采用Na+,K+和 Ca2+探究阳离子对萃取的影响[12-14].由于Na/Ca-Cl作用和影响十分相似[6],因此本实验采用 NaCl,NaBr,KCl和 KBr探究 Na+与 K+影响大小程度.不同离子种类和浓度对漆酶后萃的影响如图 1所示.阳离子的种类和浓度对鼠李糖脂形成逆胶束溶液的萃取有明显的影响.由图 1(a)可知,当NaCl浓度为0.15mol/L时,酶活回收率和纯化因子均达到最大值.虽然此时蛋白质后萃率未达到最优值,但综合考虑各个参数,本文采用最佳PF时的各参数为最优条件.NaCl浓度为0.15mol/L是最优浓度.从图 1(b)可以看出,NaBr最优值应为0.25mol/L.同理由图1(c)和图1(d)得知,KCl和 KBr的最优浓度为 0.25mol/L和0.20mol/L.

图1 不同离子种类与浓度对后萃的影响Fig.1 Effect of ionic strength on backward extraction
由图1可见,随着4种离子浓度的增加,酶活回收率,后萃率和纯化因子大致上都是呈先增加然后降低的趋势.这一现象可以用双电层理论进行解释.当离子浓度增大时,蛋白质与逆胶束表面之间的静电引力减小,从而降低了酶蛋白在逆胶束中的溶解度,使之由有机相反萃取回水相[15].双电层与离子强度之间的关系为[16]

式中:k为双电层厚度,cm;I为离子强度, mol/L.
从式(1)可以看出随着I的增大,逆胶束内表面的双电层变薄,即静电引力随着I的增大而减弱:另一方面,逆胶束内表面双电层变薄之后,减小了逆胶束内表面极性头之间的相互斥力,使逆胶束变小.这两方面会使漆酶更容易从逆胶束中萃取出来[17-18].但过高的离子浓度影响蛋白质的溶解,甚至使得蛋白质变质[18].
在4种离子最优值的条件下(NaCl: 0.15mol/L,NaBr:0.25mol/L, KCl:0.25mol/L和KBr:0.2mol/L),纯化倍数对比发现,K+对后萃的影响优于 Na+的影响.类似的实验结果在文献[19]中也曾出现.
2.2 不同助溶剂对后萃的影响
采用正丁醇、正己醇、正庚醇及正辛醇等4种正构醇作为助溶剂,分别以不同的比例加入有机相异辛烷中,探究助溶剂种类和比例对漆酶后萃过程的影响,如图2所示.由图2(a)可知,当正丁醇的比例为0.35时,酶活回收率达到最大值.而当其比例为 0.5时,后萃率和纯化倍数均达到最大值.从图 2(b)和图 2(c)可以看出,正己醇和正庚醇最优比例应为 0.5,在此条件下,酶活回收率,后萃率和纯化倍数均达到最大值.由图 2(d)可知,正辛醇对后萃的影响不稳定,有两个峰值,并且酶活回收率在80%以下,后萃率不到30%,纯化倍数与其他助溶剂相比也较低.正己醇体系酶活回收率达90%,纯化倍数达 4.7;正庚醇体系酶活回收率达81%,纯化倍数达 4.3.因此可以看出,正己醇和正庚醇比较适合作为助溶剂.
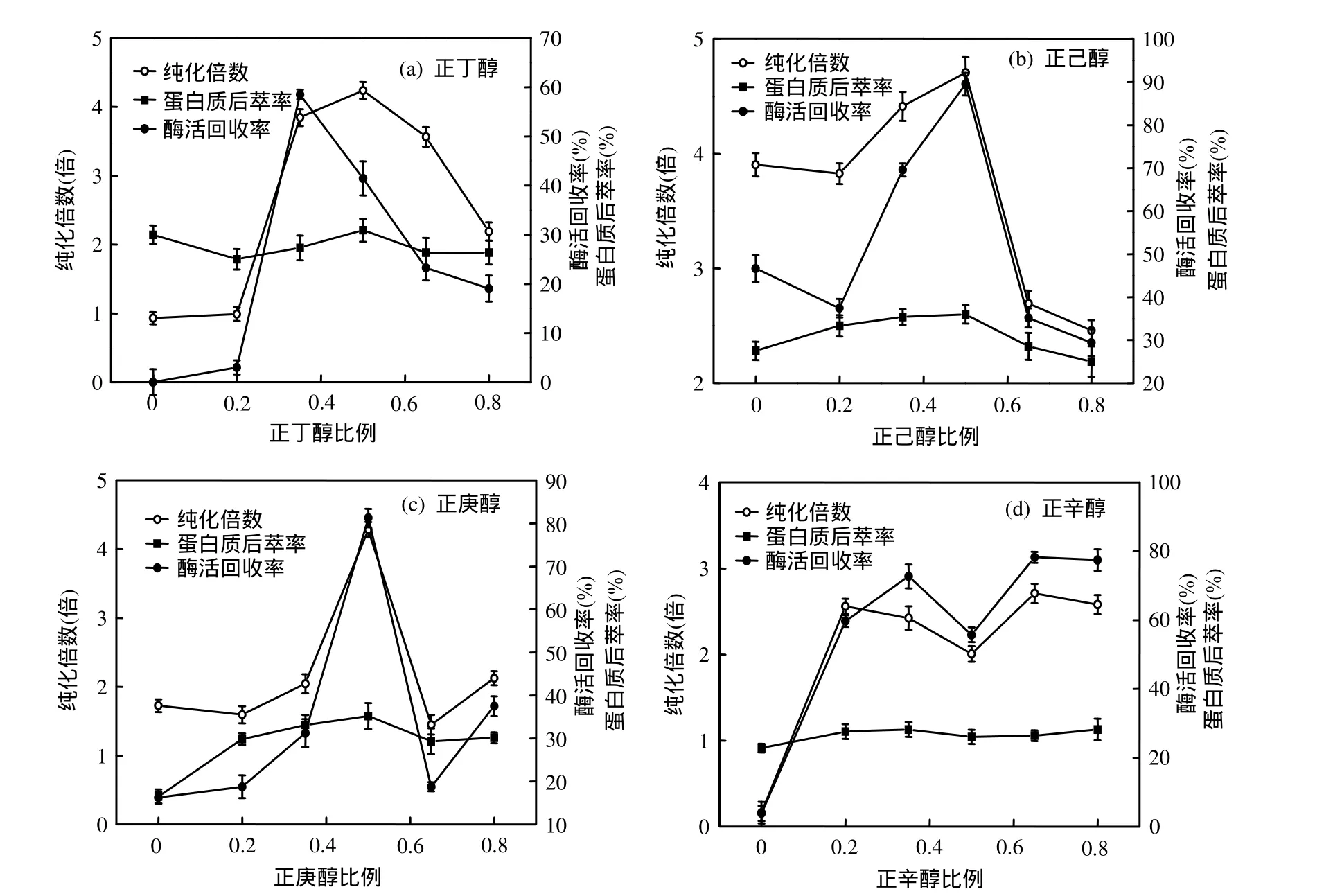
图2 不同助溶剂种类与比例对后萃的影响Fig.2 Effect of co-solvent on backward extraction
在逆胶束体系中,助溶剂分子会插入到鼠李糖脂的分子之间,因此产生两方面的影响:一是改变了鼠李糖脂的亲水基之间的作用;二是使鼠李糖脂的排列变得松散.这两方面的影响可以导致鼠李糖脂黏合性降低,从而增加了鼠李糖脂在有机溶剂中的溶解性[20].加入助溶剂之后,有机相能够增溶更多的鼠李糖脂,有利于逆胶束萃取.Jolivalt等[20]研究表明,增加助溶剂的碳链长度会导致表面活性剂分子头部集团之间的屏蔽作用降低,使得逆胶束体积变大.这一点可以从正己醇、正庚醇和正辛醇均比正丁醇更有利于逆胶束的萃取中得到证实.但同时实验表明,正辛醇相对于正己醇和正庚醇并没有体现出明显的优越性,这可能是因为碳链长度超过了合适的范围,导致萃取不稳定.
2.3 不同乙醇加入量对后萃的影响
在后萃过程中加入乙醇,会使得萃取后的分相变得相对容易,界面非常清晰[18].乙醇能够降低界面刚性,使得蛋白质和逆胶束内表面之间的作用减弱,从而使得蛋白质更容易从逆胶束中迁移出来,增加界面流动性,促进逆胶束在界面上的自由活动.同时还能减弱酶和表面活性剂极性头基之间的静电作用,防止蛋白质变性.根据Mathew 等[21]提出的理论,溶剂参与构建逆胶束的外壳,而乙醇则是进入逆胶束的水核中,从而使后萃过程变得容易.
如图3所示,乙醇加入量(0~24%,V/V)对后萃的影响呈钟罩型.当乙醇加入量小于 9%时,随着乙醇的增加,酶活回收率和纯化倍数都有明显的提高,后萃率也有所增加.当乙醇加入量超过 9%时,随着乙醇的增加,酶活回收率和纯化倍数均呈下降趋势.后萃率变化较为平缓,但当乙醇加入量超过12%时,后萃率也开始有所降低.本次实验最佳乙醇加入量为9%.
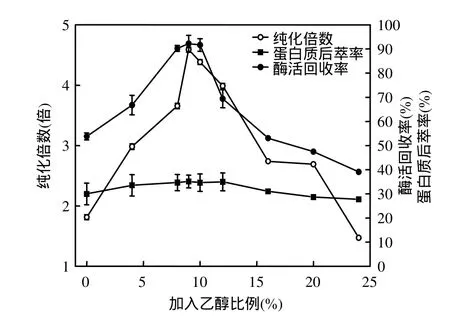
图3 不同乙醇加入量对后萃的影响Fig.3 Effect of ethanol on backward extraction
2.4 温度对后萃的影响
漆酶萃取酶活回收率,后萃率和纯化倍数随温度的变化(15~50℃)如图4所示.从图4可以看出,温度对酶活回收率的影响较大,当温度低于35℃时,酶活回收率随着温度的升高而增加;当温度为 35℃时,酶活回收率达到最高值;当温度高于 35℃时,酶活回收率随着温度的升高而降低.而温度对后萃率的影响并不大,后萃率比较稳定,在温度为30℃时达到相对较大值.纯化倍数随温度的变化与酶活回收率的变化比较一致,在35℃时达到最大值.综合考虑,35℃为最佳温度.
较低的温度不利于逆胶束萃取,而过高的温度会使酶活性和萃取效率降低.这一点与前人的研究结果较为一致,如Yu等[22]采用AOT逆胶束体系萃取纯化酵母酶的研究、Liu等[23]采用AOT逆胶束体系纯化纳豆激酶的研究和Dekker等[24]采用顿巴黄铜逆胶束体系研究温度对α-淀粉酶增溶性的研究.

图4 温度对后萃的影响Fig.4 Effect of temperature on backward extraction
3 结论
3.1 采用阴离子生物表面活性剂鼠李糖脂构建逆胶束体系萃取漆酶,在后萃过程中加入不同种类与浓度的离子,最佳离子为KCl或KBr,其最佳浓度值分别为0.25mol/L和0.20mol/L.
3.2 考察了加入不同种类与比例的助溶剂对后萃的影响,确定最佳助溶剂为正己醇或正庚醇(体积均比例为0.5).
3.3 考察了不同乙醇含量对后萃的影响,结果表明,乙醇加入量 9%为最优.在最优的条件下,酶活回收率为90%,纯化倍数为4.7.
3.4 考察了不同温对后萃的影响,结果表明35℃时酶活回收率及纯化倍数均达到最大值,为最佳温度.
[1]Guo Q Z, Yi F W, Xiao Q Z, et al. Purification and characterization of a novel laccase from the edible mushroomClitocybe maxima[J]. Process Biochemistry, 2010;45:627-633.
[2]Guo L Q, Lin S X, Zheng X B, et al . Production, purification and characterization of a thermostable laccase from a tropical white-rot fungus [J]. World Journal of Microbiology and Biotechnology 2011;27:731-735.
[3]Nandini K E, Rastogi N K. Reverse micellar extraction for downstream processing of lipase: Effect of various parameters on extraction [J]. Process Biochemistry 2009;44:1172-1178.
[4]Marcozzi G, Correa N, Luisi P L, et al. Protein extraction by reverse micelles: a study of the factors affecting the forward and backward transfer of a-chymotrypsin and its activity [J].Biotechnology and Bioengineering 1991;38:1239-1246.
[5]Melo E P, Aires-Barros M R, Cabral J M S. Reverse micelles and protein biotechnology [J]. Biotechnology Annual Review,2001,7:87-129.
[6]Tonova K, Lazarova Z. Reversed micelle solvents as tools of enzyme purification and enzyme-catalyzed conversion [J].Biotechnology Advances, 2008, 26: 516-532.
[7]崔凯龙,袁兴中,曾光明,等.生物表面活性剂用于逆胶束体系的构建及微水相条件优化 [J]. 中国环境科学, 2011,31(9):1444-1450.
[8]Sun X H, Zhu K X, Zhou H M. Protein extraction from defatted wheat germ by reverse micelles:Optimization of the forward extraction [J]. Journal of Cereal Science, 2008,48:829-835.
[9]柳畅先,王永美,孙小梅.反胶束萃取醇脱氢酶的研究 [J]. 分析科学学报, 2006,22:219-221.
[10]Liang Y S, Yuan X Z, Zeng G M, et al. Biodelignification of rice straw by Phanerochaete chrysosporium in the presence of dirhamnolipid [J]. Biodegradation, 2010,21(4): 615-624
[11]Peng X, Yuan X Z, Zeng G M, et al. Extraction and purification of laccase by employing a novel rhamnolipid reversed micellar system [J]. Process Biochemistry, 2012;47:742-748.
[12]Noritomi H, Ito S, Kojima N, et al. Forward and backward extractionsof cytochrome c using reverse micellar system of sucrose fatty acid ester [J]. Colloid and Polymer Science, 2006,284:604-610.
[13]李 凯,李成付,李加友,等.反胶束萃取精氨酸脱亚胺酶 [J]. 精细化工, 2008,25:163-166.
[14]Liu J G, Xing J M, Chang T S, et al. Reverse micelles extraction of nattokinase: From model system to real system [J]. Chinese Science Bulletin, 2006,51:796-801.
[15]王金枝,曹学君.反胶束萃取技术分离胰激肽原酶 [J]. 中国生物工程杂志, 2007,27(3):93-99.
[16]孙 彦.生物分离工程 [M]. 北京:化学工业出版社, 2005:149-156.
[17]高亚辉,陈复生,赵俊廷,等.反胶束萃取大豆蛋白反萃取过程的动力学研究 [J]. 农业工程学报, 2007,23:206-211.
[18]Sun X H, Zhu K X, Zhou H M. Optimization of a novel backward extraction of defatted wheat germ protein from reverse micelles[J].Innovative Food Science and Emerging Technologies, 2009;10:328-333.
[19]Leodidis E B, Hatton T A. Effects of average molecular charge on amino acid interfacial partitioning in reversed micelles [J].Journal of Colloid Interface Science, 1991,147:163-177.
[20]Jolivalt C, Minier M, Renon H, Extraction ofα-chymotrypsin using reversed micelles [J]. Journal of Colloid Interface Science,1990,135:85-96.
[21]Mathew D S, Juang R S. Role of alcohols in the formation of inverse microemulsions and back extraction of proteins/enzymes in a reverse micellar system [J]. Separation and Purification Technology, 2007;53:199-215.
[22]Yu Y C, Chu Y, Ji J Y. Study of the factors affecting the forward and back extraction of yeast-lipase and its activity by reverse micelles[J]. Journal of Colloid Interface Science, 2003,267:60-64.
[23]Liu J G, Xing J M, Chang T S, et al. Purification of nattokinase by reverse micelles extraction from fermentation broth: effect of temperature and phase volume ratio [J]. Bioprocess and Biosystems Engineering, 2006,28:267-273.
[24]Dekker M. Enzyme recovery using reversed micelles [D].Agricultural University of Wageningen, Department of Food Engineering, Wageningen, The Netherlands, 1990.
Purification progress of laccase by reversed micelle system.
PENG Xin1,2, YUAN Xing-zhong1,2*, HUANG Hua-jun1,2,CUI Kai-long1,2, FANG Zhen-min1,2ZENG Guang-ming1,2(1.College of Environmental Science and Engineering, Hunan University, Changsha 410082, China;2.Key Laboratory of Environmental Biology and Pollution Control, Hunan University, Ministry of Education, Changsha 410082, China).China Environmental Science, 2013,33(5):904~909
Backward extraction of laccase by an innovative method, biosurfactant-based reversed micellar extraction(RME) was studied. In this reversed micelle system, rhamnolipid (RL), a kind of anionic biosurfactant, was employed and isooctane was used as solvent. Four different salts type (NaCl, NaBr, KCl and KBr) with different concentration and four different co-solvent type(n-butanol, n-hexanol, n-heptanol and n-octanol) with different ratio were added respectively in the RME. The effects of ethanol and temperature on backward extraction were studied. The experimental results showed that the impact of KCl (0.25mol/L) on backward extraction approximately equal to KBr (0.20mol/L). Optimum co-solvent was n-hexanol or n-heptanol both with the ratio of 50%. Ethanol was added in backward extraction process and the appropriate volume was 9%. The optimum temperature during backward was 35℃. The best activity recovery and purification fold were 90% and 4.7. The analysis results of SDS-PAGE further proved that laccase was successfully purified. The research indicated RL-RME has huge potential in extraction industry.
rhamnolipid;reversed micellar extraction;backward extraction;laccase
X17
A
1000-6923(2013)05-0904-06
2012-08-30
国家自然科学基金资助项目(50978087/21276069)
* 责任作者, 教授, yxz@hnu.edu.cn
彭 馨(1987-),女,内蒙古乌海人,湖南大学环境科学与工程学院硕士研究生,研究方向为废物资源化.
