‘黄天霸’百合鳞茎低温解除休眠过程中形态和生理的变化
2013-04-25王中轩杜运鹏贾桂霞
王中轩,杨 森,杜运鹏,贾桂霞
(北京林业大学园林学院,北京100083)
百合属球根花卉,种球具有自然休眠特性,通常只有在解除休眠后,才能在适宜的环境条件下正常发芽、生长、开花[1].百合种球生理休眠的解除通常需经低温处理,一般在0-8℃下放置60-120 d即可打破休眠[2].对兰州百合的研究发现,贮藏34 d,顶芽在鳞茎内迅速发育,鳞茎内淀粉含量明显下降,可溶性糖含量显著升高,2℃贮藏101 d为解除休眠的最佳处理[3].孙红梅等对兰州百合冷藏过程的研究表明ABA是抑制百合顶芽萌发的主要因子[4].在对亚洲、东方及LA杂种系的3个百合品种鳞茎的低温处理过程中发现,淀粉含量明显下降,可溶性糖含量上升,可溶性蛋白质含量呈下降趋势,低温冷藏37-61 d是鳞茎内生理生化变化最活跃的时期[5].对新铁炮百合的研究发现,低温处理过程中糖分含量变化的转折点与鳞茎解除休眠有关,冷藏37 d为解除休眠的合适时间[6].由此可见,百合鳞茎低温打破休眠过程中,休眠的进程与碳水化合物及内源激素含量的变化密切相关,且不同类型百合间存在明显差异.
近年来,OT百合杂种系列因其花大、芳香、抗性强等特点,适宜我国大部分地区种植,颇受广大生产者及消费者欢迎,种植面积与市场需求不断扩大.其中‘黄天霸’为目前我国主栽品种之一.但有关该品种乃至OT系列百合在解除休眠过程中形态和生理生化变化的研究国内尚无报道,而这些变化趋势是指导种球贮藏生产的关键.因此,本试验通过系统研究该品种在冷藏过程中鳞茎内生理生化变化的规律,了解其生理生化变化与低温处理时间的关系,为提高OT系列百合种球贮藏质量、实现OT系列百合种球国产化生产提供依据.
1 材料与方法
1.1 供试材料
供试材料为北京市大东流苗圃自繁的OT系列百合‘黄天霸’品种.种球采收后经自然干燥、清洗干净后用50%多菌灵可湿性粉剂1000倍液浸泡30 min,选用鳞片抱合紧密、无病虫害、周径为16-18 cm的鳞茎.
1.2 方法
将试验鳞茎装入垫有薄膜的塑料筐中,用已消毒、含水量为50%的泥炭作为储藏介质,将泥炭与百合鳞茎分层放置后用薄膜(薄膜上打小孔以透气)包起,置于4℃冷库进行低温贮藏.
1.2.1 形态变化的观测 在放入冷库之前对百合种球进行第1次取样处理,之后每7 d取样观测.每次随机选取大小适中、无污染的百合种球4粒,洗净后进行标记处理.用游标卡尺量取每个百合种球的直立高度及基部距幼芽生长点的距离,算出幼芽生长顶点距种球顶端的距离,之后取平均值.
1.2.2 碳水化合物及内源激素含量的测定 对种球进行剥离取样,种球由外向内的第2层鳞片视为外层鳞片,幼芽向外的第2层鳞片视为内层鳞片,对外层鳞片与内层鳞片基部分别取样,重复3次,以比较内、外层鳞片的差异.样品质量为1.0 g,用锡箔纸包好,做标记后放入液氮中冷冻处理;之后放入超低温冰箱中冷藏.分别测定低温贮藏过程中碳水化合物、内源激素含量的变化.还原性糖含量采用3,5-二硝基水杨酸比色法测定,可溶性糖和淀粉含量采用蒽酮比色法测定[7].ZR、IAA、ABA、GA3等内源激素含量采用酶联免疫法(ELISA)测定[7],ELISA试剂盒由中国农业大学生产.所有测定均重复3次.
2 结果与分析
2.1 鳞茎低温冷藏过程中芽的变化
百合鳞茎在低温解除休眠过程中,鳞茎内新芽伸长是一个重要的形态指标.在贮藏过程中随着时间的延长,百合顶芽在鳞茎内不断伸长和膨大,芽生长点与鳞茎顶部的距离越来越小.
由图1可以看出,随着冷藏时间的延长,百合鳞茎的芽离顶端的距离越来越小.变化曲线趋于直线,说明芽的生长速度几乎未变.冷藏前,‘黄天霸’百合鳞茎新芽离鳞茎顶部的距离为3.8 cm,经过49 d的冷藏处理后,该距离小于1 cm.此时,幼芽处于即将发端的前期,表明已经解除休眠,此时可以进行播种.若要继续贮藏,则应该及时转入温度更低的冷库进行贮藏,以防幼芽进一步萌发.

图1 冷藏过程中芽的伸长变化Fig.1 Change of terminal bud of bulb during low temperature storage
2.2 鳞茎低温冷藏过程中碳水化合物的代谢
2.2.1 鳞茎中淀粉含量的变化 淀粉是百合鳞茎中养分的主要贮藏形式,是以后生长初期的主要能源物质.刚收获时其含量维持在较高水平,在低温作用下,淀粉这种贮藏态碳水化合物开始转化.
从图2可以看出,贮藏在4℃低温下的‘黄天霸’百合鳞茎在前7 d内淀粉含量出现较大幅度下降,其中以外层鳞片淀粉含量下降最为明显,从冷藏前的320 mg·g-1下降到130 mg·g-1,下降幅度约为59%.其间内层鳞片淀粉含量也呈明显下降趋势,但整体含量低于外层鳞片.在贮藏后的8-21 d,外层鳞片内的淀粉含量变化较小,总量相差不多;贮藏21 d后鳞片淀粉含量逐步下降,且趋势一致,说明在贮藏过程中淀粉不断分解.内层淀粉含量的变化与外层相似,也呈下降趋势.但在贮藏前期外层淀粉含量高于内层,而在贮藏后期内层淀粉含量高于外层,说明在冷藏过程中外层淀粉的消耗较多.
2.2.2 鳞茎中可溶性糖含量的变化 ‘黄天霸’百合种球中可溶性糖含量变化明显(图3).由图3可以看出,在整个冷藏过程中‘黄天霸’百合鳞片可溶性糖含量呈先上升后下降的变化趋势,且外层鳞片可溶性糖含量始终高于内层鳞片.前49 d鳞片中的可溶性糖含量随着贮藏天数的增加而提高,并且内外鳞片可溶性糖含量均在第49天达到最大值,其中内层鳞片可溶性糖含量峰值为55.6 mg·g-1,外层鳞片可溶性糖含量峰值为58.3 mg·g-1;之后,可溶糖含量开始下降;到第56天内层鳞片和外层鳞片的可溶性糖的含量分别为 53.7 和 54.9 mg·g-1,分别为冷藏初期的 2.6 倍和 2.4 倍,两者增幅相近.

图2 冷藏期间鳞茎淀粉含量的变化Fig.2 Change of starch contents in stored bulb under low temperature

图3 冷藏期间鳞茎可溶性糖含量的变化Fig.3 Change of total soluble suger contents in stored bulb under low temperature
2.2.3 鳞茎中还原性糖含量的变化 从图4可以看出,在冷藏过程中,贮藏前7 d内层鳞片还原糖含量显著降低,而外层含量仅略微降低.说明在贮藏初期种球内的还原糖略有消耗.之后各层鳞片还原性糖含量均呈平缓上升趋势,内外层鳞片还原性糖含量均在第49天达到峰值,其中外层鳞片含量为14.3 mg·g-1,内层鳞片含量为 13.5 mg·g-1.
各层鳞片还原性糖含量达到峰值后均呈下降趋势,在第56天,内层鳞片和外层鳞片的还原性糖含量分别达到了 12.8 和 12.5 mg·g-1,内层鳞片还原性糖含量稍高于外层鳞片.
2.2.4 鳞茎中蔗糖含量的变化 从图5可以看出,‘黄天霸’百合鳞茎内外层鳞片的蔗糖含量与可溶性糖含量的变化规律一致,均呈先上升后下降的趋势.
冷藏49 d,‘黄天霸’百合鳞茎内层鳞片蔗糖含量达到峰值,为51.5 mg·g-1;外层鳞片蔗糖含量达到峰值,为49 mg·g-1.两者增幅分别为冷藏前的 3.5 和2.3 倍.
在冷藏过程中,外层鳞片与内层鳞片的蔗糖含量变化均较大;与贮藏初期相反,贮藏后期内层鳞片蔗糖含量稍高于外层鳞片蔗糖含量,而此时可溶性糖在内层鳞片上的含量稍低于外层鳞片.

图4 冷藏期间鳞茎还原性糖含量的变化Fig.4 Change of reducing sugar contents in stored bulb under low temperature
2.3 鳞茎低温冷藏过程中内源激素含量的变化
2.3.1 IAA含量的变化 从图6可以看出,鳞片内IAA含量在贮藏前14 d呈平缓下降,在之后的7 d出现了少量回升,而在28-35 d急剧升高.外层鳞片IAA含量在第35天达到峰值,为168 ng·g-1;内层鳞片IAA含量变化趋势与外层鳞片相同,在第35天也达到峰值,为197 ng·g-1,此时内层鳞片IAA含量明显高于外层.而在冷藏前期和后期,内层鳞片的IAA含量均低于外层鳞片.
2.3.2 GA3含量的变化 由图7可以看出,在低温贮藏期间,鳞片内GA3含量呈现波动变化.在前14 d明显上升,出现第1次高峰;在之后的7 d内层鳞片GA3含量急剧下降后开始缓慢上升,直至休眠结束;而外层鳞片的GA3含量在第15天至第28天一直下降,在第29天开始上升,35 d后又下降.整体来看,‘黄天霸’百合鳞茎内外层鳞片GA3含量在低温冷藏过程中波动较大,规律不明显.由此说明,绝对含量的变化并不能准确反映休眠被打破的阶段,而相对含量的变化更能说明问题[8,9].
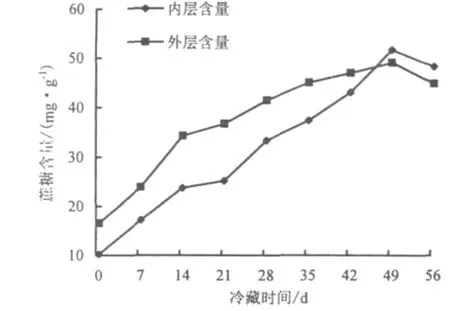
图5 冷藏期间鳞茎蔗糖含量的变化Fig.5 Change of sucrose contents in stored bulb under low temperature

图6 冷藏期间鳞茎IAA含量的变化Fig.6 Changes of IAA contents in stored bulb under low temperature
2.3.3 ABA含量的变化 由图8可以看出,‘黄天霸’百合鳞茎内层鳞片ABA含量在冷藏前21 d内缓慢上升,第22天开始上升,第28天达到峰值,为162 ng·g-1,说明在贮藏初期种球进入深休眠状态.在第29天ABA含量开始迅速下降,并在第35天达到最小值,为64 ng·g-1;之后呈缓慢上升趋势.外层鳞片ABA含量在低温冷藏期间与内层鳞片变化的整体趋势一致,也在第35天达到最小值;但在第29天至第35天ABA含量的变化趋势与内层相反,呈下降趋势,说明此阶段ABA在向内层转移.而前28 d较高的ABA含量对休眠起着关键作用,随着休眠的打破,其含量急剧下降,之后趋于平缓.

图7 冷藏期间鳞茎GA3含量的变化Fig.7 Changes of GA3contents in stored bulb under low temperature

图8 冷藏期间鳞茎ABA含量的变化Fig.8 Changes of ABA contents in stored bulb under low temperature
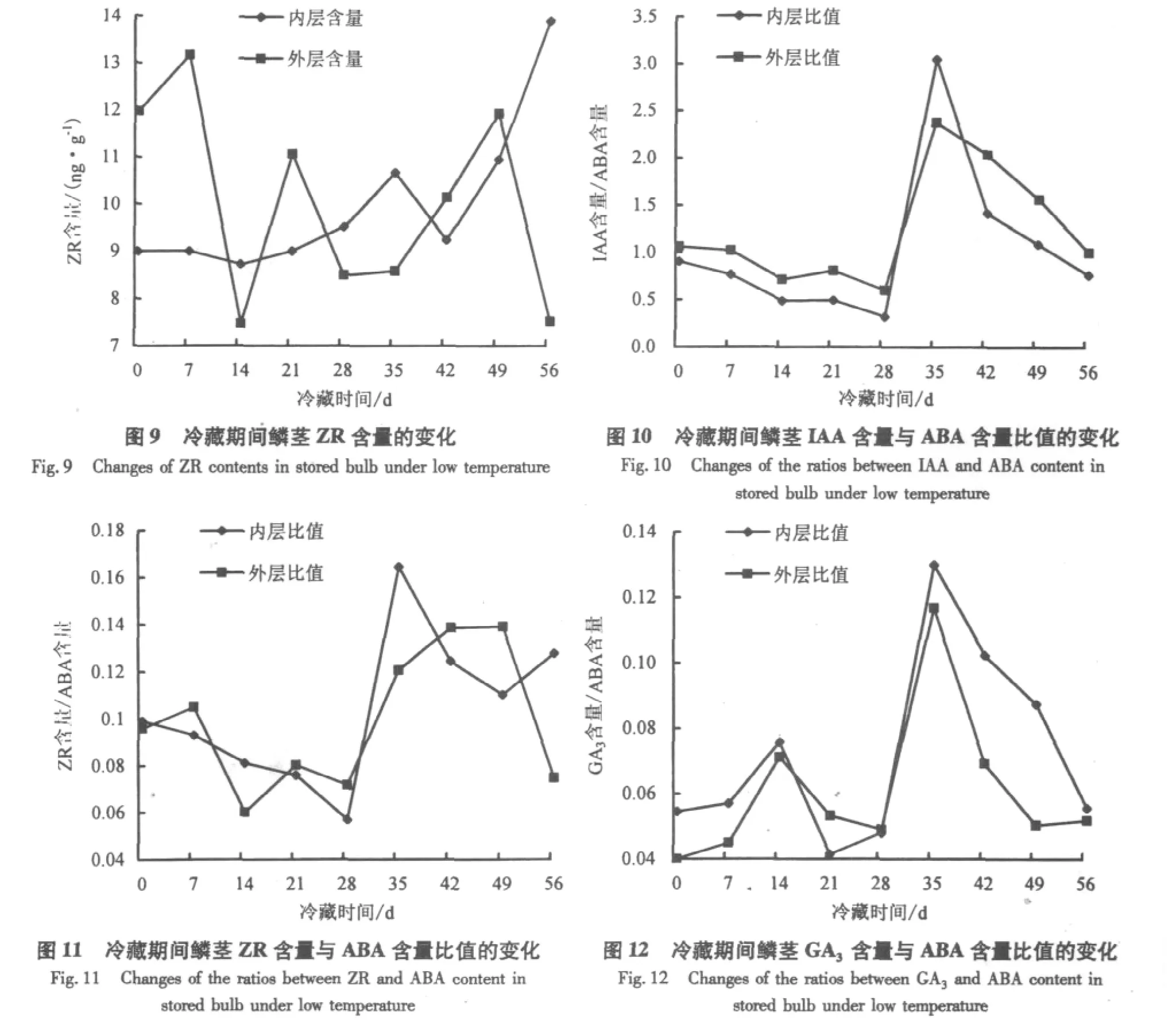
2.3.4 ZR含量的变化 由图9可以看出,‘黄天霸’百合内层鳞片ZR含量变化不大,打破休眠后明显上升.而外层鳞片ZR含量在前14 d呈下降趋势,之后平缓上升,在打破休眠后开始下降.在低温处理期间,ZR含量总体变化不大,尤其是与新芽接近的内层鳞片,仅在打破休眠后变化明显,这也说明ZR含量不能准确反映‘黄天霸’百合打破休眠的程度.
2.4 鳞茎低温冷藏过程中激素含量比值的变化
鉴于各激素含量的变化不能准确反映种球的休眠程度,本试验对如下激素含量比值的变化进行了分析,结果见图10-12.由图10可以看出,‘黄天霸’百合内外层鳞片的IAA含量与ABA含量的比值在低温贮藏的28 d内缓慢下降;第29天开始明显上升,第35天出现峰值,且内层高于外层;之后呈下降趋势,直至休眠结束.这是由于随着休眠的解除,鳞片内IAA含量上升,ABA含量下降.同时,激素含量比值变化明显的阶段也是打破休眠的关键时期.由图11可以看出,‘黄天霸’百合内层鳞片ZR含量与ABA含量的比值在低温贮藏的28 d内缓慢下降,之后上升,在第35天突然增高,出现峰值,然后呈下降趋势.外层鳞片ZR含量与ABA含量的比值在前28 d缓慢下降后上升,在休眠结束时达到最高值,然后下降.从图12可以看出,‘黄天霸’百合内层鳞片GA3含量与ABA含量的比值和外层鳞片GA3含量与ABA含量的比值在低温处理过程中变化趋势基本一致,仅在8-14 d有所上升,第29天开始明显上升,之后开始下降.其整体变化趋势和IAA含量与ABA含量的比值相似,说明相对含量对休眠的指示更为准确.
3 小结与讨论
3.1 ‘黄天霸’百合鳞茎打破休眠的形态标志
休眠是一个复杂的生理过程,关于休眠以及解除休眠的形态标志尚无定论[1],国内外在判断百合冷藏解除休眠时,通常以顶芽生长点距离鳞茎顶端约1 cm为形态依据[10],前人对其他百合的研究均证实了这一点[11,12].本试验结果表明‘黄天霸’百合鳞茎在4℃条件下冷藏49 d,其顶芽生长点与鳞茎顶端的距离小于1 cm,与该形态标志基本一致,说明此时种球已打破休眠.因此,若急于种植,可在此时进行催芽处理;需长期贮藏的,应在打破休眠关键时期的第29天至第35天转入冷冻贮藏.
3.2 贮藏过程中鳞茎生理生化变化与打破休眠的关系
在对百合低温贮藏的研究中发现淀粉与可溶性糖及还原糖之间存在此消彼长的关系[13].国外也利用鳞片中可溶性糖含量出现下降作为判断打破休眠的依据[10].国内对东方百合、兰州百合等研究结果与此相似[3,14].本试验也发现,OT系列百合‘黄天霸’内、外层鳞片在冷藏过程中淀粉含量持续下降,可溶性糖、还原糖和蔗糖的含量均提高,即出现‘低温糖化’现象[15-17].但在贮藏前7 d还原糖含量明显下降,这可能与贮藏初期对低温环境的适应有关.而作为百合鳞茎的主要营养源,淀粉含量一直呈下降趋势,可溶性糖等含量呈上升趋势,这说明冷藏过程中鳞茎的淀粉转化为能被分解利用的糖,开始为花芽分化作准备.本研究发现‘黄天霸’百合种球在4℃冷藏49 d后,内、外层鳞片的可溶性糖、还原糖和蔗糖含量均达到峰值并开始出现下降,说明此时休眠已打破;同时证明了可溶性糖含量峰值的出现与形态指标相吻合,可作为鳞茎休眠解除的临界点生理指标.休眠打破后糖含量下降则说明鳞茎内部的生理活动增强.
一般认为休眠是由内源激素GA3、ABA、IAA等促进与抑制生长的物质之间的平衡决定的[18].本试验结果表明,在贮藏初期,ABA含量呈上升趋势,说明此时鳞茎仍处于休眠状态,抑制萌发的ABA起主导作用;在之后的14 d内,IAA含量显著上升,ABA含量明显降低,GA3与ZR含量也有所上升,这与孙红梅等对兰州百合的研究结果相似[15].说明鳞茎已进入解除休眠的阶段,该阶段也是打破休眠的关键时期.同时,在打破休眠过程中ABA与IAA含量的变化明显,说明在‘黄天霸’百合打破休眠过程中,ABA与IAA起的作用较大;而GA3和ZR在内、外层鳞片内含量变化规律不明显,说明这两种激素对‘黄天霸’百合打破休眠的作用不明显.
通过对冷藏过程中各激素含量比值变化的比较发现,随着百合鳞茎休眠的解除,各激素含量比值的变化趋势较为相似.说明各激素不是单独发挥作用的,而是通过彼此之间相互作用来控制种球的休眠,只有当几种激素含量之间处于一定的平衡状态时,才可显示促使某一阶段开始或保持某一生长状态.这与相关研究结果相似[20-21].而这几项比值的变化也能够反映种球打破休眠的进程,在贮藏第29天至第35天比值出现明显变化又证明了该时期是打破休眠的关键时期.此外,各激素相对含量的峰值出现在处理的第35天,而碳水化合物的峰值出现在第49天.这可能是在打破休眠过程中激素含量首先发生改变,之后调控碳水化合物的变化,进而打破休眠.
[1]郭志刚,张伟.切花生产技术丛书——球根类[M].北京:清华大学出版社,1999:24-45.
[2]GUDE H,VERBRUGGEN J.Physiological markers for lily bulb maturity[J].Acta Hort,2000:343 -350.
[3]孙红梅,李天来,李云飞.不同贮藏温度下兰州百合种球淀粉代谢与萌发关系初探[J].园艺学报,2004,31(3):337-342.
[4]孙红梅,李天来,李云飞.内源ABA对兰州百合鳞茎顶芽内物质变化的调节作用[J].林业科学,2006,42(10):19-23.
[5]涂淑萍,穆鼎,刘春.百合鳞茎低温解除休眠过程中的生理生化变化研究[J].江西农业大学学报,2005,27(3):404-407.
[6]宁云芬,龙明华,陶劲,等.新铁炮百合鳞茎低温解除休眠过程中的形态和生理变化[J].广西农业生物科学,2008,27(1):66-69.
[7]邹琦.植物生理学实验指导[M].北京:中国农业出版社,2000:33-50.
[8]孙红梅,李天来,李云飞.兰州百合鳞茎发育及低温解除休眠过程中内源激素的变化[J].植物研究,2006,26(5):570-576.
[9]周涤,卫尊征,王贤,等.不同贮藏温度对彩色马蹄莲块茎内源激素变化及萌芽与生长的影响[J].植物生理学报,2011,47(7):705-709.
[10]夏宜平,黄春辉,何桂芳,等.东方百合鳞茎冷藏解除休眠的养分代谢和酶活性变化[J].园艺学报,2006,33(3):571-576.
[11]何桂芳,夏宜平,黄春辉,等.东方百合鳞茎低温解除休眠过程中的形态和生理变化[J].浙江农业学报,2006,18(3):167-170.
[12]夏宜平,黄春辉,郑慧俊,等.百合鳞茎形成与发育生理研究进展[J].园艺学报,2005(5):947-953.
[13]罗丽兰,石雷,张金政.低温对解除百合鳞茎休眠和促进开花的作用[J].园艺学报,2007,34(2):517-524.
[14]徐伟韦,夏宜平.东方百合鳞茎长期冷藏期间形态和生理变化研究[J].北方园艺,2007(9):126-128.
[15]MILLER W B,LANGHANS R W.Low temperature alters carbohydrate metabolism in Easter lily bulbs[J].HortScience,1990,25(4):463 -465.
[16]SHIN K S,CHAKRABARTY D,PAEK K Y.Sprouting rate,change of carbohydrate contents and related enzymes during cold treatment of lily bulblets regenerated in vitro[J].Scientia Horticulturae,2002,96:195 -204.
[17]DENNIS J F.Dormancy——what we know[J].HortScience,1994,29(11):1249 -1255.
[18]冯莹,赖钟雄.外源激素和糖对石斛兰原球茎受体系统建立的影响[J].福建农林大学学报:自然科学版,2009,38(5):495-499.
[19]孙红梅,李天来,李云飞.低温解除休眠过程中兰州百合中部鳞片物质变化的生理机制[J].中国农业科学,2005,38(2):376-382.
[20]郑国生,盖树鹏,盖伟玲.低温解除牡丹芽休眠进程中内源激素的变化[J].林业科学,2009,45(2):48-52.
[21]杨柏云,连勇,章敏华,等.马铃薯休眠阶段中内源激素变化的研究[J].中国马铃薯,2004,18(6):321-325.
