CD44在胃癌细胞株MKN45悬浮球体细胞中的表达及意义*
2013-04-11刘建明马利林周友浪陈瑞新徐骏飞章建国
刘建明,马利林 ,周友浪,陈瑞新 ,徐骏飞 ,章建国,刘 杰
(南通大学附属医院1普外科;2手外科;3病理科,江苏 226001)
胃癌是全球范围内最常见的恶性肿瘤之一,其病死率仅次于肺癌[1]。尽管包括内镜在内的各种诊断及治疗技术有所提高,胃癌病死率有所下降,但由于复发与转移,胃癌总体预后仍很差,5年生存率不到40%[2]。近来研究表明[3-4],肿瘤干细胞(cancer stem cell,CSC)是肿瘤的起源,它决定肿瘤发生、治疗抵抗、肿瘤进展和复发转移。CSC是指肿瘤组织中一小部分亚群细胞,这些细胞具有自我更新能力并能形成异质化(heterogeneous)的肿瘤细胞[5]。针对CSC的研究,关键问题是CSC的分离、纯化与鉴定。根据CSC的特性,有多种方法可分离实体瘤CSC,本文旨在探讨利用悬浮球培养法在胃癌细胞株MKN45中分离出的球体细胞的干细胞特性。
1 材料与方法
1.1 材料 人胃癌细胞株MKN45(上海中科院细胞库);N-2添加剂及B-27添加剂(Invitrogen公司);青链霉素及培养液(Gibco公司);人纤维生长因子-2及表皮生长因子(Chemicon公司);CD44抗体及ECL化学发光试剂(Santa curz公司);DAPI与4%甲醛(Sigma公司),Evagreen TM qPCR Master Mix(Biotium Inc公司);Trizol Reagent试剂盒(Qiagen公司);PCR引物由上海Invitrogen公司合成。
1.2 方法
1.2.1 细胞培养:人胃癌细胞株MKN45在含10%胎牛血清(FBS)的1640培养液中培养。细胞贴壁以后,收集贴壁细胞置于含无血清的1640培养液96孔超低粘附板中培养。培养液中加入1%N-2添加剂,2%B-27添加剂,1% 青链霉素,20 ng/mL人FGF-2和100 ng/mL表皮生长因子。观察悬浮球形成情况,每孔100个细胞,2周后在Olympus倒置显微镜下放大40及100倍观察悬浮球形成情况。当形成的悬浮球长到200~500个细胞时,将悬浮球吹散成1000个/mL细胞的溶液,按每孔100μL单细胞悬液植入含无血清培养液的96孔超低粘附板中,2周后观察第2代悬浮球的形成情况,贴壁细胞作为对照组观察成球情况。
1.2.2 逆转录聚合酶链反应(RT-PCR):以悬浮球体细胞为实验组、贴壁细胞为对照组,分别取1×106个细胞提取总RNA,按照Trizol Reagent试剂盒说明书进行。用分光光度计来检测RNA浓度,取1μg RNA按照Qiagen公司的逆转录试剂盒进行合成cDNA。PCR反应体系为50μL,包括25μL混合物,CD44上、下游引物各1μL,2μLcDNA模板,双蒸水补足到50μL。95℃预变性 10分钟,95℃变性 10秒,60℃退火30秒,72℃延伸30秒扩增40个循环。荧光定量PCR检测各基因的表达,引物序列见表1。操作步骤及加样剂量按照荧光定量PCR试剂盒说明书进行,每组重复实验3次,结果用7500 System Software V 2.0分析。

表1 荧光定量PCR检测各基因表达的引物序列
1.2.3 免疫印迹分析法(Western-Blot analysis):悬浮球或贴壁细胞经含有蛋白酶抑制剂的裂解液裂解,并提取蛋白样本。然后添加变性缓冲液后煮沸备用,用SDS-PAGE在8%~12%的凝胶中分离并转移到PVDF膜上。5%牛奶封闭后加入一抗在4℃条件下孵育过夜(抗-CD441:500),TBST洗3次,然后加入标记辣根过氧化物酶的二抗室温下培养2小时,TBST洗3次,最后蛋白条带经ECL化学发光试剂曝光于柯达胶片上。
1.3 统计学处理 统计分析采用SPSS统计软件包,所有实验至少重复3次,计量资料采用均值±标准差()表示,均值间的差异比较采用 t检验,P<0.05为差异有统计学意义。
2 结 果
2.1 胃癌细胞悬浮球体的形成 胃癌MKN45细胞在无血清培养基中悬浮培养3天即开始形成细胞球体,培养至7天球体大体形成,培养至14天球体基本形成且中心密度増高。培养21天球体完全形成,球体结构饱满,细胞排列致密,中心密度更高(图1)。第1代球体细胞吹散后在无血清培养基中继续培养,形成细胞球体增多,成球率达29.70%±6.21%,而原代贴壁细胞的成球率为3.30%±1.49%,两者比较差异有统计学意义(t=-13.052,P<0.05)。
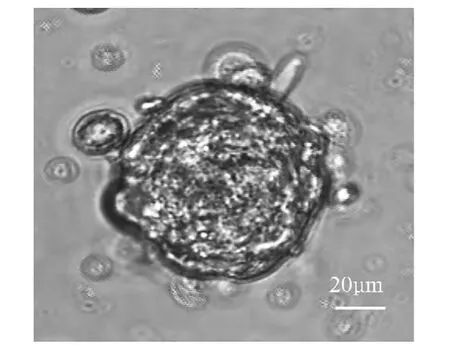
图1 胃癌细胞株MKN45在无血清培养条件下第21天所形成的悬浮球体
2.2 球体细胞中干细胞相关基因CD44的表达 定量PCR显示,球体细胞中干细胞相关基因CD44mRNA的相对含量为1.18±0.04,原代贴壁细胞中干细胞相关基因CD44mRNA的相对含量为1.00±0.05,两者比较差异有统计学意义(t=-4.386,P<0.05)。免疫印迹分析显示球体细胞的CD44的表达高于原代贴壁细胞(图2)。
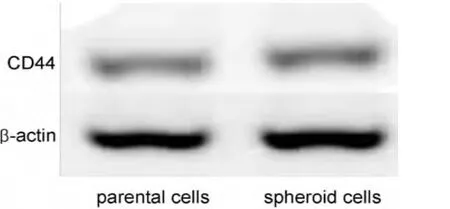
图2 免疫印迹分析检测CD44在原代贴壁细胞及球体细胞中的表达
3 讨 论
目前针对CSCs分离、鉴定有各种不同的方法。有学者利用CSCs表面特异性标志物的荧光激活细胞分选法,这些标志物主要有 CD44、CD133 等[4,6-7]。也有学者利用ABCG2高表达的细胞具有将DNA荧光染料Hoechst 33342排出细胞外的特性,通过流式细胞术分选出边缘细胞群[8-10]。还有学者采用悬浮球体培养法,候选细胞在含成纤维生长因子及表皮生长因子的无血清培养液中培养,能形成悬浮球体的细胞被认为是CSCs[11]。悬浮球培养法正是利用肿瘤干细胞的特性分离鉴定CSC的一种方法。文献报道悬浮球培养法已在许多实体肿瘤中成功分离、鉴定出CSC[12-14]。而应用于胃癌干细胞的分离、鉴定的相关研究报道较为罕见。本研究选用胃癌细胞株MKN45在含人成纤维生长因子及表皮生长因子的无血清培养液中培养,结果显示有一小部分细胞能够形成悬浮球体。且悬浮球体细胞在无血清培养条件下,成球率明显高于原代贴壁细胞,提示悬浮球体细胞富集具有自我更新与增殖的能力的胃癌干细胞。
为了进一步证实悬浮球体细胞的干细胞特性,本研究对胃癌细胞株MKN45悬浮球体细胞中的干细胞相关因子CD44作了检测。CD44是一种多功能的跨膜糖蛋白,在许多正常组织细胞及肿瘤组织中都有不同程度表达[15],也是在实体肿瘤中最早用来分离鉴定CSC的标志物之一。2009年Takaishi等[16]采用CD44作为特异性的分子标志物,分离鉴定胃癌干细胞。Lu Cao等[17]在干细胞培养条件下培养肝癌细胞株PLC/PRF/5,结果PLC/PRF/5能够形成无粘附的3-D球体。免疫印迹检测显示球体细胞中的肝CSC中的CD44,Oct3/4等相关蛋白,明显高于原代贴壁细胞。张波等[18]在体外无血清培养液中悬浮培养前列腺癌PC-3细胞,通过传代更新、诱导分化验证了PC-3悬浮成球细胞具有较强的增殖、自我更新及分化潜能。
本研究对胃癌细胞株MKN45球体细胞及原代贴壁中的CD44mRNA,采用逆转录聚合酶链反应和免疫印迹分析法检测。结果显示,尽管原代贴壁细胞中的CD44mRNA也有一定量表达,但球体细胞中CD44mRNA的表达仍高于原代贴壁细胞。进一步证实胃癌细胞株MKN45在无血清的培养液中,形成的悬浮球体细胞中富集类肿瘤干细胞。原代贴壁细胞中的CD44mRNA一定量的表达提示,CD44并非胃癌干细胞唯一的特异性标志物,如何联合其他分子标志物进一步筛选、纯化胃癌干细胞将是今后研究的方向。
[1]Yasui W,Sentani K,Sakamoto N,et al.Molecular pathology of gastric Cancer:research and practice[J].Pathol Res Pract,2011,207(10):608-612.
[2]Gill S,Shah A,Le N,et al.Asian ethnicity-related differences in gastric Cancer presentation and outcome among patients treated at a Canadian Cancer center[J].J Clin Oncol,2003,21(11):2070-2076.
[3]Marx J.Cancer research.Mutant stem cells May seed Cancer[J].Science,2003,301(5638):1308-1310.
[4]Singh SK,Hawkins C,Clarke ID,et al.Identification of human brain tumour initiating cells[J].Nature,2004,432(7015):396-401.
[5]Clarke MF,Dick JE,Dirks PB,et al.Cancer stem cells--perspectives on current status and future directions:AACR Workshop on Cancer stem cells[J].Cancer Res,2006,66(19):9339-9344.
[6]许新华,苏进,鲁明骞,等.CD44+鼻咽癌细胞的干细胞生物学特性[J].肿瘤防治研究,2011,38(12):1346-1350.
[7]Ricci-Vitiani L,Lombardi DG,Pilozzi E,et al.Identification and expansion of human colon-cancer-initiating cells[J].Nature,2007,445(7123):111-115.
[8]高钢龙,刘文勇,张学利,等.肠癌SW-620肿瘤细胞SP亚群研究[J].中华实验外科杂志,2010,27(8):1052-1054.
[9]Chiba T,Kita K,Zheng YW,et al.Side population purified from hepatocellular carcinoma cells harbors Cancer stem cell-like properties[J].Hepatology,2006,44(1):240-251.
[10]Szotek PP,Pieretti-Vanmarcke R,Masiakos PT,et al.O-varian Cancer side population defines cells with stem celllike characteristics and Mullerian Inhibiting Substance responsiveness[J].Proc Natl Acad Sci U S A,2006,103(30):11154-11159.
[11]Lee J,Kotliarova S,Kotliarov Y,et al.Tumor stem cells derived from glioblastomas cultured in bFGF and EGF more closely Mirror the phenotype and genotype of primary tumors than do serum-cultured cell lines[J].Cancer Cell,2006,9(5):391-403.
[12]许立生,王水,许健,等.无血清悬浮法培养MCF-7细胞系并筛选该细胞系中肿瘤干细胞相关亚群的初步研究[J].中华肿瘤防治杂志,2007,14(10):736-740.
[13]Fujii H,Honoki K,Tsujiuchi T,et al.Sphere-forming stem-like cell populations with drug resistance in human sarcoma cell lines[J].Int J Oncol,2009,34(5):1381-1386.
[14]Rappa G,Mercapide J,Anzanello F,et al.Growth of Cancer cell lines under stem cell-like conditions has the potential to unveil therapeutic targets[J].Exp Cell Res,2008,314(10):2110-2122.
[15]Prince ME,Sivanandan R,Kaczorowski A,et al.Identification of a subpopulation of cells with Cancer stem cell properties in head and neck squamous cell carcinoma[J].Proc Natl Acad Sci U S A,2007,104(3):973-978.
[16]Takaishi S,Okumura T,Tu S,et al.Identification of gastric Cancer stem cells using the cell surface marker CD44[J].Stem Cells,2009,27(5):1006-1020.
[17]Cao L,Zhou Y,Zhai B,et al.Sphere-forming cell subpopulations with Cancer stem cell properties in human hepatoma cell lines[J].BMC Gastroenterol,2011,11:71.
[18]张波,范新兰,林天歆,等.从PC-3细胞中富集前列腺癌干细胞的实验研究[J].江苏医药,2012,38(17):1989-1991.
