唐古特白刺蛋白激酶基因NtCIPK2超表达载体构建及紫花苜蓿转化研究
2013-04-10郑琳琳王佳贺龙梅王学峰王迎春
郑琳琳,王佳,贺龙梅,王学峰,王迎春*
(1.内蒙古大学生命科学学院 内蒙古自治区牧草与特色作物生物技术重点实验室,内蒙古 呼和浩特010021;2.内蒙古和信园蒙草抗旱绿化股份有限公司,内蒙古 呼和浩特010021)
“牧草之王”紫花苜蓿(Medicagosativa)是全世界栽培历史最悠久、种植面积最广、利用价值最高的一种豆科多年生优质牧草,广泛种植于以畜牧业为支柱产业的中国西北地区[1-2]。然而这些地区多具有干旱、高盐、低温等生境特点,严重制约着苜蓿生长发育和产量。因此,通过转基因手段培育具有多重抗逆能力的优良品种,对于苜蓿产业的可持续发展具有举足轻重的作用。
在植物应对非生物胁迫的防御机制中,Ca2+作为第二信使发挥着重要的作用[3]。CIPK(CBL-interacting protein kinase)是近年来鉴定的一类丝氨酸/苏氨酸蛋白激酶,可与上游植物特有的Ca2+传感器钙调磷酸酶B类似蛋白(calcineurin B-like proteins,CBLs)结合,识别并传递胞质钙信号,引发细胞内一系列应激反应[4-5]。通过生物信息学分析,在模式植物拟南芥(Arabidopsisthaliana)和水稻(Oryzasativa)基因组中分别发现26和30个CIPK基因[6],后在银杨(Populustrichocarpa)[7]、葡萄(Vitisvinifera)[8]、高粱(Sorghumbiocolor)[9]和玉米(Zeamays)[10-11]中相继获得多个CIPK家族成员。多项研究表明,CIPK广泛参与植物对高盐、低钾和干旱等外界刺激的应答反应[12-14],在拟南芥、水稻、烟草(Nicotianatabacum)等植物中过量表达不同CIPK基因均可提高转基因植株的抗逆能力[15-18]。
本实验以唐古特白刺(Nitrariatangutorum)cDNA为模板,利用PCR技术克隆获得NtCIPK2完整编码序列(complete coding sequence,CDS),在此基础上构建含有该序列的植物表达载体pPZP221-NtCIPK2,采用农杆菌介导法对紫花苜蓿进行遗传转化,经PCR及RT-PCR验证,获得了超表达NtCIPK2基因的转化植株,为利用转基因手段选育抗逆苜蓿新品种奠定基础。
1 材料与方法
1.1 材料
本实验于2012年9月开始进行。紫花苜蓿“中苜一号”种子由中国农业科学院草原研究所孙启忠研究员惠赠。大肠杆菌DH5α、农杆菌GV3101、植物表达载体pPZP221由内蒙古大学牧草与特色作物生物技术省部共建教育部重点实验室提供。
氨苄青霉素(ampicillin,Amp)、壮观霉素(spectinomycin,Spe)、庆大霉素(gentamycin,Gen)、头孢霉素(cefotaxime,Cef)等抗生素购自Sigma公司;2,4-二氯苯氧乙酸(2,4-dichlorophenoxyacetic acid,2,4-D)、激动素(kinetin,KT)、6-苄氨基腺嘌呤(6-benzylaminopurine,6-BA)、萘乙酸(1-naphthylacetic acid,NAA)等植物激素购自Sangon公司;DNA限制性内切酶、T4DNA连接酶购自Fermentas公司,Taq酶、Marker购自TransGen公司;总RNA分离采用RNAiso试剂(Takara),cDNA合成采用 M-MLV Reverse Transcriptase Kits反转录试剂盒(Promega),基因组DNA提取采用Plant Genomic DNA Kit试剂盒(Tiangen);寡核苷酸引物合成和产物测序由Invitrogen公司承担;其他化学试剂均为国产分析纯。
苜蓿遗传转化所需培养基如下:无菌苗生长,1/2MS(Murashige and Skoog)培养基;预培养及共培养培养基,MS+2mg/L 2,4-D+0.5mg/L KT;愈伤组织诱导培养基,MS+2mg/L 2,4-D+0.5mg/L KT+500mg/L Cef;分化培养基,MS+0.5mg/L 6-BA+0.05mg/L NAA+200mg/L Cef+30mg/L Gen;生根培养基,1/2MS+0.3%活性炭。
1.2 研究方法
1.2.1NtCIPK2CDS的克隆 按照RNAiso总RNA抽提试剂盒的操作说明提取唐古特白刺叶片总RNA,用1%的琼脂糖凝胶鉴定其质量和完整性;利用M-MLV Reverse Transcriptase Kits反转录试剂盒将1μg RNA反转录为cDNA,并最终将其稀释为20ng/μL。
根据本实验室提交的NtCIPK2序列(GenBank登录号KC823044),设计1对用于扩增其编码区cDNA的引物[NCF:5′-CGCGGATCCATGATGGAACACAA-3′和 NCR:5′-CGGGGT ACCCTAATGGTAATGCT-3′]。酶切位点用下划线表示,分别为BamHⅠ和KpnⅠ。以合成的cDNA作为模板,利用高保真酶扩增NtCIPK2 CDS。PCR反应体系为25μL,内含2mmol/L Mg2+、200μmol/L dNTPs、引物各1.0μmol/L,Taq DNA 聚合酶1.0U,20ng模板。PCR扩增程序为94℃预变性5min;然后94℃变性30s,55℃退火30s,72℃延伸1min,共35个循环,最后72℃延伸10min。将PCR产物插入pMD-19Tsimple载体(Takara)中,命名为pMD-Nt-CIPK2,转化大肠杆菌DH5α,经菌体PCR检测的阳性克隆进行双向测序。
1.2.2 植物表达载体的构建 选取测序正确的阳性克隆提取质粒,利用限制性内切酶BamHⅠ和KpnⅠ双酶切pMD-NtCIPK2和pPZP221质粒,琼脂糖凝胶检测后回收目的片段,T4DNA连接酶连接过夜,转化大肠杆菌DH5α,在含有Spe抗性的LB(Luria-Bertani)平板中筛选阳性菌落,经PCR检测和双酶切鉴定,获得植物表达载体pPZP221-NtCIPK2。
1.2.3 农杆菌介导的紫花苜蓿遗传转化 采用CaCl2冻融法将植物表达载体pPZP221-NtCIPK2转入农杆菌GV3101中,在筛选培养基(LB+50mg/L Rif+100mg/L Spe+50mg/L Gen)上获得转化菌落,经PCR鉴定后保存备用。
选取颗粒饱满的苜蓿种子,利用75%的酒精和0.1%的HgCl2溶液分别消毒1和10min,无菌水清洗3~5次,用灭菌滤纸吸干种子上的多余水分,置于1/2MS培养基中萌发。切取7d龄无菌苗的下胚轴作为受体材料,预培养3d后,将其浸泡于活化的农杆菌菌液中侵染15min,在共培养培养基中避光生长3~5d。形成愈伤组织后,经分化筛选培养和生根培养得到紫花苜蓿抗性转化植株。待再生苜蓿根与地上部分均长至10cm左右时,移入营养土中继续培养。
1.2.4 转化植株的检测设计1对引物[aacC1F:5′-GGATCGTCACCGTAATCTGCT-3′和 aacC1R:5′-GCTCCGTAGTAAGACATTCATCG-3′],用于扩增载体中的庆大霉素抗性基因aacC1,扩增长度为246bp。以转基因抗性苜蓿的基因组DNA作为模板,质粒pPZP221和野生型紫花苜蓿基因组DNA为阳性和阴性对照,进行PCR扩增和电泳分析。PCR反应体系为25μL,内含2mmol/L Mg2+、200μmol/L dNTPs、引物各1.0 μmol/L,Taq DNA聚合酶1.0U,20ng模板。PCR反应程序为94℃预变性5min;然后94℃变性20s,55℃退火20s,72°C延伸20s,共35个循环。
提取转化植株总RNA,反转录合成cDNA,利用NCF和NCR引物扩增目的基因。质粒pPZP221-NtCIPK2和野生型紫花苜蓿cDNA用作阳性对照和阴性对照。PCR体系和反应条件与NtCIPK2基因克隆相同,通过1%琼脂糖凝胶电泳分析扩增产物。
检测实验重复3次,以确定NtCIPK2基因在苜蓿中的整合及表达。
2 结果与分析
2.1 NtCIPK2基因CDS的获得
以唐古特白刺cDNA作为模板进行PCR扩增,获得1条1362bp的DNA片段,与预期结果相符(图1)。将PCR产物切胶回收,连接到载体pMD-19T上,转化大肠杆菌,阳性克隆进一步测序验证。测序结果表明该片段与GenBank中公布的序列完全一致,成功的克隆获得NtCIPK2的CDS。
2.2 植物表达载体pPZP221-NtCIPK2的鉴定
以pPZP221为基本骨架,通过双酶切切出的末端之间的连接将外源基因NtCIPK2插入其中,获得植物表达载体pPZP221-NtCIPK2(图2)。提取重组质粒,应用NCF和NCR引物进行PCR扩增,结果显示均扩增出1350bp左右的预期片段(图3);同时对重组质粒进行双酶切鉴定,电泳分析表明重组质粒可以切出两个片段,大片段为载体序列,约为9.8kb,小片段为NtCIPK2基因,约为1.4kb(图4)。

图1 NtCIPK2基因CDS的PCR扩增Fig.1 PCR amplification of NtCIPK2CDS
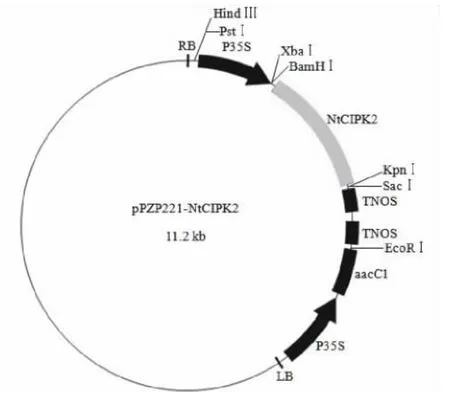
图2 植物表达载体pPZP221-NtCIPK2质粒图谱Fig.2 Map of plant transformation vector pPZP221-NtCIPK2
2.3 农杆菌转化
随机挑取5个转化菌落进行PCR鉴定,均可扩增出目的条带(图5),表明载体pPZP221-NtCIPK2已成功转入农杆菌,可用于后续苜蓿的转化。
2.4 紫花苜蓿抗性转化植株的获得
将预培养的紫花苜蓿下胚轴,加入活化的农杆菌中侵染15min,共培养3d后,在愈伤组织诱导培养基上生长15d左右,形成愈伤组织(图6A),将浅黄色的愈伤组织分别接入分化培养基中继续培养,直至绿色再生芽产生(图6B),最后切下再生芽转入生根培养基中生成再生植株(图6C),经炼苗移栽至营养土中继续培养(图6D)。
2.5 再生植株的检测
对获得的7株抗性幼苗进行庆大霉素抗性基因aacC1的鉴定,PCR产物电泳分析表明所有幼苗均克隆得到长约250bp的条带,与预期结果相符(图7),证明外源基因确已整合到紫花苜蓿基因组中。

图3 pPZP221-NtCIPK2的PCR鉴定Fig.3 PCR analysis of pPZP221-NtCIPK2

图4 pPZP221-NtCIPK2的双酶切鉴定Fig.4 Double digestion of pPZP221-NtCIPK2
同时对抗性苗进行NtCIPK2基因的RT-PCR检测,结果显示其中的3株扩增获得大小一致的目的条带,其他4株幼苗无扩增条带(图8),这可能是由于基因插入位点的差异引发的基因沉默所致。结果说明NtCIPK2基因在3株转基因幼苗中可以正常表达。
3 讨论

图5 pPZP221-NtCIPK2导入农杆菌的PCR检测Fig.5 PCR analysis of pPZP221-NtCIPK2transformed Agrobacterium tumefaciens
自1986年Deak等[19]首次报道利用转基因技术获得抗逆苜蓿植株以来,利用基因工程手段提高苜蓿抗逆性状已成为苜蓿育种的重要途径[20-24]。将拟南芥冷诱导转录因子AtCBF1[25]和AtCBF2[26]导入和田苜蓿或“Hunter-river”苜蓿中,经PCR检测得到了阳性转化植株,为紫花苜蓿抗寒新品种的选育奠定了基础;燕丽萍等[27-29]采用分子生物学检测手段和不同浓度NaCl对转甜菜碱醛脱氢酶BADH基因苜蓿进行研究,证实BADH基因可以稳定遗传,且转基因苜蓿耐盐性明显高于对照,最终获得综合性状优良的耐盐苜蓿新品种“山苜2号”;李燕等[30]构建了紫花苜蓿MsZIP基因超表达载体并对转基因苜蓿进行检测,结果表明该基因的超表达可以提高苜蓿的耐盐性和耐旱性;Liu等[31]将角果碱蓬(Suaedacorniculata)液泡膜Na+/H+逆向转运蛋白ScNHX1和液泡质子ATP酶ScVP基因共转化紫花苜蓿,发现转化植株在盐胁迫和盐碱复合胁迫条件下存活,而野生植株则萎黄死亡;在紫花苜蓿过量表达苏打猪毛菜(Salsolasoda)SsNHX1基因,成功获得迄今所有报道中耐盐能力最强的转化植株,可以在400mmol/L NaCl中正常生长超过50d[32]。
近期的研究证实CIPK2基因在植物传递钙信号,应答外界刺激的过程中发挥着重要的作用。Chen等[10]发现玉米ZmCIPK2受盐、干旱、低温和高温诱导上调表达,表达量在根和叶中存在差异;高盐、干旱和ABA处理均可增加盐生植物短芒大麦草(Hordeumbrevisubulatum)HbCIPK2的表达量,且超表达HbCIPK2的转基因拟南芥抵抗盐和渗透胁迫的能力显著上升[33];本实验室从盐生植物唐古特白刺中克隆获得NtCIPK2基因,并将其转入大肠杆菌,发现转化菌株对高盐、干旱、低温及高温的抗性明显提高(未发表数据)。上述研究表明CIPK2的表达可能是植物具有多种抗性的基础,因此可以作为遗传转化的候选基因。

图6 转化再生植株Fig.6 Obtaining the transformed plants

图7 再生植株庆大霉素抗性基因检测Fig.7 Detection of aacC1gene in regeneration plants

图8 再生植株目的基因检测Fig.8 Detection of NtCIPK2gene in regeneration plants
本研究获得抗性紫花苜蓿转化植株,经PCR和RT-PCR检测发现外源基因已整合到苜蓿基因组中并过量表达,为进一步研究转化植株在各种逆境胁迫条件的表现及其遗传稳定性,培育具有多重抗逆能力的苜蓿品种,促进苜蓿产业发展提供参考。
[1] 曹宏,章会玲,盖琼辉,等.22个紫花苜蓿品种的引种试验和生产性能综合评价[J].草业学报,2011,20(6):219-229.
[2] 张立全,张凤英,哈斯阿古拉.紫花苜蓿耐盐性研究进展[J].草业学报,2012,21(6):296-305.
[3] Knight H.Calcium signaling during abiotic stress in plants[J].International Review of Cytology,2000,195:269-324.
[4] Kim K N,Cheong Y H,Gupta R,etal.Interaction specificity ofArabidopsiscalcineurine B-like calcium sensor and their target kinases[J].Plant Physiology,2000,124:1844-1853.
[5] 赵晋锋,余爱丽,王高鸿,等.植物CBL/CIPK网络系统逆境应答研究进展[J].中国农业科技导报,2011,13(4):32-38.
[6] Kolukisaoglu,Weinl S,Blazevic D,etal.Calcium sensors and their interacting protein kinases:genomics of theArabidopsisand rice CBL-CIPK signaling networks[J].Plant Physiology,2004,134:43-58.
[7] Yu Y H,Xia X L,Yin W L,etal.Comparative genomic analysis of CIPK gene family inArabidopsisandPopulus[J].Plant Growth Regulation,2007,52:101-110.
[8] Weinl S,Kudla J.The CBL-CIPK Ca2+-decoding signaling network:function and perspectives[J].New Phytologist,2009,184:517-528.
[9] Li L B,Zhang Y R,Liu K C,etal.Identification and bioinformatics analysis of SnRK2and CIPK family genes in sorghum[J].Agriculture Science in China,2010,9:19-31.
[10] Chen X F,Gu Z M,Xin D D,etal.Identification and characterization of putative CIPK genes in maize[J].Journal of Genetics and Genomics,2011,38:77-87.
[11] 陈勋基,李建平,郝晓燕,等.玉米ZmCIPK21基因的克隆与分析[J].核农学报,2012,26(6):0862-0867.
[12] Cheng N H,Pittman J K,Zhu J K,etal.The protein kinase SOS2activates theArabidopsisH+/Ca2+antiporter CAX1to integrate calcium transport and salt tolerance[J].Journal of Biological Chemistry,2004,279:2922-2926.
[13] 李莉,李毅,王长春,等.番茄LeCIPK3的克隆及非生物胁迫诱导的表达分析[J].植物生理学通讯,2010,46(7):659-663.
[14] Chen L,Ren F,Zhou L,etal.TheBrassicanapuscalcineurin B-Like 1/CBL-interacting protein kinase 6 (CBL1/CIPK6)component is involved in the plant response to abiotic stress and ABA signaling[J].Journal of Experimental Botany,2012,63:6211-6222.
[15] 聂红资,杨铁钊,杨志晓,等.不同供钾水平下转AtCIPK23基因烟草钾吸收特征的研究[J].河南农业科学,2009,6:53-56.
[16] Zhao J F,Sun Z F,Zheng J,etal.Cloning and characterization of a novel CBL-interacting protein kinase from maize[J].Plant Molecular Biology,2009,69:661-674.
[17] Hu D G,Li M,Luo H,etal.Molecular cloning and functional characterization of MdSOS2reveals its involvement in salt tolerance in apple callus andArabidopsis[J].Plant Cell Reports,2012,31:713-722.
[18] 冯娟,范昕琦,徐鹏,等.棉属野生种旱地棉蛋白激酶基因GarCIPK8的克隆与功能分析[J].作物学报,2013,39(1):34-42.
[19] Deak M,Kiss G B,Korkz C,etal.Transformation ofMedicagoby agrobacterium mediated gene transfer[J].Plant Cell Reports,1986,5:97-100.
[20] 周岩,张洁,袁重要,等.紫花苜蓿转基因技术及其应用的研究进展[J].生物技术通报,2012,8:17-23.
[21] 王鸣刚,骆焕涛,李志忠,等.AtPCS1基因表达载体的构建与转化苜蓿的研究[J].草业科学,2011,28(2):201-206.
[22] 王瑛,朱宝成,孙毅,等.外源lea3基因转化紫花苜蓿的研究[J].核农学报,2007,21(3):249-252.
[23] 刘晓琳,康俊梅,孙彦,等.MsNHX1基因转化紫花苜蓿及转基因植株的鉴定[J].草地学报,2008,16(2):115-120.
[24] 甘智才,陈东颖,张丽,等.转柠檬酸合成酶基因苜蓿耐铝性研究[J].中国农业科学,2010,43(16):3461-3466.
[25] 徐春波,王勇,赵海霞,等.冷诱导转录因子AtCBF1转化紫花苜蓿的研究[J].草业学报,2012,21(4):168-174.
[26] 刘晓静,郝凤,张德罡,等.抗冻基因CBF2表达载体构建及转化紫花苜蓿的研究[J].草业学报,2011,20(2):193-200.
[27] 燕丽萍,夏阳,梁慧敏,等.转BADH基因苜蓿T1代遗传稳定性和抗盐性研究[J].草业学报,2009,18(6):65-71.
[28] 燕丽萍,夏阳,毛秀红,等.转BADH基因紫花苜蓿山苜2号品种的抗盐性鉴定及系统选育[J].植物学报,2011,46(3):293-301.
[29] Yan L P,Liu C L,Liang H M,etal.Physiological responses to salt stress of T2alfalfa progenies carrying a transgene for betaine aldehyde dehydrogenase[J].Plant Cell,Tissue and Organ Culture,2012,108:191-199.
[30] 李燕,孙彦,杨青川,等.紫花苜蓿MsZIP基因超表达载体的构建及转基因苜蓿检测[J].草业学报,2012,21(6):182-189.
[31] Liu L,Fan X D,Wang F W,etal.Coexpression ofScNHX1andScVPin transgenic hybrids improves salt and saline-alkali tolerance in Alfalfa(MedicagosativaL.)[J].Journal of Plant Growth Regulation,2013,32:1-8.
[32] Li W F,Wang D L,Jin T C,etal.The vacuolar Na+/H+antiporter geneSsNHX1from the halophyteSalsolasodaconfers salt tolerance in transgenic Alfalfa(MedicagosativaL.)[J].Plant Molecular Biology Reporter,2011,29:278-290.
[33] Li R F,Zhang J W,Wu G Y,etal.HbCIPK2,a novel CBL-interacting protein kinase from halophyteHordeumbrevisubulatum,confers salt and osmotic stress tolerance[J].Plant Cell and Environment,2012,35:1582-1600.
