劲直黄芪水浸提液化感作用研究
2013-04-10胡远彬陈俊肖天昊呼天明许岳飞
胡远彬,陈俊,肖天昊,呼天明,许岳飞
(西北农林科技大学动物科技学院,陕西 杨凌712100)
化感抑草就是利用化感作用控制杂草的生长发育[1],主要通过茎叶挥发、茎叶淋溶、根系分泌以及植物残株的腐解等途径向环境中释放化感物质来发挥抑制作用[2-3]。研究证明毛苕子(Viciavillosa)、紫花苜蓿(Medicagosativa)和白三叶(Trifoliumrepens)[4]及红三叶(Trifoliumpratense)[5]有化感抑草的潜力,高粱(Sorghumbicolor)、水稻(Oryzasativa)、小麦(Triticumaestivum)和玉米(Zeamays)等的一些品种能抑制杂草的萌发和生长[6]。近年来,随着世界各国对高效低毒“绿色农药”的追求,从有毒植物资源中筛选生物农药成分成为人们关注的热点,主要集中在抗菌和杀虫方面[7],化感抑草方面的研究却少见报道。张宝琛等[8]对青海高寒草甸人工草场自然退化中的化感作用进行研究,表明天然有毒植物存在化感作用,这可能是导致草场自然退化的重要原因。研究有毒植物的化感作用,利用有毒植物的化感物质开发除草剂,将是解决草地退化和有毒植物总体利用的一项有效措施[9]。
劲直黄芪(Astragalusstrictus)是豆科黄芪属多年生草本植物,主要分布在西藏各地及青海、四川部分地区[10]。劲直黄芪为有毒植物,其主要有毒成分为苦马豆素(swainsonine)[11],与棘豆属(Oxytropis)的一些有毒植物统称为疯草[12],家畜大量采食后会出现中毒死亡[13],同时劲直黄芪的迅速繁殖蔓延,会使草场草群结构劣变,导致草地退化[14]。因此,对劲直黄芪有毒成分的研究、毒草的控制及防除[10-14]成为减少其危害畜牧业及草地生态的最直接途径而深受关注,但其开发利用方面的研究较少,且在化感作用方面的研究尚未见报道。因此,本实验选择燕麦(Avenasativa)、反枝苋(Amaranthusretroflexus)、白三叶和荠菜(Capsellabursa-pastoris)为受体植物,研究劲直黄芪地上部分水浸提液对受体种子萌发和幼苗生长的影响,并研究其对燕麦和白三叶幼苗体内超氧化物歧化酶(SOD)、过氧化物酶(POD)活性及丙二醛(MDA)含量的影响,初步探讨其化感作用机理,为进一步研究劲直黄芪次生物质,进而开发生物源除草剂、揭示高寒草地退化机制及合理地开发利用奠定基础。
1 材料与方法
1.1 材料
供体植物劲直黄芪于2011年9月采自西藏自治区工布江达县松多三村。将劲直黄芪地上部分自然干燥、粉碎后保存在4℃冰箱下备用;受体植物为燕麦、反枝苋、白三叶和荠菜,种子由西北农林科技大学草业科学系提供。
1.2 试验方法
1.2.1 提取液的制备 取粉碎的劲直黄芪地上部分70g,置于三角瓶中,加10倍体积的蒸馏水,室温下超声30 min后抽滤,得到质量浓度为100.0mg/mL的水浸提液原液,再将原液稀释成质量浓度为12.5,25.0和50.0 mg/mL的浸提液,保存在4℃冰箱中备用。
1.2.2 种子萌发实验 采用培养皿滤纸法[15],将铺有2层滤纸的培养皿中分别加入5mL不同浓度的提取液,再把预先打破休眠和经消毒处理的受体植物种子均匀摆放于培养皿中,根据4种植物种子大小的不同,燕麦每皿30粒,反枝苋、白三叶和荠菜每皿50粒,每个处理3个重复,以蒸馏水处理为对照,于25℃培养箱内培养,光照周期为12h。每天等量补充少量水浸提液(对照加蒸馏水),保持滤纸湿润。记录种子每天的萌发情况(以胚根或胚轴突破种皮达1~2mm为发芽标准),连续记录7d,7d后测定苗高、根长及鲜重,并计算种子发芽率。
1.2.3 劲直黄芪对燕麦和白三叶生理生化指标的影响 参照郝建军等[16]实验指导,分别采用邻苯三酚自氧化法、愈伤木酚氧化法和硫代巴比妥酸法测定SOD、POD的活性以及MDA的含量。
1.2.4 数据处理 参照沈慧敏等[17]和李美等[18]的方法进行测试,测试指标包括受体种子发芽率、幼苗根长、苗高及鲜重。

化感效应指数(RI)[19]用以下公式表示:

式中,C为对照值,T为处理值,RI为化感效应指数,RIT表示幼苗生长化感综合效应指数,RIr表示根长化感效应指数;RIs表示苗高化感效应指数;RIf表示幼苗鲜重化感效应指数。当RI>0时,表示促进作用;当RI<0时,表示抑制作用,其绝对值的大小反映化感作用的强弱。
1.3 数据统计分析
试验数据采用Excel 2003作图,SPSS 17.0软件对各处理间种子萌发和幼苗生长等特性进行显著性分析。
2 结果与分析
2.1 劲直黄芪水浸提液对种子萌发的影响

图1 劲直黄芪水浸提液对受体植物种子发芽率的影响Fig.1 Effect of aqueous extracts fromA.strictus on seed germination rate of receptor plants
从图1可以看出,随着劲直黄芪水浸提液浓度的升高,4种受体植物的发芽率均呈降低趋势。12.5和25.0mg/mL的劲直黄芪水浸提液虽降低了燕麦和荠菜种子的发芽率,但差异不显著(P>0.05);50.0和100.0mg/mL的水浸提液显著降低了它们种子的发芽率(P<0.05),其中荠菜发芽率下降的幅度较大,其RI值分别为-0.620和-0.898。25.0,50.0和100.0mg/mL水浸提液显著地抑制了反枝苋和白三叶种子的发芽率(P<0.05),且随着水浸提液浓度的升高,种子的发芽率迅速下降;当水浸提液浓度为100.0mg/mL时,完全抑制了反枝苋种子的发芽,其RI值为-1.0。
2.2 劲直黄芪水浸提液对幼苗生长的影响
2.2.1 劲直黄芪水浸提液对幼苗根长的影响4种受体植物幼苗的根长随着劲直黄芪水浸提液浓度的升高而不断降低(表1),即受体幼苗根长所受的抑制作用随之增强。与对照相比,12.5mg/mL的水浸提液显著抑制了燕麦和反枝苋根的生长(P<0.05),其RI值分别为-0.194和-0.261,但对白三叶和荠菜根生长的抑制作用不显著(P>0.05);当水浸提液浓度为25.0和50.0mg/mL,4种受体植物的根长均受到了抑制,且差异显著(P<0.05);浓度为100.0mg/mL时,抑制作用达到最大,燕麦、反枝苋、白三叶和荠菜的RI值分别为-0.730,-1.00,-0.928和-0.802,其中对反枝苋的化感抑制作用最强。

表1 劲直黄芪水浸提液对受体植物幼苗根长的影响Table 1 Effect of aqueous extracts fromA.strictus on root length of receptor plant seedlings cm
2.2.2 劲直黄芪水浸提液对幼苗苗高的影响 劲直黄芪水浸提液对4种受体植物苗高的影响见表2。随着浸提液浓度的升高,燕麦苗高所受到的抑制作用随之增强,在50.0和100.0mg/mL时所受的抑制作用显著高于其他处理(P<0.05),RI值分别为-0.292和-0.516。反枝苋和白三叶苗高的化感作用表现为低浓度促进高浓度抑制的特点,其中浓度为12.5和25.0mg/mL时显著地促进了反枝苋苗的生长(P<0.05),RI值分别为0.413和0.274,而对白三叶的促进作用不显著(P>0.05),之后随着水浸提液浓度的升高对反枝苋和白三叶均表现为显著的抑制作用(P<0.05)。与对照相比,荠菜所受到的化感作用均表现为显著地促进作用(P<0.05),在浓度为12.5mg/mL时达到最大,RI值为0.583,之后随着浓度的加大,促进作用随之减弱。

表2 劲直黄芪水浸提液对受体植物幼苗苗高的影响Table 2 Effect of aqueous extracts fromA.strictus on seedling height of receptor plant seedlings cm
2.2.3 劲直黄芪水浸提液对幼苗鲜重的影响 劲直黄芪水提液对燕麦的鲜重有抑制作用(表3),且随提取液浓度的升高抑制作用不断增强,其中浓度为50.0和100.0mg/mL时受到的抑制作用显著高于其他处理(P<0.05),RI值分别为-0.376和-0.543。12.5和25.0mg/mL对反枝苋、白三叶和荠菜的鲜重均有促进作用,且浓度为12.5mg/mL时对反枝苋和荠菜鲜重的促进作用显著高于对照(P<0.05),RI值分别为0.392和0.555,之后随着浓度的升高,这种促进作用变为抑制作用,在100.0mg/mL时达到最大。
2.2.4 劲直黄芪水浸提液对4种植物幼苗生长化感综合效应的影响 为了探明劲直黄芪水浸提液对4种植物幼苗生长的影响,采用了化感综合效应指数(图2)。随着劲直黄芪水浸提液浓度的升高,燕麦所受到的抑制作用逐渐增强。反枝苋、白三叶和荠菜呈“低促高抑”的化感作用,浓度为12.5mg/mL时,对反枝苋和白三叶起促进作用,其他浓度下均为抑制作用,100.0mg/mL时反枝苋受到的抑制作用最大;当浓度为12.5和25.0mg/mL时,对荠菜起促进作用,50.0和100.0mg/mL时为抑制作用。
2.3 劲直黄芪水浸提液对燕麦和白三叶幼苗体内抗氧化物酶活性的影响
2.3.1 对燕麦和白三叶幼苗体内POD活性影响 由图3可知,随着劲直黄芪水浸提液浓度的升高,燕麦POD活性呈显著上升的趋势(P<0.05),在浓度为100.0mg/mL时达到最大,是对照的1.2倍。白三叶幼苗POD活性呈先降低,再升高,然后降低的趋势,在浓度为25.0mg/mL时POD活性最低,但与对照差异不显著(P>0.05),之后随着浸提液浓度的升高白三叶POD活性显著增加(P<0.05),在50.0mg/mL时达到最高值,而当水浸提液浓度继续增大至100.0mg/mL时,其POD活性显著下降(P<0.05),较最高值降低了6.8%。

表3 劲直黄芪水浸提液对受体植物幼苗鲜重的影响Table 3 Effect of aqueous extracts fromA.strictus on fresh weight of receptor plant seedlings g/株Plant
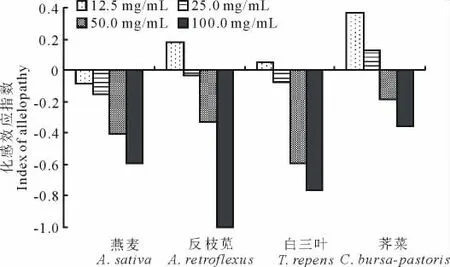
图2 劲直黄芪水浸提液对受体植物幼苗生长的化感综合效应的影响Fig.2 Effect of aqueous extracts fromA.strictus on the index of allelopathy in receptor’s seedling growth

图3 劲直黄芪水浸提液对燕麦和白三叶幼苗POD活性的影响Fig.3 Effect of aqueous extracts fromA.strictus on POD activity of A.sativaand T.repens
2.3.2 对燕麦和白三叶幼苗体内SOD活性影响 燕麦和白三叶幼苗体内SOD活性均随劲直黄芪地上部分水浸提液浓度的升高呈先升高后降低的趋势(图4),其中对白三叶SOD活性的作用表现更为明显。燕麦在0~50.0mg/mL时,其SOD活性呈上升趋势,50.0mg/mL时显著高于其他处理(P<0.05),之后随劲直黄芪水浸提液浓度升高而缓慢下降(P>0.05)。白三叶幼苗在12.5~50.0mg/mL浓度范围之间时,其体内SOD活性明显增加(P<0.05),在50.0mg/mL时达到最大,较对照增加了1.1倍,当浓度升高到100.0mg/mL时,其SOD活性显著降低(P<0.05),与最高值相比降低了54%,但与对照差异不显著(P<0.05)。
2.3.3 对燕麦和白三叶幼苗体内MDA含量的影响 从图5可以看出,随着劲直黄芪水浸提液浓度的升高,燕麦和白三叶幼苗体内MDA含量也随之显著增加(P<0.05)。劲直黄芪水浸提液浓度为50.0mg/mL时,燕麦和白三叶幼苗的MDA含量迅速增加(P<0.05),分别是对照的1.3和1.4倍。当水浸提液浓度增加到100.0 mg/mL时,燕麦和白三叶幼苗的MDA含量明显增加且达到最大值(P<0.05)。在50.0~100.0mg/mL范围内,劲直黄芪水浸提液对燕麦和白三叶幼苗的伤害较大。

图4 劲直黄芪水浸提液对燕麦和白三叶幼苗SOD活性的影响Fig.4 Effect of aqueous extracts fromA.strictus on SOD activity of A.sativaand T.repens

图5 劲直黄芪水浸提液对燕麦和白三叶幼苗MDA含量的影响Fig.5 Effect of aqueous extracts fromA.strictus on MDA content of A.sativaand T.repens
3 讨论与结论
植物化感作用是普遍存在于自然界的一种生态机制,在植被的形成和演替、农作物耕作制度的合理安排,新一代无公害农药与植物生长发育调节剂的开发方面有着广泛的应用前景[20]。因此,近年来受到世界各国科学家的重视,逐步形成了一个新的研究领域[21]。本研究就劲直黄芪的化感作用进行了研究,结果表明,地上部分水浸提液对受体植物燕麦、反枝苋、白三叶和荠菜的种子萌发和幼苗生长有较强的化感作用。燕麦种子萌发和幼苗生长均表现为抑制作用,且随着劲直黄芪水浸提液浓度的升高其抑制程度不断增强,这与耿广东等[22]研究香草醛对莴苣(Lactucasativa)种子发芽和幼苗生长的结果一致。反枝苋、白三叶和荠菜种子萌发均为抑制作用,幼苗生长基本上呈“低促高抑”的化感作用,其中反枝苋在浸提液浓度为100.0mg/mL时,种子萌发和幼苗生长均被完全抑制了。可见,受试物种不同对劲直黄芪化感作用的响应不同,说明不同植物对化感物质的敏感性不同,以反枝苋最为敏感,白三叶和荠菜次之,燕麦最弱。由于发挥化感作用的化感物质具有选择性和专一性,同一种化感物质作用于不同的植物可能产生不同的效果[23],这4种受体植物属于不同的科属,种子大小不同,以燕麦的种子最大。此外,还与化感物质的浓度有关,同一受体植物对不同浓度的化感物质会有不同的响应,一般在高浓度下表现为强烈抑制作用,在低浓度下作用不显著或起促进作用[24]。
植物在逆境条件下会增加细胞内活性氧自由基含量,导致细胞膜损伤,引发质膜过氧化作用[25]。SOD和POD是植物细胞内的保护酶,可以在一定程度上抵御各种环境因子造成的氧化胁迫[26]。MDA是膜质过氧化产物之一,其含量的高低表示细胞膜脂过氧化的程度和植物对逆境条件反应的强弱[27]。鲁艳等[28],刘慧芹等[29]和樊瑞苹等[30]就是通过对植物抗氧化酶及膜质过氧化程度的研究,来探索重金属Ni和Cu、Pb和盐这些逆境因子的胁迫对受体植物的影响。Yu等[31]认为,不同的化感物质都会对SOD、POD活性及 MDA含量产生一定的影响,浓度及不同物质的互作关系明显影响这些指标的活性。本实验结果表明,当劲直黄芪水浸提液作用于燕麦和白三叶后,随浓度的增加,燕麦的POD活性表现为升高的趋势,而白三叶表现为先降低后升高再降低的趋势,SOD活性均为先上升后下降,MDA含量逐渐增加。在劲直黄芪水浸提液浓度为50.0mg/mL时,燕麦和白三叶幼苗体内POD、SOD活性和MDA含量均明显增加(P<0.05),可能是幼苗受到化感胁迫后,体内过氧化产物增多而启动的一种应激机制[32],以诱导幼苗体内抗氧化能力增加。但当浓度升高到100.0mg/mL时,保护酶活性下降,产生过多的MDA,是由于随着化感胁迫的进一步加大,幼苗体内氧化产物累积量已超过SOD和POD的调节范围,不能全面有效清除活性氧而造成积累,使得酶活性下降,膜脂过氧化作用加强[33],影响受体植物细胞的正常代谢,最终抑制了植物生长。
本研究仅在实验室条件下,首次对分布于西藏自治区的劲直黄芪地上部分水浸提液的化感作用及机理进行了研究,对于劲直黄芪发挥作用的化感物质及室外自然条件下化感作用的发挥还需进一步探讨,以揭示有毒植物繁殖蔓延对天然草地草场退化的影响,也为开发出生物源除草剂提供理论依据。
[1] 高承芳,林仕欣,张晓佩,等.牧草化感抑草作用研究进展[J].家畜生态学报,2012,33(1):99-102.
[2] 阎飞,杨振明,韩丽梅.植物化感作用及其作用物的研究方法[J].生态学报,2000,20(4):692-696.
[3] 林娟,殷全玉,杨丙钊,等.植物化感作用研究进展[J].植物生理科学,2007,23(1):68-72.
[4] 王瑞龙,张墨溪,宋圆圆,等.豆科牧草对4种农田常见杂草和水稻化感作用的研究[J].生态环境学报,2010,19(10):2307-2312.
[5] Ohno T,Doolan K L.Effects of red clover decomposition on phytotoxicity to wild mustard seedling growth[J].Applied Soil Ecology,2002,16(2):187-192.
[6] Teasdale J R.Cover crops,smother plants,and weed management[A].Hatfield J L,Buhler D D,Stewart B A E.Integrated Weed and Soil Management[C].Chelsea:Ann Arbor Press,1998:247-270.
[7] 王瀚,张和平,何九军,等.有毒植物及其开发利用的主要途径[J].甘肃高师学报,2010,15(2):29-31.
[8] 张宝琛,白雪芳,顾立华,等.生化他感作用与高寒草甸上人工草场自然退化现象的研究[J].生态学报,1989,9(2):115-119.
[9] 邓建梅,杨顺义,沈慧敏,等.黄花棘豆甲醇提取液对油菜、燕麦、反枝苋和狗尾草萌发和幼苗生长的影响[J].植物保护,2009,35(5):48-52.
[10] 赵宝玉.我国黄芪属有毒植物及其对家畜的危害[J].中国兽医杂志,1994,20(4):15-16.
[11] 鲁西科,王俊彪,曹光荣.劲直黄芪有毒成分的分离与鉴定[J].西藏科技,1993,59:1-4.
[12] 李建科.中国疯草研究现状与展望[J].中国农业科学,2003,36(9):1091-1099.
[13] 鲁西科,孟大为.西藏劲直黄芪毒性、毒理和开发利用研究取得重大进展[J].西藏科技情报,1992,1:18-19.
[14] 蔺淑琚.西藏山南地区家畜劲直黄芪中毒的探讨[J].中国兽医科技,1990,10:33-34.
[15] 曾任森.化感作用研究中的生物测定方法综述[J].应用生态学报,1999,10(10):123-126.
[16] 郝建军,康宗利,于洋.植物生理学实验技术[M].北京:化学工业出版社,2007:68-172.
[17] 沈慧敏,郭鸿儒,黄高宝.不同植物对小麦、黄瓜和萝卜幼苗化感作用潜力的初步评价[J].应用生态学报,2005,16(4):740-743.
[18] 李美,高兴祥,高宗军,等.艾蒿对不同植物幼苗的化感作用初探[J].草业学报,2010,19(6):114-119.
[19] William S G B,Richardson D.Bioassays for allelopathy:measuring treatment responses with independent controls[J].Chemical Ecology,1988,14(1):181-187.
[20] 李寿田,周健民,王火焰,等.化感作用的应用防除[J].中国生态农业学报,2003,11(3):104-106.
[21] 胡飞,孔垂华.胜红蓟化感作用研究Ⅵ.气象条件对胜红蓟化感作用的影响[J].应用生态学报,2002,13(1):76-80.
[22] 耿广东,张素勤,程智慧.香草醛对莴苣的化感作用及其作用机制[J].西北农业学报,2009,18(3):209-212,217.
[23] 杨期和,叶万辉,廖富林,等.植物化感物质对种子萌发的影响[J].生态学杂志,2005,24(12):1459-1465.
[24] 贾黎明,翟明普,尹伟伦.辽东栎混交林中生化他感作用的研究[J].林业科学,1995,31(6):491-498.
[25] 金忠民,沙伟,谭大海.低温胁迫对蓝萼香茶菜幼苗保护酶系统的影响[J].高师理科学刊,2004,24(2):54-56.
[26] 徐威,王瑜,袁庆华.NaCl胁迫对白三叶生长及保护酶的影响[J].草地学报,2011,19(3):492-496.
[27] 王爱国,罗广华.植物的超氧化物自由基与羟胺反应的定量关系[J].植物生理学通讯,1990,26(6):51-57.
[28] 鲁艳,李新荣,何明珠,等.Ni和Cu胁迫对骆驼蓬抗氧化酶活性的影响[J].草业学报,2012,21(3):147-155.
[29] 刘慧芹,韩巨才,刘慧平,等.铅梯度胁迫对多年生黑麦草幼苗生理生化特性影响[J].草业学报,2012,21(6):57-63.
[30] 樊瑞苹,周琴,周波,等.盐胁迫对高羊茅生长及抗氧化系统的影响[J].草业学报,2012,21(1):112-117.
[31] Yu J Q,Ye S F,Zhang M F,etal.Effects of root exudates and aqueous root extracts of cucumber(Cucumissativus)and allelochemicals,on photosynthesis and antioxidant enzymes in cucumber[J].Biochemical Systematics and Ecology,2003,31:129-139.
[32] Ding J,Sun Y,Xiao C L,etal.Physiological basis of different allelopathic reactions of cucumber and figleaf gourd plants to cinnamic acid[J].Journal of Experimental Botany,2007,58(13):3765-3773.
[33] Roshchina V V,Roshchina V D.The Excretory Function of Higher Plant[M].New York:Springer-Verlag,1993:213-215.
