类风湿关节炎患者外周血单核细胞Toll样受体4的表达及其与血清白介素-18水平变化的相关性
2013-04-09武加标顾巧英蒋立新戚传平赵东宝
任 敏,武加标,汤 丽,顾巧英,肖 菁,蒋立新,戚传平,赵东宝
(江苏大学附属武进医院风湿免疫科,常州 213002)
类风湿关节炎(rheumatoid arthritis,RA)是一种以慢性破坏性关节病变为特征的全身性自身免疫病,主要表现为双手及腕的对称性关节炎。虽然大多研究认为,RA是在抗原驱动下与遗传相关、多因素参与的疾病,但迄今病因仍不明。早期人们一直致力于对T细胞和B细胞产生的细胞因子和自身抗体介导的获得性免疫进行研究,探讨其在RA滑膜损害及发病中的作用。然而,近年来Toll样受体(toll-like receptor,TLR)的发现使人们重新审视了天然免疫在RA发生机理中的作用。有报道TLR在RA的发病机理及胶原诱导的小鼠关节炎动物模型(collagen-induced arthritis,CIA)中起至关重要的作用[1-2]。Toll样受体4(toll-like receptor-4,TLR4)作为第一个发现的TLR,可通过识别病原体相关模式分子激活天然免疫系统,启动细胞内信号转导通路,产生炎性因子白细胞介素(interleukin,IL)-1、IL-18等。TLR除了参与急性微生物感染导致的炎性反应外,在RA慢性炎性反应中也可能发挥了重要作用[3-5]。本研究采用流式细胞术检测RA患者CD14+单核细胞表面TLR4的阳性率及平均荧光强度(mean fluorescence intensity,MFI),并与对照组进行比较。同时,分析RA患者TLR4阳性率与其临床和实验室指标的相关性。
对象和方法
研究对象

骨性关节炎(osteoarthritis,OA)组:同时期住院的7例OA患者纳入疾病对照组,患者均为女性,年龄42~63岁,诊断均符合1990年美国风湿病学会制定的分类标准。
对照组:选取同时期江苏大学附属武进医院体检中心健康志愿者39名。其中,男3名,女36名,年龄33~59岁。
RA组、OA组及对照组的年龄构成均具可比性。
方法
试剂和仪器:流式检测用荧光标记单克隆抗体,抗人CD14-FITC(克隆号为61D3,购自eBioscience公司)、抗人TLR4-PE(克隆号为HTA125,购自eBioscience公司)、溶血剂(购自苏州跃亚生物技术有限公司),IL-18酶联免疫吸附剂测定(Enzyme-linked immunosorbent assay,ELISA)试剂盒(购自R&D公司)。酶标仪(美国BIO-Rad680),流式细胞仪(德国PARTEC公司)。
实验步骤:抽取3组受试者静脉血2 ml于抗凝管中;每份标本分装4管,从第2管开始,依次加入6 μl 抗CD14、5 μl抗TLR4和4 μl抗CD14、5μl抗TLR4,然后加入30 μl抗凝全血混匀,置室温孵育20 min,后加50 μl溶血剂,充分混匀后室温闭光15 min 使红细胞充分溶解,置于离心机以1500 rm离心5 min,弃上清,用1 ml蒸馏水清洗2次,弃上清、重悬细胞加入1 ml蒸馏水,放入流式细胞仪进行有关指标测定。每管在圈定的总细胞中设置收集6 000个细胞,选取FSC-SSC散点图上的单核细胞群,以CD14及TLR染色双阳性细胞百分率记录结果。即TLR4(CD14+TLR4+)双阳性区域在试验患者组和正常对照组单核细胞表面阳性率,并比较MFI。同时留取血清用ELISA检测IL-18的表达水平。
统计学方法
结 果
TLR4在RA外周血CD14+单核细胞表面阳性率和MFI
TLR4在RA高度活动组、中低度活动组外周血CD14+单核细胞表面阳性率分别于对照组相比,差异有统计学意义(P<0.01)(图1)。MFI在RA高度活动组、中低度活动组和对照组组间比较,差异有统计学意义(F=3.15,P<0.05)(表1)。
不同病情RA患者外周血IL-18水平与对照组的差异
血清IL-18水平在RA高度活动组最高,中低度活动组次之,且均高于对照组。RA中低度活动组及对照组血清IL-18水平分别与RA高度活动组相比,差异有统计学意义(P<0.01)(表2)。
TLR4外周血CD14+单核细胞表面阳性率与血清IL-18水平、临床指标的相关性
RA高度活动组TLR4外周血CD14+单核细胞表面阳性率与血清IL-18水平呈正相关(r=0.261,P=0.032),与DAS28呈负相关(r=-0.722,P=0.027)。
表1TLR4外周血CD14+单核细胞表面阳性率和平均荧光强度
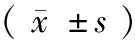

组别例数(n)TLR4阳性率(%)TLR4平均荧光强度(道)RA高度活动组1324 58±10 13∗47 34±19 85RA中低度活动组2132 47±12 40∗42 56±17 41OA组710 23±3 4067 90±31 40对照组3913 14±5 2259 38±28 05F值—28 273 15P值—<0 010 029MS组内—71 20613 21
TLR4:Toll样受体4;RA:类风湿关节炎;OA:骨性关节炎;与对照组比较,*P<0.01
表2血清IL-18在3组中的表达水平
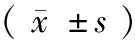

组别例数(n)IL⁃18(pg∕ml)RA高度活动组13236 71±39 42RA中低度活动组21195 32±20 69∗对照组39185 49±42 96∗F值—9 24P值—0 00027MS组内—1390 57
IL-18:人白细胞介素18;RA:类风湿关节炎;与RA高度活动组比较,*P<0.01
RA中低度活动组TLR4外周血CD14+单核细胞表面阳性率与血清IL-18水平无明显相关性(r=-0.030,P=0.880),与DAS28呈负相关(r=-0.398,P=0.036)。
对照组TLR4外周血CD14+单核细胞表面阳性率与血清IL-18水平(r=0.320,P=0.800)及与DAS28(r=0.203,P=0.301)均无明显相关性。
讨 论
RA发病的天然免疫机制一直是研究的热点问题,目前普遍认为,微生物可能通过感染宿主使其产生免疫应答促使RA发病,并非感染因素直接引起RA。炎性反应持续的其中一个途径是通过TLR发挥作用。TLR是连接天然与获得性免疫的危险信号受体,可促炎性因子受体表达于免疫细胞及非免疫细胞表面。在机体受到外界刺激,如感染、自身免疫紊乱等影响后,TLR通过分子模拟、表位扩散及模糊识别机制导致免疫系统稳态失衡,产生炎性反应,参与由炎性因子介导的RA发生过程[6]。
TLR是进化高度保守的一型跨膜蛋白,目前在人类已有13种TLR(TLR1~TLR13)被鉴定出[7]。TLR4是研究最广的受体,主要识别细菌脂多糖(Lipopolysaccharides,LPS),在CD14的协助下启动下游信号控制炎性反应,已发现Toll样受体2(toll-like receptor-2,TLR2)和TLR4在RA患者的滑膜纤维母细胞及淋巴细胞表面高度表达[8]。Radstake等[9]通过免疫组化证明TLR4表达在RA患者的滑膜上,此后得到Ospelt等[10]的验证,且在RA早期阶段高表达。然而在TLR4在RA患者外周血循环中表达情况及作用机制至今很少报道。
本研究表明,TLR4在RA患者外周血CD14+单核细胞表达高于对照组(上调),这一结果同国内外学者报道的一致[11-13]。进一步分析发现,病情高度活动组、中低度活动组阳性率均高于对照组,由此提示:(1)活动期RA患者体内炎性因子的产生可能是TLR4介导的。然而值得讨论的是,TLR4在静息情况下表达在细胞表面,当识别病原体细胞壁成分后被激活,但纳入试验的患者已经排除了合并细菌、病毒感染者,推测体内存在类似RA滑膜的内源性配体,受体内的配体驱动激活细胞信号的转导,反复刺激使TLR4上调。(2)Iwahashi等[14]曾用CD16+阳性群代表大部分单核细胞,结果表明CD16+细胞在患者外周血单核细胞中明显增加。LPS-CD14-TLR4-NF-κB信号传导是TLR4的经典途径,TLR4阳性率的增加也提示单核细胞起重要的桥梁作用。值得一提的是,RA高度活动组的TLR4表达低于中低活动组,这可能由于细胞表面的TLR4脱落到血清中,进一步明确原因需进行TLR4的血清含量测定实验。
免疫细胞内存在多层次不同靶点的负向调控分子,可以对TLR4所介导的信号通路的开启和传导起到精确的负调控作用,从而抑制TLR4信号转导[15]。本实验同时设立OA组作为疾病对照组,其阳性率低于RA各组,TLR4在RA高度活动组、中低度活动组和对照组3组间差异有统计学意义,但其阳性率差距不大,提示TLR4的信号转导中存在精细的调控机制,以避免过强的免疫反应,维持机体的稳态平衡。
纳入本研究的RA患者病程较长(大多在6个月以上),属于非早期且为多为复诊患者,入院时DAS28评分多为中低度活动。当炎性反应转为慢性、持续性时,TLR4的表达上调会给患者带来不利影响,产生更多的炎性因子,后者除了聚集在关节滑膜上外,还会激活体内的配体产生免疫应答。推测TLR4在活动期的上调会反复刺激信号转导,导致RA炎性反应慢性持续发展。下一步研究则需要继续监测改善病情抗风湿药(disease-modifying antirheumatic drugs,DMARDs)治疗前后TLR4的变化情况。
本研究结果提示,RA两组的血清IL-18水平均高于正常组,提示RA病情活动时有IL-18的参与。血清中IL-18作为信号转导的下游致炎因子,在RA发病机制中起重要作用,且在单核巨噬细胞中高表达。TLR4能有效识别“非己”成分而被活化,继而激活NF-κB等转录因子引起与免疫有关的细胞因子IL-18的分泌。本试验表明,RA高度活动组TLR4阳性率与DAS28呈负相关,而与IL-18的水平呈正相关。DAS28是反应疾病活动度的指标之一,提示患者在RA活动时TLR4的阳性率反而降低,可能的原因是IL-18的水平增高不仅会招募单核细胞到滑膜组织,还会促使单核细胞聚集在外周血中,从而趋化内源性配体,促使TLR4通路下传,消耗性地表达降低。另外,其他炎性因子受到单核细胞招募聚集后也会加重RA的症状。研究者在试验中观察到,TLR4在CD14+单核细胞上表达时,很明显的变化是有些DAS28评估高度活动的患者外周单核细胞群和细胞数目反而很少,其阳性率会随之降低,表明炎性活动会使TLR4信号通路会被反复激发,级联反应后的IL-18增高反馈性调节TLR4降低,外周血单核细胞很容易被TLR4触发产生致炎因子[16]。TLR4的表达上调影响IL-18的产生,而IL-18在RA患者的血清中浓度的增高是否会影响TLR4的表达值得进一步探讨。
在RA的发病机制中可能存在多种细胞类型和可溶性因子之间的复杂的相互作用[17],TLR4对RA炎性的触发有间接潜在的驱动作用,虽然不是在疾病的开始,但可能是通过信号下游通路IL-18的产生促成RA反复发作。曾有学者设想TLR4是否可以作为治疗RA的靶目标,在临床应用大量肿瘤坏死因子(tumor necrosis factor alpha,TNF)-a抑制剂的同时抑制TLR4,使症状得以控制[18]。已经有报道TLR4抑制剂可抑制RA实验鼠的临床症状和细胞因子介导的炎性反应[19]。
总之,本研究表明TLR4在RA患者外周血CD14+单核细胞表达上调,TLR4的阳性率与IL-18的水平呈正相关,与DAS28呈负相关,在一定程度上提示TLR4释放炎性因子可能是RA反复发作的原因之一。因此,对于TLR4在分子水平的研究可能为RA的发病机制和防治提供依据。
(致谢:安徽省感染与免疫重点实验室蚌埠医学院李柏青教授在流式方面的指导及对本文的修改意见)
(本文图1见插页第Ⅱ页)
[1]Maciejewska Rodrigues H, Jungel A, Gay RE, et al. Innate immunity, epigenetics and autoimmunity in rheumatoid arthritis[J]. Mol Immunol, 2009, 47:12-18.
[2]Huang QQ, Pope RM. The role of toll-like receptors in rheumatoid arthritis[J]. Curr Rheumatol Rep, 2009,11:357-364.
[3]Dinarello CA. Immunological and inflammatory functions of the interleukin-1 family[J]. Annu Rev Immunol, 2009, 27:519-550.
[4]Gierut A, Perlman H, Pope RM. Innate immunity and rheumatoid arthritis[J]. Rheum Dis Clin North Am, 2010, 36:271-296.
[5]Falgarone G, Jaen O, Boissier MC. Role for innate immunity in rheumatoid arthritis[J]. Joint Bone Spine, 2005, 72:17-25.
[6]Barton GM, Kagan JC. A cell biological view of Toll-like receptor function: regulation through compartmentalization[J]. Nat Rev Immunol, 2009, 9:535-542.
[7]Moresco EM,LaVine D,Beutler B.Toll-like receptors[J].Curr Biol,2011,21:R488-493.
[8]Brentano F,Kyburz D,Gay S.Toll-like receptors and rheumatoid arthritis[J].Methods Mol Biol,2009,517:329-343.
[9]Radstake TR, Roelofs MF, Jenniskens YM, et al. Expression of toll-like receptors 2 and 4 in rheumatoid synovial tissue and regulation by proinflammatory cytokines interleukin-12 and interleukin-18 via interferon-gamma[J]. Arthritis Rheum, 2004, 50:3856-3865.
[10] Ospelt C, Brentano F, Rengel Y, et al. Overexpression of toll-like receptors 3 and 4 in synovial tissue from patients with early rheumatoid arthritis: toll-like receptor expression in early and longstanding arthritis[J]. Arthritis Rheum, 2008, 58:3684-3692.
[11] Huang Q, Ma Y, Adebayo A, et al. Increased macrophage activation mediated through toll-like receptors in rheumatoid arthritis[J]. Arthritis Rheum, 2007, 56:2192-2201.
[12] 潘正论, 张源潮, 许冬梅, 等. 天然免疫分子TLR2 TLR4在类风湿关节炎的表达模式研究[J]. 中华风湿病学杂志, 2005, 9:86-88.
[13] Kowalski ML, Wolska A, Grzegorczyk J, et al. Increased responsiveness to toll-like receptor 4 stimulation in peripheral blood mononuclear cells from patients with recent onset rheumatoid arthritis[J]. Mediators Inflamm, 2008, 2008:132732.
[14] Iwahashi M, Yamamura M, Aita T, et al. Expression of Toll-like receptor 2 on CD16+blood monocytes and synovial tissue macrophages in rheumatoid arthritis[J]. Arthritis Rheum, 2004, 50:1457-1467.
[15] Zeytun A,Chaudhary A,Pardington P, et al. Induction of cytokines and chemokines by Toll-like receptor signaling: strategies for control of inflammation[J]. Crit Rev Immunol, 2010, 30:53-67.
[16] Shahrara S, Park CC, Temkin V, et al. RANTES modulates TLR4-induced cytokine secretion in human peripheral blood monocytes[J]. J Immunol, 2006, 177:5077-5087.
[17] Ospelt C, Kyburz D, Pierer M, et al. Toll-like receptors in rheumatoid arthritis joint destruction mediated by two distinct pathways[J]. Ann Rheum Dis, 2004, 63:90-91.
[18] Sacre SM, Drexler SK, Andreakos E, et al. Could toll-like receptors provide a missing link in chronic inflammation in rheumatoid arthritis? Lessons from a study on human rheumatoid tissue[J]. Ann Rheum Dis, 2007, 66:81-86.
[19] Abdollahi-Roodsaz S, Joosten LA, Roelofs MF, et al.Inhibition of Toll-like receptor 4 breaks the inflammatory loop in autoimmune destructive arthritis[J]. Arthritis Rheum, 2007, 56:2957-2967.
