一种从骨髓血凝块中分离间充质干细胞的方法
2013-03-03李志勇王恒湘毕晓云郭子宽郭志坤
李志勇 王恒湘 毕晓云 黄 舒 郭子宽 郭志坤
一种从骨髓血凝块中分离间充质干细胞的方法
李志勇 王恒湘 毕晓云 黄 舒 郭子宽 郭志坤
目的探讨一种从骨髓血凝块中分离培养间充质干细胞的简易方法。方法采集肝素化骨髓标本7份,部分加入凝血酶以模拟血液凝固过程,并于0、8和16 h分别使用尿激酶或机械处理,分为尿激酶处理组、机械处理组、凝固未处理组及未凝固对照组。各组标本经氯化铵溶解红细胞后,分别进行成纤维细胞集落形成单位(CFU-F)和MSC传代培养。计每组CFU-F及第0、1和2代MSC数量。流式细胞仪测定细胞表型,组织化学法检测细胞体外成骨和成脂肪能力。结果尿激酶处理组样本CFU-F数平均为(33.71±23.54),接近于未凝固对照组样本(40.43±21.29)(n=7,P>0.05),显著高于机械法处理组(13±11.91)(n=7,P<0.01)和凝固未处理组(3.71±3.89)(n=7,P<0.01)。储存8或16 h后的标本,各组CFU-F形成能力下降,而未凝固对照组和尿激酶处理组数量仍显著高于另外两组(P<0.05)。标本储存不同时间进行MSC传代培养,未凝固对照组及尿激酶处理组细胞数量无明显差别,但均显著高于凝固未处理组及机械处理组。各组MSC均表达CD73和CD90,不表达CD31和CD45。经特异诱导后,各组MSC均呈现碱性磷酸酶活性,细胞内出现亲油红O染料的脂肪滴。结论对于已经凝固的骨髓标本而言,尿激酶预处理是分离培养MSC的良好途径。
间充质干细胞骨髓凝固尿激酶分离
间充质干细胞(Mesenchymal stem cells,MSC)是一种具有造血支持及免疫调节活性的成体干细胞,具有向成骨细胞、成软骨细胞和成脂肪细胞分化的能力,已经进入多种疾病的临床试验及临床应用阶段,包括移植物抗宿主病、心血管疾病及肌肉骨骼疾病等[1-2]。MSC具有较低的免疫原性,异体骨髓MSC已经应用于造血干细胞移植,用于某些并发症的预防与治疗。但是,MSC分化的细胞具有较强的免疫原性,如MSC分化形成的成骨细胞,与MSC明显不同,高表达HLA-DR,抗原性显著增强[3]。因此,在某些情况下,必需使用自体MSC移植,以免引起移植细胞的排斥。脂肪组织也是MSC重要的来源,但骨髓采集方便,在进行骨及软骨缺陷的修复时,通常抽吸患者骨髓,用来分离培养MSC[4]。然而,有时骨髓很难抽取,且在抽吸后标本极易凝结成块,一些高凝状态的患者更是如此[5-6],从而导致所获得MSC的数量下降乃至培养扩增失败。为解决这个实际问题,我们探讨了一种从骨髓血凝块中分离出间充质干细胞的方法。
1 材料和方法
1.1 材料
7份健康人骨髓标本来自空军总医院血液科,均为健康骨髓供者。骨髓标本采集符合空军总医院人体标本采集和使用规范。
α-MEM培养基(Sigma公司);胎牛血清(Stem Cell公司),为经筛选后适用于人MSC培养的专用血清;人凝血酶(Sigma公司);胰蛋白酶(Amresco公司);肝素钠注射液(江苏万邦生化医药公司);尿激酶注射用粉针(珠海塞隆药业有限公司);PE标记的小鼠抗人CD31、CD45、CD73和CD90单克隆抗体(BD公司);细胞分化诱导试剂如地塞米松、异丁基甲基黄嘌呤和吲哚美辛(Sigma公司),β-甘油磷酸钠盐和维生素C钠盐(Fluka公司);碱性磷酸酶组化染色试剂盒(86C-1KT)(Sigma公司)。
1.2 标本处理方法
将骨髓标本充分混匀,用台盼蓝试剂拒染法计数活细胞数,PBS调整细胞浓度至1×107cells/mL。在CFU-F测定实验中,取1 mL混匀骨髓液分为12等份,每份约含106个有核细胞,向其中9份中加入凝血酶,使其终浓度为1 U/mL,放置37℃反应1 h。在细胞传代实验中,取12等份骨髓样本,各含107个有核细胞,其中9份加入凝血酶,37℃反应1 h。上述12份标本,根据不同处理分为4组:尿激酶处理组、机械处理组、血凝块未处理组及未凝固对照组(未加入凝血酶),每组3份,分别于0、8和16 h进行相同处理。凝血块样本处理包括机械处理和尿激酶消化两种方式,即用剪刀将骨髓凝块剪成体积约为1 mm3的碎块,或向标本中加入尿激酶(终浓度为50 000 U/mL),放置于37℃摇床中,120 r/min消化20 min。之后,所有样本经氯化铵缓冲液处理,以溶解其中的红细胞[7]。收集不同标本,用于后续实验。
1.3 CFU-F的培养及计数
将含有106个有核细胞的标本,重悬于含10% FCS的α-MEM培养基中,接种于直径为100 mm的培养皿内,37℃、5%CO2条件下培养5 d,补充新鲜培养基。培养12 d时,PBS洗涤去除非贴壁细胞。0.1%甲醛固定,瑞氏-吉姆萨染色。计数直径大于0.5 mm的集落。
1.4 MSC的传代培养
将含有107个有核细胞的处理及未处理标本,重悬于含10%FCS的α-MEM培养基中,按文献报道的方法进行MSC传代培养[8-10]。当未凝固对照组贴壁细胞生长融合至80%时,将各组细胞用胰酶消化计数,按6 000 cells/cm2的密度重新接种于培养皿。台盼蓝拒染法计数第0、1和2代活细胞总数。
1.5 细胞表型分析
按文献报道方法进行[8-10]。简言之,收集第2代MSC,PBS洗涤后计数。细胞悬液中加入单克隆抗体,室温避光反应30 min。PBS洗涤两次后重悬细胞,流式细胞仪分析,FACSCalibur收集数据,WinM-di 2.9软件分析结果。
1.6 体外成骨和成脂肪能力测定
按本室常规方法进行[11]。即,将MSC按照l×l04个细胞/孔接种于24孔培养板中。成骨能力测定时,加入成骨诱导体系培养液(地塞米松0.1 mol/L、β-甘油磷酸钠盐10 mmol/L和抗坏血酸磷酸盐50 mol/L),培养第2周后,按碱性磷酸酶检测试剂盒操作步骤进行碱性磷酸酶染色。成脂肪能力测定时,加入成脂诱导体系培养液(地塞米松1 mol/L、IBMX 0.5 mmol/L、吲哚美辛100 mol/L)。体外培养10 d后,PBS洗涤,0.2%多聚甲醛固定,油红O染色。
1.7 统计学分析
计数资料均以均值±标准差表示。所有数据经t检验分析,P<0.05为差异有统计学意义。
2 结果
2.1 不同处理组CFU-F数量
CFU-F是检测某一样本MSC含量的代表性指标。为显示不同处理组MSC含量,将不同处理组有核细胞进行CFU-F培养,12 d后计数。结果表明:各骨髓血凝固样本所得的CFU-F,均低于未凝固骨髓样本。其中,尿激酶处理组样本CFU-F平均值为(33.71±23.54),接近于未凝固对照组(40.43±21.29)(n=7,P>0.05)。两者均明显高于机械法处理组的结果(13±11.91)(n=7,P<0.01)和血凝块未处理组(3.71±3.89)(n=7,P<0.01)。将标本保存8或16 h后,所有组别样本中CFU-F的数目明显下降,但是未凝固对照组及尿激酶处理组仍明显高于其他两组(图1)。
2.2 不同处理组收获MSC数量
未凝固对照组原代贴壁细胞数(38.86±17.4)×104,尿激酶处理组为(38.57±16.78)×104,均明显高于机械处理组的(18.57±13.69)×104(n=7,P<0.01)及未处理组的(13.14±8.39)×104(n=7,P<0.01)。第1代及2代细胞总数,同样存在相似的差异。
2.3 MSC的鉴定
为观察不同组别所获得的细胞是否为MSC,对第2代贴壁细胞进行了生物学特性分析。结果发现:所有贴壁细胞均呈成纤维细胞样;不表达CD31(内皮细胞标志)和CD45(血细胞标记),均一表达间充质细胞标记CD73,而且高表达干细胞标记CD90。进一步分化功能分析证实,这些细胞可在体外分化为成骨细胞和成脂肪细胞。因此,所获细胞符合MSC的最低标准[10],不同处理对细胞本身的特性无明显影响(图2)。

图1 不同组别CFU-F和MSC数量Fig.1CFU-F and MSC numbers of different groups
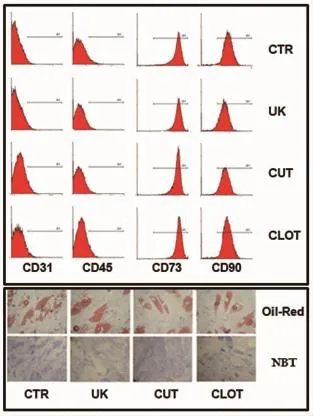
图2 MSC的表型及分化能力鉴定。上:流式细胞学结果,显示细胞表面抗原;下:不同组别Oil-Red染色和NBT染色Fig.2Representative results from flow cytometric analysis on cell phenotype(upper)and in vitro differentiation assay (lower).The antigenic markers are indicated.Adipogenesis was revealed by Oil-red staining and osteogenesis was examined by NBT/BCIP staining for alkaline phosphatase
因此,从收获细胞数量上讲,以上结果提示尿激酶处理骨髓凝块是分离培养MSC的一种有效方法。
3 讨论
MSC是一种存在于胚外及胚内组织的未分化多能细胞,具有分化为成骨细胞、软骨细胞、脂肪细胞和骨髓基质细胞的能力[12-14]。与造血干细胞不同,MSC易于分离和培养,体外增殖能力旺盛[12],且具有特征性的造血支持及免疫调节功能[1,13]。因此,MSC作为组织修复的种子细胞已经受到广泛关注。然而,骨髓中MSC含量相当有限,需要体外扩增后用于临床。临床骨髓抽吸过程中,尤其对于那些处于高凝状态的患者,总会出现骨髓凝结成块的现象,导致MSC培养扩增困难。
为解决该问题,本实验通过向凝固16 h内的骨髓凝块中加入尿激酶,使凝块溶解。流式细胞学分析和分化实验证实,培养后的细胞高表达干细胞标记,而且,仍具有成骨和成脂肪能力,表明细胞生物学未受到影响。因此,使用尿激酶消化法从骨髓凝块中分离MSC,所获细胞数量接近于未凝固标本,又可保证细胞质量,方法简单可行,是一种可推广的实用手段。
已有研究证实,间充质干细胞表达尿激酶受体,而且,受体的活化会启动其迁徙过程,促进干细胞动员[15]。由此可以推测,尿激酶处理骨髓凝块过程中,除酶消化分解凝块外,MSC从凝块中迁移至消化液中,也可能是凝块释放MSC的途径。然而,必须指出的是,经过尿激酶刺激后,MSC可释放更多的促血管再生细胞因子,如bFGF、VEGF和IL-8等[16-17]。因此,从骨髓标本凝块中分离的MSC,是否具有更强的促血管新生活性,或因此促进实体瘤的增殖,值得进一步研究阐明。
总之,利用尿激酶消化法从骨髓凝块中分离MSC,方法简单可行,获得细胞数量较稳定。但是,该方法所获MSC的详细生物学特性尚未明确,仍需从不同角度研究探讨,以期用于相应临床试验研究。
[1]Duffy MM,Ritter T,Ceredig R,et al.Mesenchymal stem cell effects on T-cell effector pathways[J].Stem Cell Res Ther,2011, 2(4):34-43.
[2]Steinert AF,Rackwitz L,Gilbert F,et al.Concise review:the clinical application of mesenchymal stem cells for musculoskeletal regeneration:current status and perspectives[J].Stem Cells Transl Med,2012,1(3):237-247.
[3]陈苗,曲强,沈悌,等.细胞表面分子在骨髓间充质干细胞向成骨细胞分化过程中的表达[J].中国医学科学院学报,2007,29(1): 62-66.
[4]Szpalski C,Barbaro M,Sagebin F,et al.Bone tissue engineering: current strategies and techniques--part II:Cell types[J].Tissue Eng Part B Rev,2012,18(4):258-269.
[5]Lykissas MG,Gelalis ID,Kostas-Agnantis IP,et al.The role of hypercoagulability in the development of osteonecrosis of the femoral head[J].Orthop Rev(Pavia),2012,4(2):e17.
[6]Bramham K,Hunt BJ,Goldsmith D.Thrombophilia of nephrotic syndrome in adults[J].Clin Adv Hematol Oncol,2009,7(6):368-372.
[7]Horn P,Bork S,Diehlmann A,et al.Isolation of human mesenchymal stromal cells is more efficient by red blood cell lysis[J].Cytotherapy, 2008,10(7):676-685.
[8]Zhang HC,Liu XB,Huang S,et al.Microvesicles derived from human umbilical cord mesenchymal stem cells stimulated by hypoxia promote angiogenesis both in vitro and in vivo[J].Stem Cells Dev,2012,21(18):3289-3297.
[9]Jin JD,Wang HX,Xiao FJ,et al.A novel rich source of human mesenchymal stem cells from the debris of bone marrow samples [J].Biochem Biophys Res Commun,2008,376(1):191-195.
[10]Dominici M,Le Blanc K,Mueller I,et al.Minimal criteria for defining multipotent mesenchymal stromal cells.The International Society for Cellular Therapy position statement[J].Cytotherapy, 2006,8(4):315-317.
[11]楼晓,汪劲松,靳继德,等.血小板裂解物支持人骨髓基质细胞的扩增[J].组织工程与重建外科,2009,5(2):61-64.
[12]张薇薇,郭子宽.间充质干细胞临床试验中的问题及其解决策略[J].中国实验血液学杂志,2007,15(4):901-904.
[13]王恒湘,郭子宽.间充质干细胞在组织再生应用中的诸多问题[J].组织工程与重建外科,2008,4(5):241-245.
[14]王东梅,郭子宽.新型干细胞治疗:科学与策略[J].组织工程与重建外科,2011,7(2):61-64.
[15]Vallabhaneni KC,Tkachuk S,Kiyan Y,et al.Urokinase receptor mediates mobilization,migration,and differentiation of mesenchymal stem cells[J].Cardiovasc Res,2011,90(1):113-121.
[16]Neuss S,Schneider RK,Tietze L,et al.Secretion of fibrinolytic enzymes facilitates human mesenchymal stem cell invasion into fibrin clots[J].Cells Tissues Organs,2010,191(1):36-46.
[17]Gutova M,Najbauer J,Frank RT,et al.Urokinase plasminogen activator and urokinase plasminogen activator receptor mediate human stem cell tropism to malignant solid tumors[J].Stem Cells,2008,26(6):1406-1413.
An Approach of Isolating Mesenchymal Stem Cells from Human Bone Marrow Clots
LI Zhiyong1,WANG
Hengxiang2,BI Xiaoyun3,HUANG Shu3,GUO Zikuan4,GUO Zhikun1.1 Key and Open Lab for Tissue Regeneration, Xinxiang Medical University,Henan 453003,China;2 Department of Hematology,General Hospital of Air Force,Beijing 100036,China;3 Department of Cell Therapy,Guangzhou Hospital of Developmental District,Guangzhou 510730,China;4 Department of Experimental Hematology,Beijing Institute of Radiation Medicine,Beijing 100850,China.Corresponding author:GUO Zhikun(E-mail:gzk@xxmu.edu.cn).
ObjectiveTo establish an easily-handled method to isolate and culture-expand MSC from marrow clots.MethodsSeven heparized bone marrow samples were harvested from healthy subjects.Thrombin were added to part of the samples to mimic the coagulation process.After being stored for 0,8 and 16 hours,all the samples were divided into 4 groups:urokinase-treated group,mechanically-cut group,untreated group and control group.The clots were mechanically cut into pieces or treated with urokinase,followed by red blood cell lysis with ammonium chloride.Colony-forming units of fibroblast(CFU-F)and MSC culture were further developed,and the numbers of CFU-F and MSC at passage 0-2 were counted.The phenotypic features were analyzed with flow cytometry.Histological staining was used to observe the in vitro osteogenesis and adipogenesis.ResultsThe average CFU-F number of urokinase-treated group was 33.71±23.54,which was comparable to that of control group(40.43±21.29)(n=7,P>0.05)).Both of them were significantly higher than those of mechanically-cut group(13±11.91)(n=7,P<0.01)and untreated group(3.71±3.89)(n=7,P<0.01).The CFU-F numbersdecreased after samples were stored for 8 or 16 hours,but those of control and urokinase-treated group remained higher than the other two groups.MSC culture from samples stored at different times was developed.The cell numbers at different passages were similar between control and urokinase-treated group,while they were greatly higher than those from untreated and mechanically-cut group(P<0.05 for all time points and passages respectively).MSC from different groups expressed CD73 and CD90 and they were negative for CD31 and CD45.After specific induction of differentiation,the cells became positive for alkaline phosphatase activity and intracellular Oil-red O-binding lipid droplets appeared.ConclusionThe results here suggest that urokinase pretreatment is an optimal strategy to culture mesenchymal stem cells from coagulated marrow samples.
Mesenchymal stem cells;Bone marrow;Coagulation;Urokinase;Isolation
Q813.1+1
A
1673-0364(2013)03-0125-04
2013年4月9日;
2013年5月20日)
国家自然科学基金(30971068);广州市开发区科技局课题(2009Q-P081)。
453003河南省新乡市新乡医学院组织再生重点实验室(李志勇,郭志坤);100036北京市空军总医院血液科(王恒湘);510730广东省广州市广州市开发区医院南方生物诊治中心(毕晓云,黄舒);100850北京市军事医学科学院放射与辐射医学研究所实验血液学研究室(郭子宽)。
郭志坤(E-mail:gzk@xxmu.edu.cn)。
10.3969/j.issn.1673-0364.2013.03.002
