蜂蜜中细菌的筛选、鉴定及其抑菌作用
2013-02-19韩惠丽蔡宇杰管政兵孙付保廖祥儒
韩惠丽, 蔡宇杰, 管政兵, 孙付保, 廖祥儒
(江南大学 工业生物技术教育部重点实验室,江苏 无锡,214122)
蜂蜜是工蜂将采集的植物花蜜或分泌物经过充分酿造而贮存在蜂巢内的甜味物质,它是一种粘度高、透明或半透明的液体。蜂蜜不仅具有很高的营养价值,而且还具有多种生物学活性,如抗氧化、解毒、抗菌、消炎、滋润、防腐、保护创面、促进细胞再生等[1]。
由于蜂蜜具有渗透势低、水分质量分数低(17%~22%)、pH 值低(3.2~4.5)、葡萄糖氧化酶催化葡萄糖氧化不断产生过氧化氢、粘度高、含有抗氧化剂和抗菌物质等特点[2],故蜂蜜中所含营养生长阶段的细菌极少。微生物大部分以孢子的形式存在,使得蜂蜜能保存很长时间。有研究发现,蜂蜜对60多种细菌以及7种真菌有抑菌作用,其中对炭疽杆菌、短小芽孢杆菌、白喉状杆菌、大肠杆菌、肺炎杆菌等均有明显的杀菌作用[3]。
大多数芽孢杆菌对蜂蜜的品质和人类健康影响较小,但肉毒杆菌危害较大。据报道,在蜂蜜中发现了肉毒梭状芽孢杆菌的孢子,其能够引发婴儿肉毒杆菌中毒[4]。但也有研究从蜂蜜中筛选得到一些细菌,并发现其能产生一些抑菌物质进而抑制一些病原菌的生长[5-6]。
作者从4种蜂蜜中筛选得到了8株细菌,通过生理生化实验及形态学观察,结合16S rRNA基因序列分析对这些菌种进行了鉴定,然后初步研究了8株菌对大肠杆菌,痢疾杆菌及粘质沙雷氏菌的抑菌作用。
1 材料与方法
1.1 材料
1.1.1 原蜜 研究采用的4种蜂蜜为未经过加工的蜂蜜,分别为小茴香蜜(产于广西),桉树蜜(产于广西扶缓),五倍子蜜(产于广西南丹)和枣花蜜(产于河南)。使用前避光室温放置。
1.1.2 指示菌 大肠杆菌(Escherichia coli),痢疾杆菌 (Shigella dysenteriae S7NaCl),粘质沙雷氏菌(Serratia marcescens SYBCT02)均保存于作者所在实验室。
1.1.3 培养基
1)营养琼脂培养基(组分 g/L):牛肉膏 5.0,蛋白胨 10.0,NaCl 5.0,琼脂 20.0;pH 7.2~7.4。
2)验证培养基:含葡萄糖的营养琼脂培养基,分别含质量分数20%、30%、40%、50%的葡萄糖。
3)TSA 培养基(组分 g/L):胰蛋白胨 17.0,大豆胨 3.0,葡萄糖 2.5,NaCl 5.0,K2HPO4·3H2O 2.5,琼脂15.0(或 7.5);pH 7.1~7.5。
数字出版是数字内容产业的着力点之一。重庆市积极谋划数字出版发展战略,未来3年要建成5个数字内容产业基地。重庆的数字出版已突破“技术+出版”的模式,初步形成了“出版+服务”和“内容+服务”的商业模式,拓展了数字出版业的内涵和外延,形成网络出版服务商业模式,而服务又反向作用于出版和内容的创新,形成基于市场需求的创新动力,与政策的推动力,形成推进重庆数字出版业发展新动能。
4)种子培养基(组分 g/L):牛肉膏 5.0,蛋白胨10.0,NaCl 5.0,pH 7.2~7.4。
5)发酵培养基(组分 g/L):葡萄糖 20.0,蛋白胨20.0,K2HPO4·3H2O 1.5,MgSO4·7H2O 2.5;pH 7.0。
生理盐水:NaCl 0.85 g/dL。
1.2 实验方法
1.2.1 菌种筛选 4种蜂蜜用灭过菌的生理盐水稀释到质量分数为75%,分别取200 μL涂布在营养琼脂培养基上,放置在培养箱于30℃培养。每天观察,每长出一个菌落都要转接到新鲜的培养基上,划线分离纯化直到长出单菌落,转接并保藏菌种。
1.2.2 菌种验证 用含糖培养基验证分离得到的菌,先在含糖20 g/dL的营养琼脂培养基上转接筛到的菌落,30℃培养一段时间观察菌落是否能够生长。把能够在含20 g/dL的葡萄糖培养基上生长的菌落再转接到含糖30 g/dL的培养基上,观察是否生长。依次再转接到含糖40、50 g/dL的培养基上,筛选出耐高糖的菌落,转接保藏菌种。
1.2.3 菌种鉴定
1)菌体形态观察和生理生化实验:把筛到的细菌转接到倒有营养琼脂培养基的平板上,30℃培养24 h,观察菌落形态特征;根据《伯杰细菌手册》和《常见细菌鉴定手册》中的方法测定其生理生化特性。生理生化实验包括淀粉水解、V-P试验、M-R试验、过氧化氢酶的产生、反硝化、明胶液化试验、柠檬酸盐的利用、脲酶的测定以及糖发酵试验等。
1.2.4 分离菌对指示菌的抑制作用 用接种针将分离得到的细菌分别点种到倒有TSA(1.5 g/dL的琼脂)的平板上,30℃培养48 h,直到有菌落长出。然后把融化的TSA(0.75 g/dL的琼脂)培养基冷却到40℃左右(以不烫手为准),取2 mL加入200 μL指示菌,混匀,分别涂布在已长有菌落的平板上,30℃培养24 h,观察是否有抑菌圈[7]。
1.2.5 分离菌发酵液的抑菌作用 将筛到细菌接入种子培养基中,30℃、200 r/min摇12 h。然后将种子液接入装液量50 mL的液态发酵培养基中,接种体积分数为 4%,30℃、200 r/min恒温培养 72 h,得到发酵液。发酵液经8 000 r/min离心15 min,得到上清液。上清液用0.22 μm的过滤器进行过滤除菌。分别取3种指示菌200 μL涂平板,并在涂好的平板上打孔(9 mm),取100 μL过滤除菌的上清液加入孔中,30℃培养24 h,观察是否有抑菌圈。
2 结果与分析
2.1 菌种筛选及验证
通过筛选及验证最终得到8株细菌,分别为:X1,X2 来自小茴香蜜;W1,W3 来自五倍子蜜;A1,A3来自桉树蜜;Zao2,Zao3来自枣花蜜。因为蜂蜜中的糖含量很高,从蜂蜜中筛选的微生物有可能是耐高糖的,所以要用高糖培养基验证以排除其它的杂菌。
8株菌都能在含葡萄糖20 g/dL的培养基上生长; 其中 X1,X2,W1,A1,A3 能在含葡萄糖 30 g/dL的培养基上生长;只有A1能在含葡萄糖40 g/dL的培养基上生长;8株菌均不能在含葡萄糖50 g/dL的培养基生长。
2.2 菌种鉴定
2.2.1 菌体形态观察和生理生化实验 在营养琼脂培养基上菌落形态特征:X1白色,边缘有树状分枝;X2淡红色,菌落边缘呈绒毛状,菌落干燥;W1黄色,菌落较规则;W3浅黄色;A1乳白色,菌落较光滑,边缘透明,产粘液;A3乳白色,菌落边缘呈绒毛状,产粘液;Zao2白色,边缘有绒毛状分枝,菌落较小;Zao3白色,边缘有绒毛状分枝,菌落较大,与Zao2相比生长较快。生理生化实验结果见表1。

表1 生理生化特性Table 1 Physiological and biochemical characteristics
2.2.2 系统进化树的构建 通过MEGA 4.0.2软件采用邻接法(Neighbor-Joining method)进行聚类分
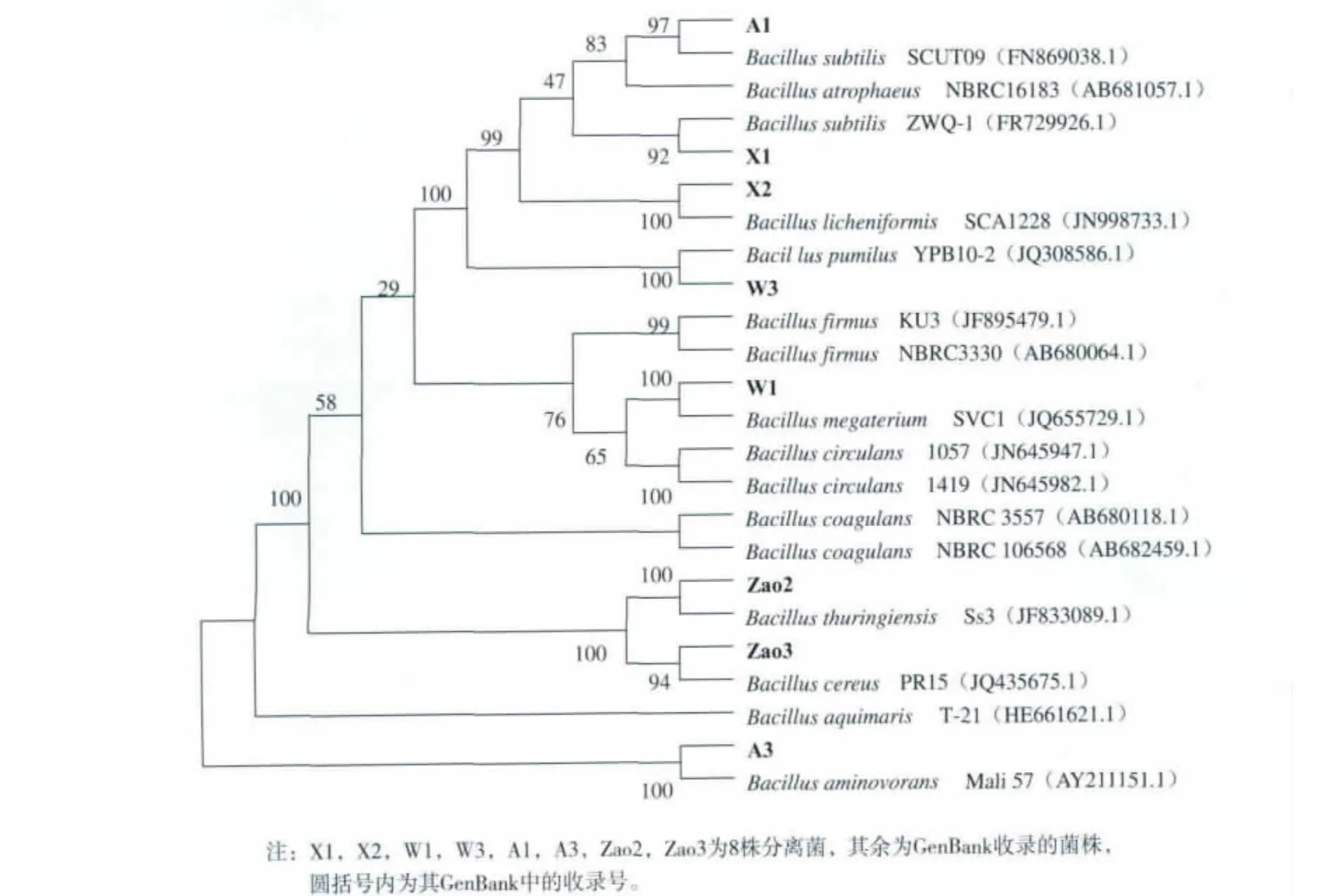
图1 MEGA4.0.2软件构建的8株分离菌的16SrRNA基因系统发育树Fig.1 Phylogenetic tree of the 8 isolated strains structure by MEGE4.0.2
经测定菌株X1的16S rRNA基因序列全长1 424 bp, 与 菌 株 Bacillus subtilis ZWQ-1(FR 729926.1)的同源性水平最高,置信度为92%,相似度为99%,并且菌株X1的菌落形态特征和生理生化性质大部分符合伯杰细菌鉴定手册中枯草芽孢杆菌的性质,所以初步鉴定X1为枯草芽孢杆菌(Bacillus subtilis);菌株X2的16S rRNA基因序列全 长1 423 bp, 和 菌 株 Bacillus licheniformis SCA1228(JN998733.1)的置信度为 100%,相似度达到了100%,菌株X2的菌落形态特征和生理生化性质与伯杰细菌鉴定手册中的Bacillus licheniformis相似,则认为X2属于地衣芽孢杆菌(Bacillus licheniformis);菌株W1的16S rRNA基因序列全长1 427 bp,与 Bacillus megaterium SVC1(JQ655729.1)的置信度为100%,相似度为99%,结合菌株W1的菌落形态特征和生理生化性质,可以认为W1为巨大芽孢杆菌(Bacillus megaterium);菌株 W3的 16S rRNA基因序列全长1 423 bp,和菌株Bacillus pumilus YPB10-2(JQ308586.1)的置信度为 100%,相似度为100%,菌株W3的菌落形态特征和生理生化性质与伯杰细菌鉴定手册中的Bacillus pumilus相符合,则认为W3是短小芽孢杆菌(Bacillus pumilus);经测定菌株 A1的16S rRNA 基因序列全长1 574 bp,其与Bacillus subtilis SCUT09(FN869038.1)同源性水平最高,置信度为97%,相似度达到了99%,结合菌株A1的菌落形态特征和生理生化性质,可以认为A1属于枯草芽孢杆菌(Bacillus subtilis);菌株A3的16S rRNA基因序列全长 1 580 bp, 与 Bacillus aminovorans Mali 57(AY211151.1)同源性水平最高,置信度为100%,相似度仅仅94%,而菌株A3的菌落形态特征和生理生化性质与伯杰细菌鉴定手册中枯草芽孢杆菌的性质符合,暂且命名A3为Bacillus sp.SYBC-hb6;菌株Zao2的16S rRNA基因序列全长1 577 bp,与菌株 Bacillus thuringiensis Ss3(JF833089.1)同源性水平最高,置信度为100%,相似度达到了99%,同时析和系统进化树构建,得到的进化树见图1。结合其菌落形态特征和生理生化性质,认为Zao2属于苏云金芽孢杆菌 (Bacillus thuringiensis);Zao3的16S rRNA基因序列全长1 433 bp,与菌株Bacillus cereus PR15(JQ435675.1)的同源性最高,置信度为94%,相似度为99%,并且菌株Zao3的菌落形态特征和生理生化性质符合伯杰细菌鉴定手册中蜡样芽孢杆菌的性质,所以认为其为蜡样芽孢杆菌(Bacillus cereus)。
最终确定X1为枯草芽孢杆菌(Bacillus subtilis),X2 为 地 衣 芽 孢 杆 菌 (Bacillus licheniformis),W1 为 巨 大 芽 孢 杆 菌 (Bacillus megaterium),W3 为 短 小 芽 孢 杆 菌 (Bacillus pumilus),A1 为枯草芽孢杆菌 (Bacillus subtilis),Zao2为苏云金芽孢杆菌 (Bacillus thuringiensis),Zao3为蜡样芽孢杆菌(Bacillus cereus)。分别命名8株菌见表2。

表2 菌种的命名及来源Table 2 Honey isolates species name and species origin
2.3 分离菌对指示菌的抑制作用
分离菌对指示菌的抑制作用的实验中见表3。

表3 分离菌对3种指示菌的抑制作用Table 3 Antimicrobial activity of the bacterial isolates against three indicator bacteria
菌株X2,W1,W3周围没有抑菌圈;而菌株X1,A1,A3,Zao2,Zao3 的周围有明显的抑菌圈,见图 2。说明其对三种或者其中的一种指示菌有抑制作用,原因有两种:可能是分离菌和指示菌之间的生长有竞争作用,即生活在一起的两种微生物,为了生长争夺有限的同一营养或其他共同需要的生长条件而相互竞争,互相受到不利的影响称为竞争。另一种可能菌株 X1,A1,A3,Zao2,Zao3 适应环境快,生长的较快,使其在生长上占优势,而三种指示菌适应环境慢,生长的较慢,其在生长上处于不利的形势, 导致菌株 X1,A1,A3,Zao2,Zao3 的周围形成了抑菌圈;也有可能是它们之间存在着拮抗现象,即两种微生物生活在一起,其中的一种能产生某些特殊的代谢产物或改变环境条件,从而抑制或杀死另一种微生物的现象称为拮抗。X1,A1,A3,Zao2,Zao3这些菌株可能产生某些抑菌物质或改变环境条件,从而抑制或杀死指示菌,也导致菌株X1,A1,A3,Zao2,Zao3的周围形成了抑菌圈。
2.4 分离菌发酵液的抑菌作用
加有X2,W1,W3这些菌的发酵液的周围没有抑菌圈,见表4。表明其发酵液对3种指示菌没有抑制作用,可能是X2,W1,W3在代谢过程中没有产生抑菌物质。

图2 Zao2对粘质沙雷氏菌的抑制作用Fig.2 Antibacterial activity of Zao2 against Serratia marcescens SYBCT02
菌株X1,A1,A3的发酵液抑菌效果较好,在平板上有明显的抑菌圈,见图3、图4。通过菌种的鉴定得知X1,A1为枯草芽孢杆菌 (Bacillus subtilis),而枯草芽孢杆菌(Bacillus subtilis)在生长代谢过程中能够产生多种抗菌物质,包括非核糖体合成的脂肽类抗生素(lipopeptide antibiotics)、核糖体合成的羊毛硫抗生素(lantibiotics)和抗菌蛋白[8-9]。这些抗菌物质可以抑制细菌、真菌和酵母,在食品、医药、化工和防治植物病害等方面有重要的应用价值[10]。加入X1,A1的发酵液后,产生抑菌圈,可能就是因为它们的发酵液含有这些抗菌物质。菌株A3的性质尚待进一步研究。

表4 分离菌的发酵液对指示菌的抑制作用Table 4 Antimicrobial activity of the bacterial isolates of liquid fermentation against three indicator bacteria
菌株 Zao2,Zao3的周围在分离菌对指示菌的抑制作用实验中有抑菌圈,而在分离菌发酵液的抑菌作用实验中没有,则有可能是分离菌和指示菌之间存在着生长竞争作用,菌株Zao2,Zao3适应环境快,生长的速度也快于指示菌,而使其在生长上占优势,就在菌株Zao2,Zao3的周围形成了抑菌圈。

图3 A3,Zao2,Zao3的发酵液对大肠杆菌的抑制作用Fig.3 Antimicrobial activity of the liquid fermentation of A3,Zao2,Zao3 against Escherichia coli

图 4 X1,X2,A1,A3,Zao3 的发酵液对粘质沙雷氏菌的抑制作用Fig.4 Antimicrobial activity of the liquid fermentation of X1,X2,A1,A3,Zao3 against Serratia marcescens SYBCT02
3 结语
作者从4种蜂蜜中筛选到8株细菌,均为芽孢杆菌,并通过验证这8株菌能够在耐高糖的环境下生长,这与它们的生存环境有关:蜂蜜中的含糖量很高(平均超过了85%),包括果糖、葡萄糖、麦芽糖、蔗糖和其他碳水化合物[11]。
通过对这些分离菌的抑菌性质的研究,发现有些菌株是通过竞争作用抑制其他菌落的生长,还有些菌株是通过其代谢过程产生的抑菌物质来抑制其他菌落的生长。通过菌种的鉴定得知有两株菌为枯草芽孢杆菌(Bacillus subtilis),枯草芽孢杆菌在生长代谢过程中能够产生两类抗菌物质,一类是非核糖体合成的脂肽类抗生素 (lipopeptide antibiotics),例如 surfactin,iturin,plipastatin 等[12],通常对植物病原真菌具有显著的抑菌活性,对细菌、病毒和寄生虫也有一定抑制效果;另一类为核糖体合成的细菌素(bacteriocin), 例如 subtilosin,sublancin,subtilint[13]属于类似于nisin的羊毛硫抗生素(lantibiotics),能够有效地杀死近缘细菌。因此研究Bacillus subtilis抗菌物质在医学、农业和食品上具有广阔的应用前景。
[1]玄红专,胡福良.过氧化氢与蜂蜜的抗菌活性[J].蜜蜂杂志,2002,9:23-24.XUAN Hong-zhuan,HU Fu-liang.Hydrogen peroxide and antimicrobial activity of honey[J].Journal of Bee,2002,9:23-24.(in Chinese)
[2]张金振,赵静.蜂蜜中微生物的污染与控制[J].中国蜂业,2006,57(9):30.ZHANG Jin-zhen,XIAO Jing.Microbial contamination and control in honey[J].Apiculture of China,2006,57 (9):30. (in Chinese)
[3]姚京辉,陈云,姚海春.蜂蜜抗菌作用机理研究[J].蜜蜂杂志,2009,11:41-42.YAO Jing-hui,CHEN Yun,YAO Hai-chun.Research on antimicrobial function mechanism of honey[J].Journal of Bee,2009,11:41-42.(in Chinese)
[4]Nakano H,Okabe T, Hashimoto H,et al.Incidence of Clostridium botulinum in honey of various origin[J].Japanese Journal of Medical Science and Biology,1989,43:183-195.
[5]Lee H,Churey J J,Worobo R W.Antimicrobial activity of bacterial isolates from different floral sources of honey[J].International Journal of Food Microbiology,2008,126:240-244.
[6]López A C,Alippi A M.Phenotypic and genotypic diversity of Bacillus cereus isolates recovered from honey[J].International Journal of Food Microbiology,2007,117:175-184.
[7]Harding C D,Shaw B G.Antimicrobial activity of Leuconostoc gelidum against closely related species and Listeria monocytogenes[J].Journal of Applied Bacteriology,1990,69:648-654.
[8]Moyne A L,Cleveland T E,Tuzun S.Molecular characterization and analysis of the operon encoding the antifungal lipopeptide bacillomycin D[J].FEMS Microbiology Letters,2004,234:43-49.
[9]孔建,王文夕,赵白鸽,等.枯草芽孢杆菌B-903菌株的研究及影响抗菌物质产生和积累的主要因素[J].中国生物防治,2000,16(2):65-68.KONG Jian,WANG Wen-xi,ZHAO Bai-ge,et al.Research on Bacillus subtilis strain B-903 and the main factors affected antibacterial substances produced and accumulated[J].Chinese Journal of Biological Control,2000,16 (2):65-68. (in Chinese)
[10]Yeh M S,Wei Y H,Chang J S.Bioreactor design for enhanced carrier-assisted surfactin production with Bacillus subtilis[J].Process Biochemistry,2006,41:1799-1805.
[11]Nakayma S,Takahashi M.Isolation of new variants of surfactin by a recombinant Bacillus subtilis[J].Applied Microbiol Biotechnol,1997,48:80-82.
[12]Hansen J N.Antibiotics synthesized by post translational modification[J].Annu Rev Microbiol,1993,47:535-564.
