发酵牛肉调味基料对三株致病菌的抑菌作用及机理
2020-03-03,*
,*
(1.天津农学院食品科学与生物工程学院,天津 300384; 2.天津农学院水产学院,天津 300384)
病原微生物污染是引起食源性疾病的主要原因之一,严重威胁着人类健康和社会经济发展[1]。抑制食品中腐败微生物生长繁殖,提高食品安全的研究水平尤为重要[2-3]。随着科技的发展和现代食品安全质量标准的提高,绿色、安全、高效的抑菌剂开发成为学者研究的重点[4]。研究发现,小分子肽经美拉德反应后,不仅可以提升产物气味和滋味[5],其终产物的抑菌作用也有所增强[6-7]。
陈金斌等[8]研究发现蟹肉酶解多肽与木糖等美拉德反应产物对金黄色葡萄球菌、蜡状芽孢杆菌、枯草芽孢杆菌和大肠杆菌等四种常见食品污染菌均有不同程度的抑制作用。李婷等[9]研究发现,100 ℃加热60 min,黄鲫蛋白抗菌肽-葡萄糖美拉德反应物对大肠杆菌的抑菌圈直径可达28.9 mm。董志俭等[10]以低值虾酶解液为原料,通过美拉德反应制备虾味香精,发现其对金黄色葡萄球菌、大肠杆菌、沙门氏菌均有较好的抑菌性。研究表明,美拉德反应的抑菌性可能与产物中的类黑精[11]、氨基还原酮、吲哚[12]等衍生物及其氧化还原电位有关[13]。发酵牛肉调味料(Fermented Beef Flavorings,FBF)是以牛骨肉末为原料,经高压浸提、酶解、发酵、美拉德反应等环节制成的一种热反应肉味香精[14]。本实验室前期确定了FBF的抑菌活性,同时从常用的15株肉品发酵剂中筛选得到WBL-45(木糖葡萄球菌+肉葡萄球菌+清酒乳杆菌)、VHI-41(木糖葡萄球菌+戊糖片球菌+植物乳杆菌)、清酒乳杆菌(Lactobacillussake,LS)为发酵剂制得的FBF抑菌活性更强[15],但是FBF的抑菌方式并未明确。
试验以WBL-45、VHI-41、LS为发酵剂制作FBF,选用大肠杆菌、乙型副伤寒沙门氏菌和金黄色葡萄球菌分别作为革兰氏阴性菌和革兰氏阳性菌的典型指示菌,通过测定不同FBF对三株指示菌的半数抑制浓度(Inhibitory Concentration 50,IC50)、FBF处理指示菌后的生长曲线、菌体细胞形态的变化以及FBF对细胞膜通透性的影响,综合分析FBF的抑菌机理,从而为FBF更好地应用于食品产业提供理论依据。
1 材料与方法
1.1 材料与仪器
冷冻牛骨肉末(骨肉比为3∶7) 顶兴(天津)食品科技发展有限公司提供;WBL-45、VHI-41 意大利萨科公司;LS 萨科商业复合菌中分离纯化获得;风味蛋白酶(500 LAPU/g)、复合蛋白酶(1.5 AU/g) 丹麦诺维信公司;金黄色葡萄球菌(ATCC 6538)、大肠杆菌、乙型副伤寒沙门氏菌(CMCC 50094) 中国农业大学微生物实验室提供;MRS液体培养基 北京索莱宝科技有限公司;酵母提取物、胰蛋白胨、氯化钠、氢氧化钠 分析纯,天津市风船化学试剂科技有限公司。
SX-500高压蒸汽灭菌锅 日本Tomy有限公司;THZ-98AB恒温振荡器 上海一恒科学仪器有限公司;Friocell 22恒温恒湿培养箱 艾力特国际贸易有限公司;Bioscreen C微生物全自动生长曲线分析仪 芬兰Bioscreen公司;Phenom Pro台式扫描电镜 Phenom word BV公司;2265FS溶液EC计 沃德精准(北京)科贸有限公司。
1.2 实验方法
1.2.1 实验分组设计 实验共设计了四组,具体分组介绍见表1。
1.2.2 菌种的活化及菌悬液的制备 WBL-45、VHI-41、LS发酵剂于MRS液体培养基37 ℃连续活化3代。金黄色葡萄球菌、大肠杆菌、乙型副伤寒沙门氏菌于LB液体培养基中,37 ℃下活化3代,用无菌LB稀释至107CFU/mL。
1.2.3 不同FBF的制作
1.2.3.1 工艺流程 原料选择(牛骨肉末)→高压浸提→酶解→发酵12 h(或不发酵)→美拉德反应→过滤[15]。
1.2.3.2 操作要点 a.高压浸提:将63 g牛骨肉末及252 g蒸馏水以1∶4的比例混合,0.1 MPa、121 ℃下加热4 h。吸取5 mL用于pH的测定。
b.酶解:浸提液冷却至室温,分别添加0.186 g风味蛋白酶和0.093 g的复合蛋白酶,于50 ℃振荡4.5 h,酶解结束后沸水浴灭酶20 min。吸取5 mL用于pH的测定。
c.发酵:将WBL-45、VHI-41、LS分别接种,30 ℃发酵12 h,接种量保证在106CFU/mL,发酵结束后沸水浴灭菌20 min。吸取5 mL用于pH的测定。CK组跳过此步骤。
d.美拉德反应:添加3.6 g木糖、3.6 g葡萄糖、2.7 g半胱氨酸、1.35 g甘氨酸、1.35 g丙氨酸、5.4 g VB1,搅拌均匀后在110 ℃下美拉德反应60 min。吸取5 mL用于pH的测定。
e.过滤:将美拉德反应液于4 ℃静置12 h,双层纱布过滤去除骨渣和脂肪,过0.45 μm水膜。FBF于4 ℃贮藏备用。
1.2.4 三种FBF分别对三株指示菌IC50的确定 参考林洋等[16]方法并作适当修改。试验通过光密度法确定FBF对指示菌抑制率的影响。设置7个系列浓度梯度FBF,通过观察指示菌菌液在含不同浓度FBF培养基中生长状态的差异,探究FBF浓度与抑菌率关系,以7个浓度梯度中,抑菌率最接近50%(±5%)的稀释浓度为IC50浓度。具体操作如下:采用二倍稀释法,用无菌盐水将三种FBF分别稀释成7个系列浓度梯度(分别为100、50、25、12.5、6.25、3.125、1.5625 mL/100 mL),移取上述稀释液30 μL于96孔板中,与70 μL指示菌悬液进行混合。每种FBF终浓度分别为30、15、10、7.5、3.75、1.88、0.93 mL/100 mL。37 ℃反应12 h,测定600 nm下的OD指示菌+FBF值。同时做空白对照和阳性对照,分别测定600 nm下的ODLB+盐水、OD指示菌+盐水、ODLB+FBF。试验以OD对照表征指示菌正常生长状态,OD实际值表征指示菌在含有FBF培养基中生长情况,通过计算观察FBF对指示菌生长状态的影响,由此确定三种FBF对三株指示菌IC50。计算公式如下所示。
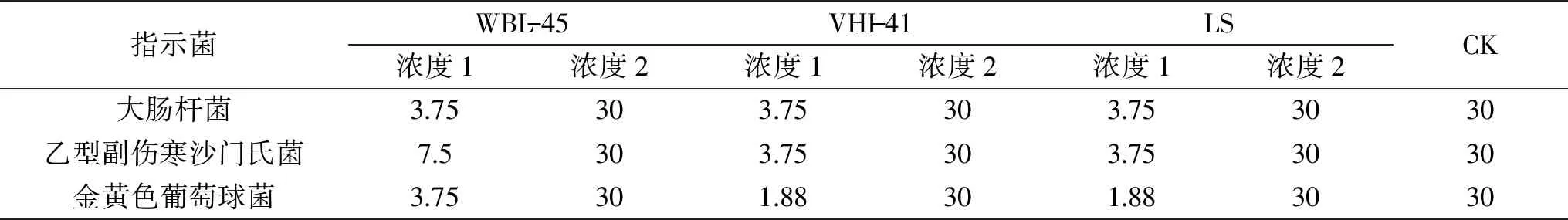
表2 FBF处理3株指示菌的终浓度(mL/100 mL)Table 2 Final concentration of three indicator strains treated with FBF(mL/100 mL)
OD实际值=OD指示菌+FBF-ODLB+FBF
OD对照=OD指示菌+盐水-ODLB+盐水

式中,ODLB+盐水为70 μL LB+30 μL盐水600 nm下的OD值;ODLB+FBF为70 μL LB+30 μL FBF600 nm下的OD值;OD指示菌+盐水为70 μL指示菌+30 μL盐水600 nm下的OD值。
1.2.5 不同FBF浓度下三个指示菌的生长曲线 参考Shi等[17]方法并作适当修改。通过1.2.4试验结果,确定了三组FBF针对三株指示菌各自的IC50浓度。由于同一FBF针对不同指示菌IC50浓度存在差异,同一指示菌不同FBF的IC50浓度也不同。为方便操作和表述,三组FBF均选用两个浓度进行此部分试验。浓度1的FBF为针对三株指示菌IC50浓度所对应的不同稀释倍数,浓度2的FBF为原液。将两种浓度的FBF 60 μL置于酶标板中,分别与140 μL指示菌菌液混合,使得酶标板中各组FBF终浓度分别为针对不同指示菌的IC50浓度和30 mL/100 mL。具体处理的终浓度如表2所示。将样品置于微生物全自动生长曲线分析仪中,于37 ℃条件下每隔15 min测定各孔样品在波长600 nm下的OD值,绘制指示菌经FBF处理后的生长曲线。试验设置60 μL盐水+140 μL指示菌为对照组,同时测定CK组原液对指示菌生长状态的影响。
1.2.6 不同FBF对指示菌细胞形态的影响 为了更加直观有效地观察FBF对指示菌菌体形态的影响,试验以LS组为代表,采用高浓度FBF处理指示菌。参考石超[18]方法并作适当修改。将大肠杆菌、乙型副伤寒沙门氏菌、金黄色葡萄球菌于37 ℃,130 r/min活化12 h。三株指示菌均在4 ℃,2000×g下离心15 min,收集菌体,用无菌生理盐水冲洗3次后重悬于盐水中,使OD600 nm约为0.5。取700 μL指示菌重悬液,加入300 μL FBF混合,以700 μL指示菌液+300 μL盐水为对照,37 ℃反应12 h,离心(4 ℃、6000×g、10 min),2%多聚甲醛溶液(Paraformaldehyde,PFA)+2.5%戊二醛固定,4 ℃过夜。0.1 mol/L的磷酸盐缓冲液冲洗样品3次,每次10 min。使用呈梯度浓度的酒精(50%、70%、80%、90%、100%)洗脱,叔丁醇置换酒精,冷冻干燥,喷金后上扫描电镜观察细胞结构。
1.2.7 不同FBF对指示菌膜通透性的影响 本实验通过测定指示菌液的相对电导率研究不同FBF浓度对膜通透性的影响。参考张赟彬等[19]、Diao等[20]的方法并作适当修改。用灭菌的5%葡萄糖溶液将WBL-45、VHI-41、LS组FBF稀释至不同指示菌的IC50浓度。三株指示菌分别接种于 LB 液体培养基,37 ℃振荡培养12 h,离心(4000×g,4 ℃,10 min),5%葡萄糖溶液冲洗菌体三次,重悬于5%葡萄糖溶液中,使OD600 nm约为0.5,此为等渗菌液。取等渗菌液3.5 mL,加入IC50浓度的FBF 1.5 mL,37 ℃下培养12 h。测定0和12 h的电导率,分别记为EC1和EC2,通过公式计算,了解IC50浓度下FBF处理指示菌菌液后的相对电导率(相对电导率(IC50-FBF),%)。试验采用沸水加热5 min的指示菌菌液的相对电导率为对照[相对电导率(0FBF)(%),即不使用FBF处理指示菌,通过沸水加热5 min,对指示菌进行处理,观察菌液相对电导率的变化]。具体操作如下:取3.5 mL等渗菌液与1.5 mL葡萄糖溶液混合,37 ℃培养12 h后沸水浴 5 min,测定沸水浴前后的相对电导率,分别记为EC3和EC4。菌种膜通透性的相对电导率根据如下公式计算。


式中,EC1为FBF与指示菌菌液刚混合时的电导率;EC2为FBF与指示菌菌液混合12 h后的相对电导率;EC3为沸水浴前无菌生理盐水与指示菌菌液的电导率;EC4为沸水浴后无菌生理盐水与指示菌菌液的电导率。
1.3 数据分析
使用Excel 2016处理数据,用Sigma plot 10.0绘图,用Statistix 8.1中Tukey HSD进行显著性检验(P<0.05)。
2 结果与分析
2.1 确定FBF对指示菌的IC50
光密度法是检测微生物生长状态的方法之一,微生物菌体在600 nm有特征吸收峰,OD600 nm越高代表菌体数量越多。本研究测定了指示菌在含不同浓度FBF培养基中生长后的OD600 nm,以反映FBF对指示菌的生长抑制作用。OD600 nm值越低,代表FBF对指示菌生长抑制越强烈,反之则代表抑制效果较弱。
大肠杆菌、乙型副伤寒沙门氏菌、金黄色葡萄球菌经不同浓度FBF处理后的生长情况分别见图1A~C。总体而言,高浓度的对照组(CK)和三组FBF对大肠杆菌、乙型副伤寒沙门氏菌、金黄色葡萄球菌的生长均有显著的抑制作用(P<0.05);低浓度的牛肉调味料,尤其是CK组对菌体的生长有促进作用。与CK组相比,FBF对菌体的生长抑制作用更强,三组FBF浓度在1.88~30 mL/100 mL范围内对指示菌的生长抑制作用呈浓度依赖关系。WBL-45、VHI-41、LS组FBF对大肠杆菌的IC50均为3.75 mL/100 mL,而CK组终浓度为30 mL/100 mL时(体系中最高浓度),其对大肠杆菌抑制率仅为22%左右。对乙型副伤寒沙门氏菌而言,WBL-45、VHI-41、LS组IC50为7.5、3.75和3.75 mL/100 mL。四种牛肉调味基料对金黄色葡萄球菌的抑制作用均随浓度的增加而增强。VHI-41、LS组FBF对金黄色葡萄球菌的抑制作用较强,IC50均为1.88 mL/100 mL,WBL-45对金黄色葡萄球菌的IC50为3.75 mL/100 mL,CK组为10 mL/100 mL。高压浸提、酶解、发酵等环节可使牛骨肉末中的大分子营养物质蛋白质等降解为小分子肽或氨基酸,低浓度FBF中小分子物质的存在可促进指示菌生长繁殖,随着FBF浓度的升高,抑菌物质不断累积,FBF的抑菌作用增强,FBF抑菌作用与浓度存在依赖关系。

图1 指示菌IC50的确定Fig.1 Determination of target bacteria IC50 注:A:大肠杆菌IC50的确定;B:乙型副伤寒沙门氏菌 IC50的确定;C:金黄色葡萄球菌IC50的确定。
2.2 指示菌的生长曲线
进一步采用生长曲线法,探讨牛肉调味基料对指示菌生长的控制作用。将大肠杆菌、乙型副伤寒沙门氏菌、金黄色葡萄球菌培养在含有IC50及30 mL/100 mL FBF培养基上,监控培养24 h的生长曲线。结果如图2~图4,曲线1、11、21分别为大肠杆菌、乙型副伤寒沙门氏菌、金黄色葡萄球菌在37 ℃条件下正常的生长曲线,可以明确区分生长的4个时期:延滞期、对数期、稳定期、衰亡期[21]。0~100 min是延滞期,100~800 min为对数生长期,随后是稳定期。
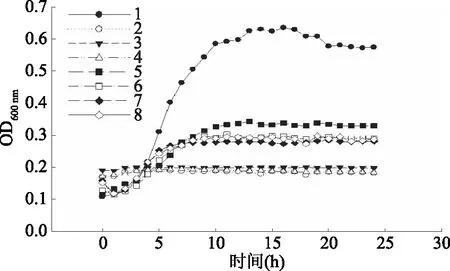
图2 大肠杆菌生长曲线Fig.2 Growth curve of Escherichia coli
注:1:对照组大肠杆菌生长曲线;2:WBL-45组浓度2处理的大肠杆菌(WBL-45终浓度为30 mL/100 mL)的生长曲线(WBL45-30 mL/100 mL);3:VHI41-30 mL/100 mL;4:LS-30 mL/100 mL;5:CK-30 mL/100 mL;6:用浓度1的WBL-45处理的大肠杆菌的生长曲线(WBL45-IC50);7:VHI41-IC50;8:LS-IC50。

图3 乙型副伤寒沙门氏菌生长曲线Fig.3 Growth curve of Salmonella paratyphi B
注:11:对照组乙型副伤寒沙门氏菌的生长曲线;12:WBL-45浓度2处理的乙型副伤寒沙门氏菌(WBL-45终浓度为30 mL/100 mL)的生长曲线(WBL45-30 mL/100 mL);13:VHI41-30 mL/100 mL;14:LS-30 mL/100 mL;15:CK-30 mL/100 mL;16:用浓度1的WBL-45处理的乙型副伤寒沙门氏菌的生长曲线(WBL45-IC50);17:VHI41-IC50;18:LS-IC50。
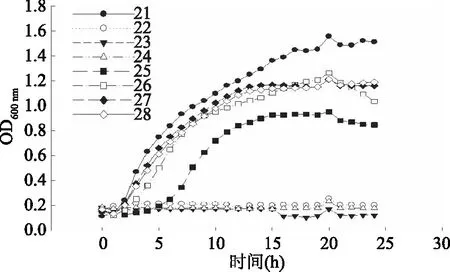
图4 金黄色葡萄球菌生长曲线Fig.4 Growth curve of Staphylococcus aureus
注:21:对照组金黄色葡萄球菌的生长曲线;22:WBL-45浓度2处理的金黄色葡萄球菌(WBL-45终浓度为30 mL/100 mL)的生长曲线(WBL45-30 mL/100 mL);23:VHI41-30 mL/100 mL;24:LS-30 mL/100 mL;25:CK-30 mL/100 mL;26:用浓度1的WBL-45处理的金黄色葡萄球菌的生长曲线(WBL45-IC50);27:VHI41-IC50;28:LS-IC50。
观察FBF处理对大肠杆菌生长状况的影响,VHI41-IC50、LS-IC50组与对照组大肠杆菌在100 min左右进入对数生长期,CK-30 mL/100 mL组约在150 min进入对数生长期,进入稳定期时,正常状态生长的大肠杆菌菌液OD600 nm约为0.6,高于经3组浓度1和浓度2的FBF处理后的大肠杆菌菌液。经CK组和三组FBF处理后,大肠杆菌出现延滞期延长,对数生长期延后,稳定期OD600 nm值降低的现象。说明FBF处理能够延迟指示菌对数生长期的到来,降低指示菌的最大比生长速率,从而抑制其生长繁殖。这种现象与其他抑菌物质对病原菌的生长抑制效果一致[22]。在含有高浓度(30 mL/100 mL)FBF的情况下,指示菌在培养的24 h内始终未出现明显增长,OD600 nm接近于平滑直线,说明高浓度的FBF可以完全抑制三株指示菌的生长繁殖,不过本研究检测时间有限,不确定在延长培养时间后指示菌是否还能进入对数生长期。综合分析图2~图4可知,添加IC50浓度的FBF延长了大肠杆菌、乙型副伤寒沙门氏菌、金黄色葡萄球菌的生长延滞期,另外,FBF明显降低了指示菌的最大比生长速率以及成熟期的最高菌量。与CK组相比,同等浓度的FBF对菌体的生长抑制作用更强,尤其是对抑制指示菌最大比生长速率抑制作用更明显。FBF与CK组的差异主要在于发酵处理的差异。发酵处理使得FBF中抑菌物质大量累积,抑制了指示菌的生长繁殖速度,指示菌37 ℃下生成量少,成熟期指示菌OD600 nm小。
2.3 FBF对指示菌细胞形态的影响
FBF对菌体生长的强烈抑制作用,可能源于FBF中各类抑菌物质对菌体代谢的干扰甚至结构的破坏。图5直观地展现了经LS组FBF处理的各种指示菌的形态变化。结果表明:正常状态下大肠杆菌(图5A)、乙型副伤寒沙门氏菌(图5C)呈杆状,金黄色葡萄球菌(图5E)呈球状,三株指示菌形态饱满、外表光滑;而经LS组FBF处理12 h后,细菌表面塌陷,菌体变形,大肠杆菌细胞表面出现较严重的皱缩和塌陷,部分细菌表面出现小孔,甚至发生断裂(图5B);乙型副伤寒沙门氏菌细胞出现孔洞,菌体扭曲变形(图5D);金黄色葡萄球菌失去了圆滑的球状形态,部分菌体表面出现孔洞,胞膜完整性遭到破坏,某些菌体出现溶解现象(图5F)。FBF中的抑菌物质可能包含发酵剂代谢产生的有机酸、短链脂肪酸、抗菌肽以及美拉德反应产物等。因此FBF处理后菌体呈现明显破坏作用。

图5 扫描电镜观察指示菌的形态(50000×)Fig.5 The morphology of target bacteria observed under scanning electron microscope(50000×)
注:A:正常大肠杆菌形态;B:30% LS处理12 h的大肠杆菌形态;C:正常乙型副伤寒沙门氏菌形态;D:30% LS处理12 h乙型副伤寒沙门氏菌形态;E:正常金黄色葡萄球菌形态;F:30% LS处理12 h的金黄色葡萄球菌形态。
2.4 FBF对指示菌膜通透性的影响
试验进一步通过相对电导率的变化来考察FBF对指示菌细胞膜通透性的影响。一般情况下,相对电导率越大,说明菌体电解质渗漏量越多,细胞膜受损越严重[23]。IC50浓度FBF处理对指示菌液相对电导率的影响如图6所示。不同FBF组对指示菌液相对电导率的影响存在明显差异。IC50浓度FBF和沸水杀菌处理后,大肠杆菌的相对电导率均升高。沸水杀菌使大肠杆菌的相对电导率升高了2%,IC50浓度下的WBL-45、VHI-41、LS处理可分别使大肠杆菌的相对电导率升高10%、3%、11%,由此说明:FBF及沸水杀菌处理均可使大肠杆菌细胞膜通透性增大,胞内电解质外泄,从而抑制大肠杆菌生长繁殖。

图6 FBF处理对指示菌菌液相对电导率的影响Fig.6 Effects of rhe FBF treatment on relative conductivity of target bacteria 注:不同字母代表差异显著(P<0.05)。
观察乙型副伤寒沙门氏菌、金黄色葡萄球菌经IC50浓度FBF处理12 h后相对电导率的变化,两种指示菌的相对电导率均呈现降低现象,该结果与毕振飞等[24]的研究有相似之处,该试验研究了植物抗菌液处理金黄色葡萄球菌8 h内相对电导率的变化,试验结果表明,抗菌液作用于指示菌后其相对电导率值呈先下降、后上升的趋势。有研究表明,相对电导率和膜电位存在相关性,细胞通透性主要由膜电位决定,小分子电解质(钾电导和钠电导)随着膜电位去极化程度的增大而增大,随着超极化程度的增大而降低[25],细胞发生去极化,膜电位降低,相对电导率升高[26],细胞发生超极化现象,膜电位升高,相对电导率降低。由此可以推断,三组FBF对大肠杆菌、乙型副伤寒沙门氏菌、金黄色葡萄球菌膜通透性影响作用不同,FBF处理使大肠杆菌细胞膜受损,胞内电解质大量泄露,瓦解了细胞质膜屏障,最终导致菌体死亡。FBF作用于乙型副伤寒沙门氏菌和金黄色葡萄球菌,使细胞发生超极化现象,胞膜离子稳态遭到破坏,菌体代谢发生异常,继而对乙型副伤寒沙门氏菌和金黄色葡萄球菌产生抑制作用。
3 结论
本研究结果表明:低浓度WBL-45组、VHI-41组、LS组FBF对大肠杆菌、乙型副伤寒沙门氏菌的生长有一定的促进作用,当FBF浓度增高到1.88~3.75 mL/100 mL时,其对指示菌的生长开始出现抑制,且存在着浓度依赖关系。WBL-45组对大肠杆菌、乙型副伤寒沙门氏菌、金黄色葡萄球菌的IC50浓度依次为3.75、7.5、3.75 mL/100 mL,VHI-41组和LS组FBF对三株指示菌IC50浓度依次为3.75、3.75、1.88 mL/100 mL。三种FBF能够抑制三株指示菌的正常生长和增殖,延长指示菌延滞期、延迟对数期、降低最大生长速率,从而抑制指示菌生长;IC50浓度下处理指示菌,可使细胞发生去极化或超极化,影响菌体电解质或小离子物质正常运输;FBF还可以破坏细胞的正常形态,造成菌体死亡。本研究初步探讨了FBF的抑菌机理,其关键抑菌物质及作为调味料应用于产品中的实际抑菌性还需更进一步的研究。
