蛹虫草Cordyceps militaris JN168产虫草素液态发酵条件的优化
2013-02-19岳翠翠沈健增蔡宇杰廖祥儒罗军侠张大兵
岳翠翠 , 沈健增 , 蔡宇杰 *, 廖祥儒 , 罗军侠 , 张大兵
(1.江南大学 工业生物技术教育部重点实验室,江苏 无锡 214122;2.江南大学 生物工程学院,江苏 无锡214122;3.江苏汉邦科技有限公司,江苏 淮安 223001)
蛹虫草学名为Cordyceps militaris,俗称北冬虫夏草、北蛹虫草、虫草等,属子囊菌亚门,麦角菌目,麦角菌科、虫草属[1]。蛹虫草是中国传统药用真菌中的一种。现代医药学研究证明,蛹虫草中含有虫草素、虫草酸和虫草多糖等多种有效成分,可用于肺结核、老人虚弱和贫血等疾病的治疗[2]。虫草素是蛹虫草有效成分中的重要活性物质。虫草素(cordycepin)又称虫草菌素、蛹虫草菌素,是由Cunningham等在1951年首先从蛹虫草Cordyceps militaris的培养滤液中分离得到,是第一个从真菌中分离出来的核苷类抗菌素[3]。其分子式为C10H13N5O3,结构式见图1。相对分子质量为251,碱性,针状或片状结晶[4]。虫草素是一种天然来源的药物,对DNA和RNA合成,hnRNA和mRNA转录后修饰以及腺苷酸环化酶等均具有抑制作用,具有抗炎、抗真菌、抗癌及抗病毒等多种生理活性[5]。虫草素在美国已进入临床实验研究,用于白血病的治疗[2]。目前虫草素的研究现正成为药物化学中一个极其活跃的领域。虫草素在自然界中被发现仅存在于虫草属(cordyceps)真菌中,其中在蛹虫草中含量较高,是目前生产虫草素的主要菌种[6-7]。蛹虫草能产生虫草素,其菌丝体生长过程中98%的虫草素分泌到培养基中[8]。所以利用蛹虫草液态发酵生产虫草素是一种较好的方法。作者对蛹虫草产虫草素的液态发酵条件进行了优化,以期提高虫草素的产量,为虫草素的工厂化生产和开发利用提供科学依据。

图1 虫草素的结构式Fig.1 Structure of cordycepin
1 材料与方法
1.1 材料
1.1.1 菌种 蛹虫草Cordyceps militaris JN168,保藏于中国典型培养物保藏中心,保藏号为CCTCC NO:M2011333。
1.1.2 培养基
1)斜面 PDA 培养基(组分 g/L):马铃薯 200,葡萄糖20,琼脂20;pH值自然,121℃灭菌20 min。
2)种子培养基(组分 g/L):葡萄糖 40,酵母膏10,MgSO40.5;pH 值自然,121 ℃灭菌 20 min。
3)发酵培养基(组分 g/L):蔗糖 30,蛋白胨 10;pH值自然,121℃灭菌20 min。
1.2 方法
1.2.1 种子制备 将菌株Cordyceps militaris JN168接种于PDA斜面培养基,25℃光照培养7 d,用无菌水洗下孢子,转入带有玻璃珠的无菌三角瓶中,振荡,充分打散孢子,用4层无菌镜头纸过滤除去菌丝,制成孢子数为106倍的孢子悬液。取制好的孢子悬液,以5%接种体积分数接种于PDA种子培养基中,25℃、200 r/min摇瓶培养3 d,即可获得种子培养液。
1.2.2 液态发酵 取种子培养液,以5%接种体积分数接入发酵培养基中,装液量50 mL,培养温度为25℃,转速为200 r/min,摇瓶培养8 d。
1.2.3 生物量的测定 将得到的发酵原液以8 000 r/min离心20 min,收集湿菌体,用蒸馏水洗涤3次后,置于60℃下恒温干燥至恒质量,用电子天平称质量。
1.2.4 发酵液中虫草素质量浓度的测定 将得到的发酵原液以8 000 r/min离心20 min,取上清液,然后用HPLC法测定上清液中虫草素的质量浓度,测定波长为260 nm,流动相为20%的甲醇。
2 结果与分析
2.1 碳源对Cordyceps militaris JN168菌体生长和产虫草素的影响
基础培养基的配方为发酵培养基,分别以等质量的葡萄糖、果糖、麦芽糖、乳糖、D-半乳糖、甘露糖、山梨糖、可溶性淀粉或马铃薯淀粉来代替基本培养基中的碳源蔗糖,进行不同碳源对Cordyceps militaris JN168菌体生长和产虫草素的影响实验。由表1可知,产虫草素发酵培养基的最佳碳源为葡萄糖;蛹虫草可以很好的利用单糖、二糖,而可溶性淀粉和马铃薯淀粉则不利于菌体的生长。

表1 碳源对Cordyceps militaris JN168菌体生长和产虫草素的影响Table 1 Effect of carbon sources on cell growth and the production of cordycepin
2.2 葡萄糖添加量对Cordyceps militaris JN168菌体生长和产虫草素的影响
用选出的碳源葡萄糖,设置其质量浓度为20、25、30、35、40、45、50、55 g/L, 进行不同质量浓度的葡萄糖对Cordyceps militaris JN168产菌体生长和虫草素的影响实验。由图2可知,葡萄糖质量浓度为40 g/L时虫草素的质量浓度最高,菌体质量浓度达到最高时,葡萄糖的质量浓度为30 g/L。

图2 葡萄糖质量浓度对蛹虫草菌体生长和产虫草素的影响Fig.2 Effect of glucose concentration on cell growth and the production of cordycepin
2.3 氮源对Cordyceps militaris JN168菌体生长和产虫草素的影响
用选出的碳源葡萄糖40 g/L,分别用等氮量的酵母浸粉、蛋白胨、牛肉膏、麦芽汁、酒石酸铵、乙酸铵 、(NH4)2SO4或 NH4NO3为 氮 源 , 进 行 氮 源 对Cordyceps militaris JN168菌体生长和产虫草素的影响实验。由表2可知,有机氮源的效果明显比无机氮源好;以牛肉膏为氮源时,虫草素的产量最高;以蛋白胨、酵母浸粉为氮源时,虫草素的产量次之;以麦芽汁和铵盐为氮源时,虫草素的产量最低;与无机氮源相比,有机氮源更可以满足菌体生长的需要,其中蛋白胨、牛肉膏和酵母浸粉的效果较好。由上述可知,Cordyceps militaris JN168产虫草素发酵培养基的最佳氮源为牛肉膏。

表2 氮源对Cordyceps militaris JN168菌体生长和产虫草素的影响Table 2 Effect of nitrogen sources on cell growth and the production of cordycepin
2.4 牛肉膏添加量对Cordyceps militaris JN168菌体生长和产虫草素的影响
用选出的最佳氮源牛肉膏,设置其质量浓度为5、10、15、20、25、30、35、40 g/L, 进行不同浓度的牛肉膏对Cordyceps militaris JN168菌体生长和产虫草素的影响实验。由图3可以看出,Cordyceps militaris JN168产虫草素的牛肉膏最佳质量浓度为15 g/L,菌体生长的最佳质量浓度为10 g/L。

图3 牛肉膏质量浓度对Cordyceps militaris JN168菌体生长和产虫草素的影响Fig.3 Effect of beef extract concentration on cell growth and the production of cordycepin
2.5 无机盐对Cordyceps militaris JN168菌体生长和产虫草素的影响
以上述优化出的碳源和氮源为基本培养基,在基 本 培 养 基 中 加 入 KCl、MgSO4、K2HPO4、Na2HPO4、CaCl2或NaCl,进行不同无机盐对Cordyceps militaris JN168菌体生长和产虫草素的影响实验。由表3可以看出,在培养基中加入 MgSO4、K2HPO4、CaCl2、Na2HPO4可以促进虫草素的产生,而加入KCl、NaCl 则 抑 制 虫 草 素 的 产 生 ;MgSO4、K2HPO4、CaCl2、Na2HPO4对菌体得生长影响较小,KCl、NaCl抑制菌体的生长。

表3 无机盐对Cordyceps militaris JN168菌体生长和产虫草素的影响Table 3 Effect of inorganic salts on the production of cordycepin and cell growth
2.6 响应面优化实验
依据无机盐单因素实验结果,应用Central Composite Design(CCD)实验原理,对培养基中MgSO4、K2HPO4、CaCl2和 Na2HPO4进行了四因素三水平响应面分析实验[9],试验设计与结果见表4和表5。

表4 响应面分析试验因素水平表Table 4 Factor and levels for response surface analysis

表5 响应面中心组合设计及试验结果Table 5 Response surface central composite design and corresponding experiment results
由此实验的实际值用二次多项式进行回归,其结果见表6。
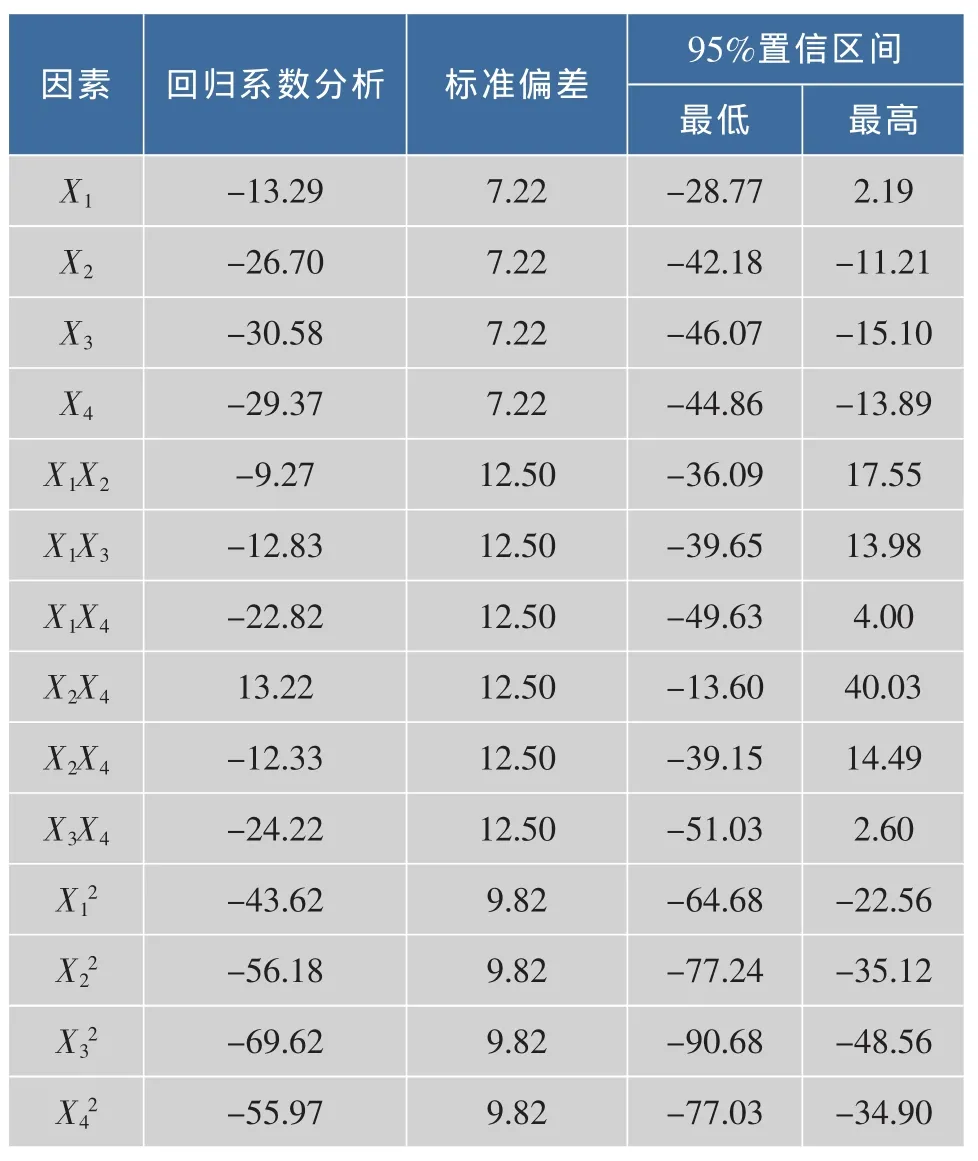
表6 试验结果的回归分析Table 6 Regression analysis of the experiment results
由表6中的回归系数可以写出二次多项式回归方程为:

对该分析方程进行方差分析,方差分析结果见表7。从方差分析中可以看出,模型P<0.05表明该模型是显著的。 同时模型中的参数 X2,X3,X4,X12,X22,X32,X42是显著的(P 值小于 0.05)。 模型失拟项表示预测值与实际值不拟合的概率[10-11]。该模型失拟项的P值为0.0528,表示有5.28%的概率使得模型偏差由噪音产生,因此模型失拟项不显著。模型的相关系数R2为0.915 0,说明了91.50%的响应值是由该模型决定的。R值为0.956 6说明实验中虫草素质量浓度的实际值与模型预测值有95.66%的一致性。由此表明,该模型可对实验结果进行较准确的预测。
利用Design Expert 7.0软件对试验结果进行分析[12],得到培养基中加入的 MgSO4、K2HPO4、CaCl2和Na2HPO4的最适质量浓度分别为 0.76、0.63、0.66、0.67 g/L。在此条件下预测得到的虫草素质量浓度为669.56 mg/L。

表7 二次多项式回归模型的方差分析Table 7 Analysis of variance for quadratic polynomial model
2.7 优化前后Cordyceps militaris JN168菌体生长和产虫草素的情况
优化前的发酵培养基为PDA液体培养基;优化后的发酵培养基为:葡萄糖40 g/L,牛肉膏15 g/L,MgSO40.76 g/L,K2HPO40.63 g/L,CaCl20.66 g/L,Na2HPO40.67 g/L。优化前后 Cordyceps militaris JN168菌体生长和产虫草素的情况见图4、5。和优化前相比,优化后Cordyceps militaris JN168菌体生长及产虫草素有相同的趋势,菌体干重在第4天达到最大,发酵液中虫草素的质量浓度在第8天达到最高,故选择8 d为发酵时间最合适。优化前发酵液中虫草素质量浓度为106.03 mg/L,优化后发酵液中虫草素浓度达到633.47mg/L,是优化前的6倍。

图4 优化前后Cordyceps militaris JN168菌体生长的情况Fig.4 Curves of cell growth before and after optimization

图5 优化前后Cordyceps militaris JN168产虫草素的情况Fig.5 Curves of the production cordycepin before and after optimization
3 结语
随着对虫草素药用活性研究的深入,人们对虫草素的需求逐渐增大,制备大量的虫草素就成了制约虫草素研究和开发的瓶颈。目前虫草素的生产主要有化学合成和生物合成两种方法。化学合成存在很大的缺陷,得率低,合成过程中使用大量有机溶剂(如氯仿等)对环境会造成污染,因此目前应用最多的还是利用虫草属真菌进行生物合成来获得虫草素[13]。其中利用蛹虫草发酵生物合成虫草素具有其它菌种不可比拟的优势,其虫草素合成量要远远高于冬虫夏草等菌株。蛹虫草发酵合成虫草素有寄主培养、固态培养、代料栽培和液体培养等方式,与其他方式相比蛹虫草液态发酵获得虫草素具有培养条件易控制、培养基成分来源广、发酵产物易提取等优点[14],而产量低,发酵时间长是其不可忽略的缺点。国内外主要从培养基质、培养条件和菌种等方面加以优化,从而提高虫草素含量,缩短发酵时间。
通过研究,确定了蛹虫草液态发酵产虫草素的优化条件为:
1)Cordyceps militaris JN168发酵产虫草素最佳培养基配方为葡萄糖40 g/L,牛肉膏15 g/L,MgSO40.76 g/L,K2HPO40.63 g/L,CaCl20.66 g/L,Na2HPO40.67 g/L,发酵时间8 d,此时该菌发酵液虫草素质量浓度达到633.47 mg/L。
2)Cordyceps militaris JN168发酵产虫草素的发酵时间为8 d,与刘艳芳等 (2010),和钟思敏等(2011)报道的28、9 d相比,显著缩短了发酵时间。
[1]林群英,宋斌,李泰辉.蛹虫草研究进展[J].微生物学通报,2006,33(4):154-157.LIN Qun-Ying,SONG Bin,LI Tai-Hui.Advances in the studies on Cordyceps militaris[J].Microbiology,2006,33 (4):154-157.(in Chinese)
[2]薛俊杰,张劲松,刘艳芳.发酵法生产虫草素研究进展[J].食用菌学报,2011,18(3):100-104.XUE Jun-jie,ZHANG Jin-song,LIU Yan-fang.Cordycepin production using fermentation methods-present status and future prospects[J].Acta Edulis Fungi,2011,18(3):100-104.(in Chinese)
[3]夏春雨,孙巍,刘学铭.虫草有效成分的研究进展[J].中国食用菌,2009,28(2):3-7.XIA Chun-yu,SUN Wei,LIU Xue-ming.Research advances on bioactive constituents of Cordyceps[J].Edible Fungi of China,2009,28(2):3-7.(in Chinese)
[4]杨涛,董彩虹.虫草素的研究开发现状与思考[J].菌物学报,2011,30(2):180-190.YANG Tao,DONG Cai-hong.Cordycepin research and exploitation:progress and problems[J].Mycosystema,2011,30(2):180-190.(in Chinese)
[5]李婧.虫草素研究进展[J].美国中华健康杂志,2005,8(3):27-30.LI Jing.Progression or study of cordycepin[J].U S Chinese Health and Hygiene Journal,2005,8(3):27-30.(in Chinese)
[6]毛宁,张丽艳,张凤梅.离子交换树脂分离纯化虫草素的工艺条件研究[J].药物生物技术,2010,17(5):400-403.MAO Ning,ZHANG Li-yan,ZHANG Feng-mei.Study on the technical parameters for extracting and purifying cordycepin with ion exchange resin[J].Chinese Journal of Pharmaceutical Biotechnology,2010,17(5):400-403.(in Chinese)
[7]韦会平,叶小利,张华英.从废弃蛹虫草大米培养基中高效提取纯化虫草素工艺条件研究[J].菌物学报,2009,28(2):220.WEI Hui-ping,YE Xiao-li,ZHANG Hua-ying.An efficient method of extracting and purifying cordycepin from waste rice medium of Cordyceps militaris[J].Mycosystema,2009,28(2):220.(in Chinese)
[8]Masuda M,Urabe E,Sakurai A,et al.Production of cordycepin by surface culture using the medicinal mushroom Cordyceps militaris[J].Enzyme and Microbial Technology,2006,39(4):641-646.
[9]黄雪莲,于新.响应面优化绿色木霉菌培养基[J].食品与生物技术学报,2011,30(5):740-744.HUANG Xue-lian,YU Xin.Optimization of medium of Trichoderma viride using response surface methodology[J].Journal of Food Science and Biotechnology,2011,30(5):740-744.(in Chinese)
[10]Lin X L,Hezari M,Koepp A E,et al.Mechanism of taxadiene synthase,a diterpenecyclase that catalyzes the first step oftaxo biosynthesis in Pacific Yew[J].Biochemistry,1996,35(9):296-2977.
[11]尹腾,陶文沂,缪恒锋,等.响应面法优化超声-微波协同萃取蓝藻中叶绿素a工艺研究[J].食品与生物技术学报,2011,30(3):427-434.YING Teng,TAO Wen-yi,MIAO Heng-feng.Optimization of ultrasonic-microwave coordinative extraction of chlorophyll a from blue algae by response surface methodology[J].Journal of Food Science and Biotechnology,2011,30 (3):427-434.(in Chinese)
[12]魏鹏飞,冯杰,王栋.响应面法优化酱油生产用大曲培养基[J].食品与生物技术学报,2011,30(3):422-426.WEI Peng-fei,FENG Jie,WANG Dong.Optimization of Koji medium in soy sauce production using response surface methodology[J].Journal of Food Science and Biotechnology,2011,30(3):422-426.(in Chinese)
[13]李虎臣,孙平,冯成强.蛹虫草中活性成分虫草素的研究进展[J].井冈山大学学报:自然科学版,2010,31(2):93-96.LI Hu-chen,SUN Ping,FENG Chengqiang.THE research of cordycepin as an active component in cordyceps[J].Journal of Jinggangshan University:Natural Science,2010,31(2):93-96.(in Chinese)
[14]钟思敏,杜梅,陈往滨.蛹虫草菌丝产虫草素液体培养条件的研究[J].菌物学报,2011,30(2):229-234.ZHONG Si-Min,DU Mei,CHEN Wang-Bin.Liquid culture conditions for promoting cordycepin secreted from Cordyceps militaris mycelia[J].Mycosystema,2011,30(2):229-234.(in Chinese)
