白藜芦醇对脂多糖诱导的急性肺损伤的保护作用
2013-01-14陈向军马李杰侯绍杰谢永宏金发光李志超
陈向军 马李杰 侯绍杰谢永宏 金发光 李志超
2710032 陕西西安,第四军医大学病理和病理生理教研室
3710032 陕西西安,第四军医大学口腔医学院材料教研室
陈向军,马李杰,侯绍杰,等.白藜芦醇对脂多糖诱导的急性肺损伤的保护作用[J/CD].中华肺部疾病杂志:电子版,2013,6(1):20-24.
急性肺损伤(acute lung injury,ALI)/急性呼吸 窘迫综合征(acute respiratory distress syndrome,ARDS)是多种因素导致的炎症和抗炎反应失衡、多种炎症因子参与的复杂的病理过程,确切发病机制不明,缺乏特异有效治疗药物,是其临床病死率极高的主要原因[1-3]。因此,探讨和寻找治疗其有效药物的研究尤为重要。
白藜芦醇(resveratrol)是非黄酮类的多酚化合物,化学名是(E)-3,5,4'-三羟基二苯乙烯[(E)-3,5,4'-trihydorxystilbene],最初被发现是作为一种植物抗毒素,现被医学界广泛重视。白藜芦醇的药理作用较为广泛,例如用来治疗博来霉素诱导的肺纤维化,抑制肿瘤细胞的生长和肺部炎症[4-6]。而白藜芦醇是否可用于防治ALI/ARDS,并且其可能的机制是什么还有待于更进一步的研究。
材料与方法
一、试剂和仪器
脂多糖(LPS O55:B5),白藜芦醇(Purity>98%)购于Sigma(美国)公司。Real-time PCR试剂盒(TaKaRa,日本),RNA 提取试剂盒(TaKaRa,日本),ELISA 检测试剂盒(R&B Systems,美国),Realtime PCR仪(Biored icycler iQ,美国)
二、实验方法
1.模型复制:健康,雄性小白鼠60只,BAL B/c,18~22 g,第四军医大学实验动物中心提供,完全随机化原则分组为:对照组(control)、白藜芦醇组(resveratrol)、LPS组、白藜芦醇预防组(resveratrol+LPS),每组15只。白藜芦醇组和白藜芦醇预防组用白藜芦醇溶液(40 mg/kg)灌胃。用3%戊巴比妥钠腹腔内注射麻醉。仰卧位固定于手术台上,颈部消毒皮肤,分离气管,用微量注射器将 LPS(5 mg/kg)缓慢滴入气管内。将小鼠正立轻轻摇晃,缝合皮肤。
2.细胞培养:NR8383细胞本实验室冻存,复苏后在10%FBS、100 U/ml青霉素和100 U/ml链霉素的F12培养基中放入培养箱中培养。培养箱条件:37℃ 5%CO2待细胞生长状态良好且完全长满培养瓶时,用0.25%胰酶进行传代。再次传代时进行分组处理。分为对照组(control组)、白藜芦醇组(resveratrol组)、LPS组、白藜芦醇预防组(resveratrol+LPS组)。
3.肺组织病理检测:动物处死取肺组织,将左肺的一叶肺组织迅速放入4%多聚甲醛中4℃固定24 h~48 h,然后用石蜡包埋。制做5 μm厚的切片,HE染色,光学显微镜下观察肺组织病理学改变。
4.肺水肿参数的检测:实验结束时称量小鼠体重,放血处死动物迅速剥离右肺(n=8),用吸水纸吸干表面水分和血液,称量肺湿重,57℃烤箱内将肺烘干至质量恒重,再称量。计算得出肺湿干比(W/D)和右肺/体重之比(R/B)。以此来反映肺水肿的程度。
5.肺组织匀浆中TNF-α、IL-6、硫氧还蛋白1蛋白的表达:采用ELISA方法检测肺组织匀浆中TNF-α、IL-6、硫氧还蛋白1的含量。取肺组织约100 mg,用 0.01 mmol/L PBS(pH 7.4)0.1 ml用匀浆器匀浆后,4℃ 12 000r/min离心20 min,收集上清,按试剂盒说明书要求操作,显色后酶标仪读数。
6.硫氧还蛋白1 mRNA的表达:取肺组织和收集的NR8383细胞放入Trizol,常规提取总 RNA,紫外风光光度计检测浓度。取1 μg总RNA用反转试剂盒将RNA反转成为cDNA。按Real-time PCR试剂盒要求加入试剂将其放入PRC仪中进行反应。95℃变性2 min,第二步 95℃变性10 s,退火60℃30 s,70℃延伸45 s的循环,共40次。小鼠肺组织引物序列:Thioredoxin1(Mouse)Sense5’-TGCTACGTGGTGTGGACCTTGC-3’,Antisense:5 ’-ACCGGAGAACTCCCCCACCT-3’NR8383细胞中引物 序 列:Thioredoxin1 (Rat) Sense 5’-CTCAGCCACGTGGTGTGGGC-3’Antisense 5 ’-TGGCGTGCATTTGACTTCACACTC-3’
7.细胞活力检测:取对数生长期的NR8383细胞,分别以5×104接种于96孔板,待生长密度达到70%~80%时改换为无血清培养液。分别在白藜芦醇组和白藜芦醇预防组先加入白藜芦醇终浓度10 μg/ml、50 μg/ml、100 μg/ml,2 h 后再在 LPS 组和白藜芦醇预防组加入LPS终浓度1 μg/ml。培养箱内孵育结束后加入MTT,每孔200 μl培养基加入20 μlMTT(5 mg/ml),培养箱内继续孵育4 h。吸出培养液,每孔加入100 μl DMSO,室温下摇床10 min使结晶物充分溶解。选择在490 nm波长用酶标仪测定,记录每孔的数值并计算。得出实验数据做柱状图。
三、统计学方法
结 果
一、白藜芦醇对肺组织病理的影响
肺组织病理学显示,对照组和白藜芦醇组肺泡结构清晰,肺泡腔内没有渗出,肺泡壁无增厚(图1A-B)。LPS组显示肺组织水肿,并有点片状出血,大量炎细胞浸润,肺泡壁明显增厚,伴有肺不张和肺实变(图1C)。在白藜芦醇预防组可见肺泡结构趋于正常,炎症渗出减少,肺不张和肺实变情况较LPS组减轻(图1D)。
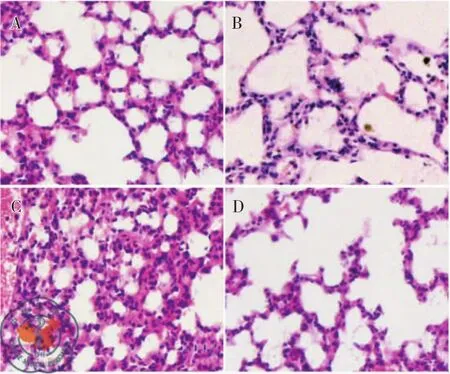
图1 各组小鼠肺组织HE染色的病理改变
二、白藜芦醇对肺组织W/D和R/B的影响
与对照组相比,LPS损伤组W/D和R/B显著增高(P<0.05),白藜芦醇预防组的 W/D和 R/B显著低于LPS损伤组(P<0.05),白藜芦醇组与对照组没有明显差异,说明单独用白藜芦醇处理对肺组织无影响,见表1。
表1 白藜芦醇对肺水肿指标的影响(±s)

表1 白藜芦醇对肺水肿指标的影响(±s)
aP<0.05 vs.Control group;bP<0.05 vs.LPS group.
Group n W/D(mg·mg-1) R/B(mg·g-1)Control 15 4.55 ±0.21 3.25 ±0.19 Resveratrol 15 4.61 ±0.19 3.52 ±0.21 LPS 15 5.06 ±0.33a 4.02 ±0.29a Resveratrol+LPS 15 4.68 ±0.28b 3.60 ±0.23b
三、白藜芦醇对TNF-α、IL-6的影响
LPS损伤6 h后与对照组相比,TNF-α、IL-6水平显著增高(P<0.05),Resveratrol+LPS组与 LPS组相比 TNF-α、IL-6的产量显著减少(P<0.05),见表2。
表2 肺组织匀浆中TNF-α、IL-6 ELISA检测结果(±s)
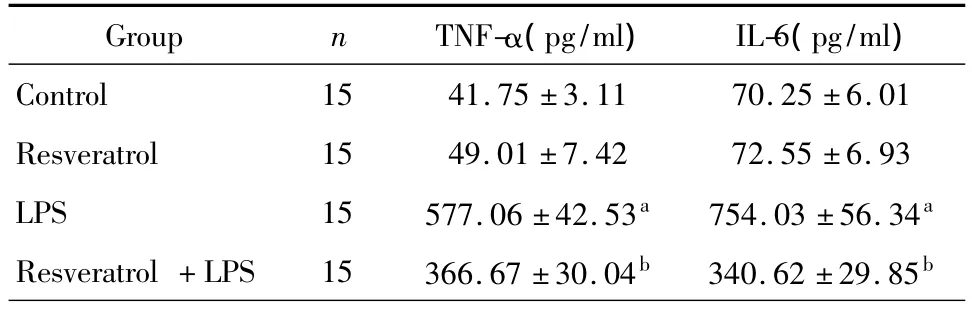
表2 肺组织匀浆中TNF-α、IL-6 ELISA检测结果(±s)
aP<0.05 vs.Control group;bP<0.05 vs.LPS group.
Group n TNF-α(pg/ml) IL-6(pg/ml)Control 15 41.75 ±3.11 70.25 ±6.01 Resveratrol 15 49.01 ±7.42 72.55 ±6.93 LPS 15 577.06 ±42.53a 754.03 ±56.34a Resveratrol+LPS 15 366.67 ±30.04b 340.62 ±29.85b
四、白藜芦醇对细胞活力的影响
用MTT检测反应白藜芦醇对细胞活力的影响,发现LPS组与对照组比较,细胞活力明显下降(P<0.05)。Resveratrol 50 μg/ml和 100 μg/ml可以明显提高LPS处理过的细胞活力(P<0.05)。对照组与单独Resveratrol处理组对比,MTT没有明显的变化(图2)。

图2 NR8383细胞的MTT含量
五、白藜芦醇对硫氧还蛋白mRNA的影响
采用Real-time PCR方法检测肺组织和NR8383细胞中的硫氧还蛋白1的含量,结果显示LPS组比Control组的硫氧还蛋白1的mRNA含量明显减少。白藜芦醇预防组较LPS组的硫氧还蛋白1的mRNA表达明显增加(P<0.05),见表3。
表3 白藜芦醇对硫氧还蛋白1在肺组织和NR8383细胞中表达的影响(±s)

表3 白藜芦醇对硫氧还蛋白1在肺组织和NR8383细胞中表达的影响(±s)
注:Control组与LPS比较aP<0.05;Resveratrol+LPS组与 LPS组比较;bP<0.05
Group n Lung NR8383 Control 15 1.00 ±0.11 1.00 ±0.12 Resveratrol 15 0.91 ±0.08 0.93 ±0.09 LPS 15 0.52 ±0.09a 0.48 ±0.05a Resveratrol+LPS 15 1.82 ±0.13b 1.93 ±0.27b
五、白藜芦醇对肺组织匀浆和细胞匀浆中硫氧还蛋白蛋白含量的影响
采用ELISA方法分别检测检测肺组织匀浆和NR8383细胞中的硫氧还蛋白1的蛋白含量,结果显示LPS组比Control组的硫氧还蛋白1的蛋白含量明显减少。白藜芦醇预防组较LPS组的硫氧还蛋白1的蛋白表达明显增加(P<0.05),见表4。
表4 ELISA检测Trx1在肺组织和NR8383细胞中蛋白含量(±s)
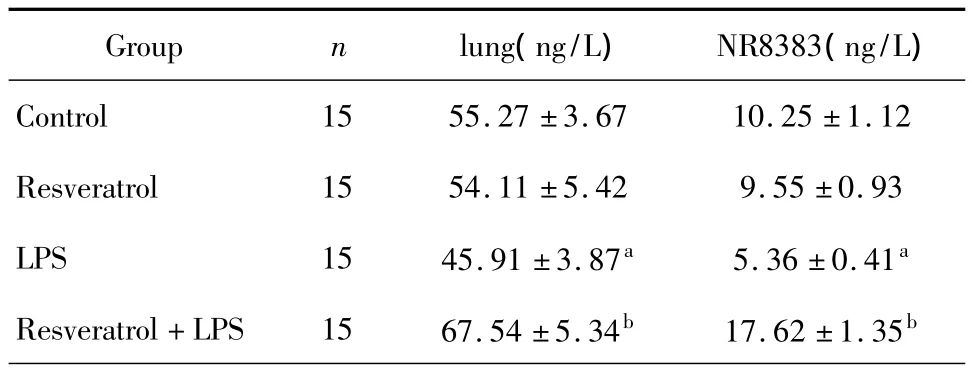
表4 ELISA检测Trx1在肺组织和NR8383细胞中蛋白含量(±s)
aP<0.05 vs.Control group;bP<0.05 vs.LPS group.
Group n lung(ng/L) NR8383(ng/L)Control 15 55.27 ±3.67 10.25 ±1.12 Resveratrol 15 54.11 ±5.42 9.55 ±0.93 LPS 15 45.91 ±3.87a 5.36 ±0.41a Resveratrol+LPS 15 67.54 ±5.34b 17.62 ±1.35b
讨 论
本实验中,首先观察到气管内滴注LPS 6 h后肺组织明显损伤,显示肺泡壁明显增厚,肺泡腔狭窄、大量炎性细胞浸润、肺泡水肿、肺不张,而用白藜芦醇处理可以明显减轻LPS导致的肺组织结构的损伤,减轻肺部炎症和淤血情况。其次白藜芦醇处理过的LPS组的肺水肿指标也明显低于LPS损伤组,肺水肿参数得到改善。这些结果表明Resveratrol在整体水平减轻了气管内滴注LPS引起的ALI。
ALI/ARDS的发生机制和过程复杂而广泛。ALI是多种因素造成的炎症反应失调,内毒素可以作为主要的致病因素引起ALI[7]。整体水平和细胞水平结果说明,LPS分别在5 mg/kg和1 μg/ml可以引起促炎细胞因子释放,导致小鼠急性肺损伤和细胞活力的下降。当核转录因子受到外源性刺激后活化转向细胞核内,并与TNF-α、IL-6等炎症因子基因启动子区的反应元件结合,启动转录与表达,使炎症因子TNF-α、IL-6产生过多,从而导致更严重的组织损伤、结构破坏[8]。在我们的实验中观察到,白藜芦醇处理后可明显减轻肺组织的炎症,促炎细胞因子TNF-α、IL-6也明显减少,此外白藜芦醇还可显著提高细胞活力。
近年来也有研究发现,白藜芦醇在治疗哮喘、慢性阻塞性肺疾病等肺部疾病中有较广泛的应用前景[9]。白藜芦醇在抗氧化和抗炎的作用机制中均起到至关重要的作用。白藜芦醇在慢性阻塞性肺疾病中通过抑制p38MAPK信号通路、减少ROS发挥抗氧化的作用,从而减轻肺部的炎症反应[8]。在我们的实验中观察到:白藜芦醇处理后使LPS诱导的Thioredoxin1在mRNA和蛋白水平明显增加。目前也有报道,通过表达Thioredoxin1具有调节NF-κB和抗氧化的双重特性[10]。Thioredoxin1 是thioredoxin家族的一种重要的小分子蛋白,相对分子量为12×103[11]。它可以利用自身的双硫键进行蛋白的氧化和还原,从而发挥其氧化还原和清除氧化应激产生的毒性产物的作用[12]。此外,在慢性间歇性低氧小鼠模型内重组的Trx1可以有效降低TNF-α 和 HIF-1 的表达[13]。在白藜芦醇提高Thioredoxin1的同时也降低了TNF-α、IL-6的产量,提示白藜芦醇的抗炎作用可能与Thioredoxin1有关。
总之,本实验研究成功复制了LPS气管内滴注构建的ALI模型。并证实白藜芦醇可减轻肺水肿、减少TNF-α、IL-6的含量,在减轻肺部炎症细胞浸润的同时可保护肺组织结构完整性。白藜芦醇增加Trx1的mRNA和蛋白含量可能是其减轻急性肺损伤的机制之一。本研究结果为治疗急性肺损伤开拓了新的思路,同时也为白藜芦醇的临床应用奠定了理论基础。
1 Wijagkanalan W,Kawakami S,Higuchi Y,et al.Intratracheally instilled mannosylated cationic liposome/NFkappaB decoy complexes for effective prevention of LPS-induced lung inflammation[J].J Control Release,2011,149(1):42-50.
2 Zhou MT,Chen CS,Chen BC,et al.Acute lung injury and ARDS in acute pancreatitis:mechanisms and potential intervention[J].World J Gastroenterol,2010,16(17):2094-2099.
3 Xie JY,Di HY,Li H,et al.Bupleurum chinense DC polysaccharides attenuates lipopolysaccharide-induced acute lung injury in mice[J].Phytomedicine,2012,19(2):130-137.
4 王在岩,张 平,何平平,等.白藜芦醇对博莱霉素致大鼠肺纤维化和 NF-κBmRNA的影响[J].临床肺科杂志,2011,16(9):1315-1317.
5 李济元,王卫华,张彦梅,等.白藜芦醇对肺腺癌细胞增殖和CXCR4表达的影响[J].中国药理学通报,2012,28(4):588-589.
6 金婉冰.白藜芦醇对脂多糖诱导的小鼠重症肺炎的保护作用[J].中国临床药理学与治疗学,2011,16(12):1352-1356.
7 Mittal N,Sanyal S N.Cycloxygenase inhibition enhances the effects of surfactant therapy in endotoxin-induced rat model of ARDS[J].Inflammation,2011,34(2):92-98.
8 王建春,姜 鹏,谢艳萍,等.急性肺损伤大鼠肺组织NF-κB表达的研究[J].中国现代医学杂志,2006,16(16):2448-2452.
9 张明灯,邓毅书.白藜芦醇在慢性阻塞性肺疾病中的抗氧化作用[J].临床肺科杂志,2012,17(9):1669-1672.
10 Psarra AM,Hermann S,Panayotou G,et al.Interaction of mitochondrial thioredoxin with glucocorticoid receptor and NF-kappaB modulates glucocorticoid receptor and NF-kappaB signalling in HEK-293 cells[J].Biochem J,2009,422(3):521-531.
11 Turanov AA,Kehr S,Marino SM,et al.Mammalian thioredoxin reductase 1:roles in redox homoeostasis and characterization of cellular targets[J].Biochem J,2010,430(2):285-293.
12 Hansen JM,Zhang H,Jones DP.Differential oxidation of thioredoxin-1,thioredoxin-2,and glutathione by metal ions[J].Free Radic Biol Med,2006,40(1):138-145.
13 顾 洁,陈小东.重组人硫氧还蛋白可降低间歇性低氧小鼠胸主动脉外膜低氧诱导因子1和肿瘤坏死因子α的表达[J].国际呼吸杂志,2011,31(15):1153-1156.
