IL-15对树突状细胞激活的T淋巴细胞免疫反应的作用观察
2013-01-07彭晶晶周进军付曾强
赵 煜 张 涛 谭 勇 彭晶晶 周进军 许 涛 付曾强
手术、化疗和放疗是传统的三大肿瘤治疗手段,生物治疗以其独特的优势在肿瘤治疗中也占有一席之地,而免疫治疗是肿瘤生物治疗的核心。正常情况下,人体以细胞免疫为主发挥着抗肿瘤的作用,而在人体免疫功能作用下仍能发生肿瘤,其原因可能与肿瘤逃避机体免疫监视,使机体不能有效的递呈肿瘤抗原,以致不能有效活化细胞毒性T细胞(cytotoxic T lymphocyte,CTL)有关[1]。DC是机体功能最强的抗原递呈细胞(antigen presenting cells,APCs),能高效地摄取、加工处理和递呈抗原。细胞因子对DC的发育、成熟及免疫功能的发挥至关重要。许多细胞因子:IL-2、IL-12、粒-巨噬细胞集落刺激因子(granulocyte-macrophage colony stimulating factor,GM-CSF)等作为DC的免疫佐剂,使其诱导的T细胞反应得以增强。IL-15是一种新近发现的细胞因子,具有与IL-2类似的激活T、B细胞和NK细胞的作用[2-4]。本研究以IL-2为对照,观察IL-15对DC疫苗诱导的T淋巴细胞免疫反应的作用。
1 材料与方法
1.1 材料
IL-15购自英国Peprotech公司。IL-2、IL-4、PE-Cy5-CD8 mAb、PE-CD44 mAb、PE-CD62L mAb、PE-CD69 mAb购自美国eBioscience公司。GM-CSF购自美国R&D公司。脂多糖(LPS)购自美国Sigma公司。ELISPOT试剂盒购自瑞士Mabtech公司。C57BL/6小鼠,雌性,6~8周龄购自四川大学实验动物中心。Levis肺癌细胞株由本实验室保种储存。
1.2 方法
1.2.1 冻融法制备Levis细胞抗原 取对数生长期的Levis细胞,用PBS重悬肿瘤细胞为2×107/mL。置于液氮10 min后放于37℃水浴中融化,反复4个循环。离心取上清即制成含Levis细胞的肿瘤细胞裂解液,置-80℃冰箱冻存备用。
1.2.2 小鼠骨髓DC(BMDCs)的制备及培养 无菌取小鼠股骨和胫骨,用注射器吸取RPMI 1640培养基冲洗髓腔,冲洗液离心后弃上清。用红细胞裂解液裂解红细胞,离心后弃上清。用含5%FCS、1 000 U/mL GM-CSF、500U/mL IL-4的RPMI 1640培养基调整细胞浓度为6×105/mL,加入6孔板中(1.8×106/孔)培养。第8天加入含2×107/孔肿瘤细胞裂解液0.1 mL,培养4 h后加入0.1 mL脂多糖(lipopolysaccharide,LPS)混匀诱导细胞成熟。
1.2.3 小鼠脾脏T淋巴细胞的制备及培养 无菌取小鼠脾脏,注射器芯研磨脾脏滤过200目钢网,加红细胞裂解液裂解红细胞后,用3 mL RPMI 1640培养基重悬置孵箱备用。将尼龙毛柱加入37℃的无血清RPMI 1640培养基,置于37℃孵箱中1h平衡柱子,取出尼龙毛柱加入脾细胞悬液3 mL,37℃孵育45 min。加入20 mL预热为37℃的RPMI 1640培养基,以1滴/s的速度洗柱收集滤过液,得到脾脏T淋巴细胞悬液,调整细胞浓度为3×106/mL。
1.2.4 淋巴细胞免疫表型测定 采用流式细胞术直接免疫荧光标记法检测淋巴细胞免疫表型。分别收集培养第3、7、14天的各组(IL-2、IL-15)T淋巴细胞,调整细胞浓度为1×106/mL,吸取l mL用PBS洗涤后,加入60 μL PBS缓冲液及各(PE-Cy5-CD8、PE-CD44、PE-CD62L、PE-CD69)单克隆抗体(mAb)40 μL,室温避光孵育40 min。每组共设3个复孔,PBS洗涤后行流式细胞仪检测。
1.2.5 肿瘤抗原负载BMDCs诱导的T细胞对肿瘤细胞杀伤活性的分析 无菌取健康小鼠的脾脏淋巴细胞,制备T淋巴细胞悬液。调整T淋巴细胞浓度为1×106/mL,于6孔板中加入600 μL/孔细胞悬液。肿瘤抗原负载的BMDCs用RPMI 1640培养基调整细胞浓度为1×105/mL,于置有T淋巴细胞的6孔板中加入300 μL/孔细胞悬液,补足培养基为3 mL,每组分别加入10 ng/mL IL-2、125 ng/mL IL-15孵箱孵育。7 d后收集悬浮细胞,以含10%FCS的RPMI 1640培养基稀释作为效应细胞备用。取l mL浓度为3×106/mL的Levis细胞为靶细胞,加入100Ci Na51CrO4混匀后置于孵箱孵育2 h。Hanks液洗涤3次后用RPMI 1640培养基重悬并调整细胞浓度为1×106/mL。将各效应细胞与靶细胞按照效靶比(E∶T)为160∶l、80∶1、40∶1、20∶1加入到96孔U型板中,各设3个复孔。同时设最大释放组(100 μL靶细胞、100 μL破膜剂1%triton-X100),最小释放组(100 μL靶细胞、100 μL RPMI 1640培养基)于孵箱孵育4 h。离心后收集上清100 μL于专用试管中。用γ记数器测定每管上清液的51Cr释放量。51Cr释放率=(样本释放cpm平均值-最小释放cpm平均值)/(最大释放cpm平均值-最小释放cpm平均值)×100%。
1.2.6 IFN-γ分泌细胞的检测 实验操作步骤按照ELISPPOT试剂盒说明书操作。调整效应细胞浓度为1×106/mL,于96孔培养板中加入100 μL/孔细胞悬液,各设3个复孔,孵育时间为24 h。将ELISPPOT板置于解剖显微镜下(×40),记录黑紫色斑点,拍照。行统计学分析。
1.3 统计学分析
采用SPSS 17.0统计软件进行分析,组间比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 IL-15或IL-2对T淋巴细胞免疫表型的影响
为研究IL-15或IL-2联合DC疫苗对T淋巴细胞免疫表型的影响,本研究对激活的T淋巴细胞采用流式细胞术分析了CD8+T细胞的表型特征,如CD69、CD62L、CD44。采用不同浓度的IL-2(5、10、20或40 ng/mL),IL-15(25、125、250或 500 ng/mL)培养淋巴细胞,以3、7和14d为时间梯度检测淋巴细胞免疫表型。结果提示:在第7天时,10 ng/mL IL-2或125 ng/mL IL-15上调CD8+T细胞表达CD69、CD44分子情况较好,同时下调CD62L分子情况亦较好。本实验选取第7天时,以10 ng/mL IL-2和125 ng/mL IL-15的条件检测T淋巴细胞的杀伤活性和分泌IFN-γ的细胞数量(图1)。
2.2 肿瘤抗原负载BMDCs诱导的T细胞对肿瘤细胞杀伤活性的影响
为了观察激活的T淋巴细胞对特异性抗原肿瘤细胞的杀伤作用,本研究采用51Cr释放法检测T淋巴细胞的杀伤活性。结果表明,在联合DC疫苗的情况下,IL-15或IL-2作为免疫佐剂对靶细胞的杀伤活性无显著差别,但两者均显著高于对照组(图2)。
图1 流式细胞术分析CD8+T细胞的表型特征Figure1 Phenotypic characteristics of CD8+T-cell populations analyzed by flow cytometry

图2 T淋巴细胞对肿瘤细胞杀伤活性的分析Figure2 Cytotoxic T lymphocyte-mediated cytotoxicity assay after stimulation with BMDCs
2.3 分泌IFN-γ细胞数量的检测
为研究IL-15或IL-2对淋巴细胞免疫反应的影响,本研究取健康小鼠脾脏制备T淋巴细胞,将DC疫苗与T淋巴细胞混合培养,同时分别加入10 ng/mL IL-2或125 ng/mL IL-15,7d后收集培养的细胞行ELISPOT实验,检测分泌IFN-γ的细胞数量。结果显示,经DC疫苗刺激后,用含IL-15的培养基培养,每10万个细胞约有50个IFN-γ分泌细胞;而用含IL-2培养基培养,每10万个细胞约有30个IFN-γ分泌细胞,有显著性差异(P<0.05)。为了排除细胞因子的非特异性刺激作用,本研究采用无DC疫苗的IL-15或IL-2为对照,在无DC疫苗的刺激下,仅有IL-15或IL-2较难刺激淋巴细胞分泌IFN-γ(图3)。
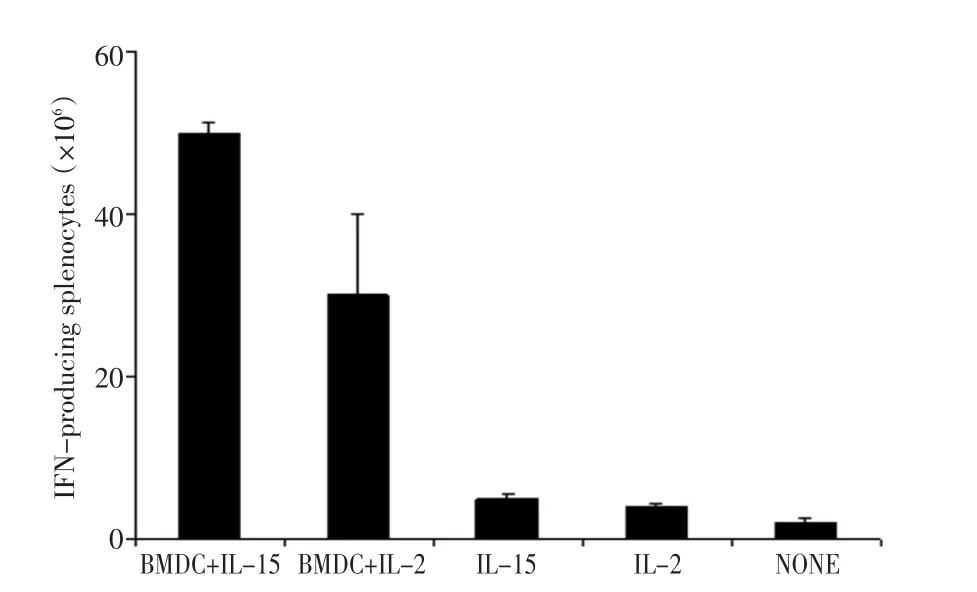
图3 分泌IFN-γ细胞数量的检测Figure3 Number of IFN-γ secreting cells after stimulation with BMDCs
3 讨论
DC递呈抗原的能力远强于B淋巴细胞、巨噬细胞等其他APCs,其能诱导CTL的抗肿瘤免疫反应[5],同时也是细胞免疫应答的启动者,可以活化初始T细胞。DC与肿瘤的发生、发展有着密切关系。肿瘤患者体内的DC数量和功能都有所下降,从而使T细胞介导的免疫应答不能被有效的激活[6]。因此如何改善和提高DC诱发的免疫反应,是肿瘤免疫学研究的热点。
IL-2常作为DC的免疫佐剂使其诱导的T细胞反应得以增强,而IL-15在抗肿瘤免疫治疗方面的应用也得到了研究者的关注,其具备一些IL-2不具备的优势,如IL-15能激活和扩增CD8+T细胞[7-8];不激活调节性T淋巴细胞(regulatory T cells,Tregs),并解除Tregs对T细胞的抑制作用,而Tregs对免疫的各个方面都有负调节作用[9-12];IL-15不会引起激活诱导的细胞死亡(activation-induced cell death,AICD)。而IL-2却抑制记忆性T细胞在体内的生存,激活并维持Tregs的活性和功能,而且能诱导AICD[13]。
本研究显示,初始T淋巴细胞在体外经DC疫苗刺激后,用IL-15或IL-2均能刺激IFN-γ的分泌,并维持和扩增抗原特异性CTL。虽然IL-15较IL-2能刺激更多的IFN-γ分泌细胞产生,但在特异性杀伤活性方面并未显示出优势,这可能与初次免疫反应较弱,刺激时间不够长有关。
IL-15作为一种新近发现的细胞因子,在三级结构上与IL-2相似,两者都属于4-螺旋的造血因子家族。IL-15受体(IL-15R)与IL-2受体(IL-2R)相似,均包含3条链,分别命名为IL-15Rα、β、γ,其中β和γ亚单位与IL-2的β和γ亚单位相同;同时两种细胞因子的信号转导通路都包含蛋白酪氨酸激酶(janus kinase,JAK)和信号传导及转录激活因子(signal transducer and activator of transcription,STAT)[14]。正因这两种细胞因子的受体具有相同的β、γ亚单位和信号转导分子,可以解释本研究观察到的IL-15与IL-2具有刺激T淋巴细胞增殖,维持T淋巴细胞活性的作用。
而IL-15Rα与IL-2Rα不同,IL-15Rα在机体的表达更为广泛,主要在激活的单核细胞、DC及基质细胞表达。而IL-2Rα主要由激活的T细胞和B细胞表达,IL-2Rα又名CD25,是Treg细胞的表型标记,部分经IL-2激活的淋巴细胞可能会转换成Treg细胞,限制免疫反应的进一步进行。
IL-2促使T-B细胞或T-T细胞之间的FasL(CD95L)和Fas(CD95)相结合,启动活化诱导的细胞死亡,是CTL和NK细胞杀伤的机制之一,同时也可杀伤活化的T、B细胞,下调细胞免疫和体液免疫。虽然IL-2是一个强的淋巴细胞增殖刺激因子,但是长期大量的使用反而可能会通过以上这些机制限制免疫反应的进行。而目前未发现IL-15下调细胞免疫和体液免疫。
鉴于以上分析,在抗肿瘤免疫治疗中,本研究认为IL-15可能是较IL-2更好的免疫佐剂,进一步的体内抗肿瘤免疫动物实验研究是今后拟进行的工作。
1 Dermime S,Gilham DE,Shaw DM,et al.Vaccine and antibody-directed T cell tumor immunotherapy[J].Biochim Biophys Acta,2004,1704(1):11-35.
2 Qian L,Zhang Y,Pan XY,et al.IL-15,in synergy with RAE-1ε,stimulates TCR-independent proliferation and activation of CD8(+)T cells[J].Oncol Lett,2012,3(2):472-476.
3 Tamang DL,Redelman D,Alves BN,et al.Induction of granzyme B and T cell cytotoxic capacity by IL-2 or IL-15 without antigens:multiclonal responses that are extremely lytic if triggered and short-lived after cytokine withdrawal[J].Cytokine,2006,36(3-4):148-159.
4 Popmihajlov Z,Xu D,Morgan H,et al.Conditional IL-2 gene deletion:consequences for T cell proliferation[J].Front Immunol,2012,3:102.
5 Mayordomo JI,Zorina T,Storkus WJ,et al.Bone marrow-derived dendritic cells pulsed with synthetic tumour peptides elicit protective and therapeutic antitumour immunity[J].Nat Med,1995,1(12):1297-1302.
6 Liu JY,Wu Y,Zhang XS,et al.Single administration of low dose cyclophosphamide augments the antitumor effect of dendritic cell vaccine[J].Cancer Immunol Immunother,2007,56(10):1597-1604.
7 Alenzi FQ,Alenazi FA,Al-Kaabi Y,et al.The use of growth factors to modulate the activities of antigen-specific CD8+T cells in vitro[J].J Med Life,2011,4(4):399-406.
8 Castro I,Yu A,Dee MJ,et al.The basis of distinctive IL-2-and IL-15-dependent signaling:weak CD122-dependent signaling favors CD8+T central-memory cell survival but not T effector-memory cell development[J].J Immunol,2011,187(10):5170-5182.
9 Ben Ahmed M,Belhadj Hmida N,Moes N,et al.IL-15 renders conventional lymphocytes resistant to suppressive functions of regulatory T cells through activation of the phosphatidylinositol 3-kinase pathway[J].J Immunol,2009,182(11):6763-6770.
10 Van Belle TL,Dooms H,Boonefaes T,et al.IL-15 augments TCR-induced CD4+T cell expansion in vitro by inhibiting the suppressive function of CD25 High CD4+T cells[J].PLoS One,2012,7(9):e45299.
11 Ahmadzadeh M,Rosenberg SA.IL-2 administration increases CD4+CD25(hi)Foxp3+regulatory T cells in cancer patients[J].Blood,2006,107(6):2409-2414.
12 Grigoriadis G,Vasanthakumar A,Banerjee A,et al.c-Rel controls multiple discrete steps in the thymic development of Foxp3+CD4 regulatory T cells[J].PLoS One,2011,6(10):e26851.
13 Waldmann TA.The biology of interleukin-2 and interleukin-15:implications for cancer therapy and vaccine design[J].Nat Rev Immunol,2006,6(8):595-601.
14 Betts BC,Abdel-Wahab O,Curran SA,et al.Janus kinase-2 inhibition induces durable tolerance to alloantigen by human dendritic cell-stimulated T cells yet preserves immunity to recall antigen[J].Blood,2011,118(19):5330-5339.
