农杆菌介导转化巨桉Eg5影响因素的研究
2012-12-27郭利军曾炳山李湘阳裘珍飞
郭利军,曾炳山,刘 英,李湘阳,裘珍飞
(中国林业科学研究院 热带林业研究所,广东 广州 510520)
农杆菌介导转化巨桉Eg5影响因素的研究
郭利军,曾炳山,刘 英,李湘阳,裘珍飞
(中国林业科学研究院 热带林业研究所,广东 广州 510520)
以巨桉无性系Eg5叶片为外植体材料,以GUS瞬时表达率和瞬时表达率指数作为评价指标,主要探讨了预培养时间、菌液浓度、侵染时间、共培养基pH、共培养时间和乙酰丁香酮(Acetosyringone,AS)对遗传转化的影响,结果表明预培养3 d、菌液浓度OD600nm为0.5、接种30~60 min、共培养基pH值为5.8~6.0、共培养基中添加150 mg·L-1AS、菌液中不添加AS、共培养1 d遗传转化效果最佳,初步建立了巨桉Eg5的遗传转化体系。
巨桉;农杆菌;Eg5;遗传转化
Eg5是优良的巨桉Euclyptus grandis W.Hill ex Maiden无性系,具有速生、干形通直、分枝角度小、出材率高等特点,在我国江西南部、湖南南部、福建中部等南亚热带地区已广泛栽培,但巨桉Eg5也存在青枯病抗性较低、抗寒能力不足等问题。通过根癌农杆菌介导的遗传转化可以将抗病、抗寒等目的基因转入巨桉基因组中,将大大改善上述不良性状。本文系统研究了影响农杆菌介导转化巨桉Eg5的多个因素,旨在建立巨桉的遗传转化体系,为巨桉的转基因育种研究奠定基础。
1 材料与方法
1.1 试验材料
以生根培养45 d左右的Eg5无菌生根苗为试验材料,选取顶端完全展开的1~4片带叶柄的叶片为外植体,剪去占全叶1/3长度的叶尖部分。
1.2 基本培养基及培养条件
农杆菌培养基为LB培养基,pH 7.0;预培养和共培养培养基为改良MS+TDZ0.12 mg·L-1+NAA0.25 mg·L-1+蔗糖30 g·L-1+琼脂6 g·L-1,pH 5.8;培养基在0.11 MPa压力下,121℃灭菌17 min后冷却待用。
1.3 农杆菌菌株及质粒
菌株为华南农业大学提供的农杆菌菌株GV3101含有载体质粒pBI121,该质粒携带有CaMV35S启动子、NOS终止子、NPTⅡ基因和GUS基因。
1.4 农杆菌工程菌液的制备
取-75℃冻存的根癌农杆菌菌株GV3101,在冰上解冻后划平板活化培养3 d。挑取单菌落于4 ml液体LB培养基中180 rpm过夜培养,当菌液OD600nm值达到0.2后,按照1∶40比例接入新鲜LB液体培养基,培养至所需OD600nm值,4 000 rpm离心8 min,再用等量的液体再生培养基重悬菌体备用。
1.3 试验方法
1.3.1 基本转化条件
农杆菌采用GV3101,将修剪好的叶片外植体于黑暗条件下预培养3 d,菌液浓度OD600nm值0.5时侵染10 min,取出外植体于黑暗条件下共培养2 d。采用逐步优化的方法进行试验,每一步骤得到的结果将应用到下一步的转化实验中[1]。
1.3.2 转化条件的优化
预培养时间试验设置为0、3、6、9、12、15 d 6种处理;菌液浓度试验设置OD600nm值0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8 共 8 种 处理;接种时间试验设置为10、20、30、40、50、60 min 6 种处理;共培养基pH值试验设置为5.0、5.2、5.4、5.6、5.8、6.0、6.2共7种处理;菌液中添加乙酰丁香酮试验设置为:0、45、90、135、180 mg·L-1共5种处理;共培养基中添加乙酰丁香酮试验设置为:0、50、100、150、200 mg·L-1共5种处理。
1.3.3 试验重复
所有试验每处理重复3次,每个重复外植体20~30个。
1.3.4 GUS染色分析
参照Jefferson R.A的GUS组织化学染色法[2],共培养结束后对叶片外植体进行GUS染色。
1.3.5 转化效果评价指标
转化效果的评价指标为叶柄GUS瞬时表达率和瞬时表达率指数。
GUS瞬时表达率是指叶柄有GUS蓝斑的外植体占总外植体数的百分率,GUS瞬时表达率=
瞬时表达率指数指叶柄经农杆菌侵染后整个叶柄被染色面积大小的程度,瞬时表达率指数采用分级计数法,瞬时表达率指数=
各字母代表数值见表1,分级计数法具体内容可参见方中达植病研究方法一书[3]。

表1 巨桉Eg5叶柄侵染效果分级Table 1 Grading of infection effect on petiole of E.grandis clone Eg5
1.3.6 统计分析
所有百分数经平方根反正弦化ASIN(SQRT(X))、个数经平方根转化SQRT(X),采用SPSS13.0分析软件进行方差分析(ANOVA)和Duncan多重比较(p=0.05)。文中数据为未转化数据均值。
2 结果与分析
2.1 预培养时间
预培养时间是农杆菌介导的遗传转化实验中一个重要的影响因素,侵染前外植体一般要经过一段时间的预培养以促进外植体细胞分裂,使受体细胞处于更容易整合外源DNA的状态,从而提高遗传转化效率[4]。表2的多重比较结果显示,随着预培养时间的增加,GUS瞬时表达率和瞬时表达率指数均呈现先增大后减小的趋势,预培养0 d和3 d,GUS瞬时表达率维持在40%左右,达到了最高水平;预培养3 d,叶片外植体进入了最佳的脱分化时间,瞬时表达率指数达到31%,染色效果最佳,显著优于其它水平;超过3 d后,叶片外植体则由脱分化状态进入了分化状态,妨碍了外源基因的整合,所以对于Eg5叶片外植体来说最佳的预培养时间为3 d。

表2 预培养时间对遗传转化的影响†Table 2 Effects of different pre-culture time on agrobacterium mediated genetic transformation of E.grandis clone Eg5
2.2 菌液光密度
光密度值是衡量农杆菌菌液浓度的最好指标[5],通常以600 nm处菌液的可见光光度值OD600nm代表菌液的浓度进行农杆菌侵染实验。由表3可知,随着菌液光密度的逐渐增大,GUS瞬时表达率和瞬时表达率指数均呈现先增大后降低的趋势。OD600nm为0.1时,由于细菌数量不足,叶柄部位GUS基因GUS瞬时表达率为0;OD600nm在0.2~0.4时,GUS瞬时表达率维持12.22%~13.33%之间,瞬时表达率指数维持在0.04和0.05之间;当OD600nm达到0.5时,叶柄Gus瞬时表达率和瞬时表达率指数增加到了33.67%和0.11,达到了最大值,显著优于其它处理;OD600nm大于0.5时,GUS瞬时表达率和瞬时表达率指数则逐渐下降。因此,适宜转化材料的菌液光密度值OD600nm应以0.5为最佳。

表3 菌液浓度对遗传转化的影响†Table 3 Effects of different bacterial concentration on agrobacterium mediated genetic transformation of E.grandis clone Eg5
2.3 侵染时间
侵染时间是农杆菌介导的遗传转化实验中非常重要的影响因素[6],侵染时间10~20 min时,GUS瞬时表达率和瞬时表达率指数维持在20%和0.1左右,未显著提高染色效果;侵染时间达到30~60 min时,GUS瞬时表达率和瞬时表达率指数与10~20 min相比获得了明显提升,此时间范围两指标没有明显差异,但以侵染时间60 min的两指标为最高,叶柄GUS瞬时表达率达到51.89%,瞬时表达率指数达到0.25,所以农杆菌GV3101的侵染时间为30~60 min为宜,且以60 min为最佳。笔者进行抗生素抑菌实验中发现,叶片外植体经过500 mg·L-1Cef处理后,置于100 mg·L-1Cef培养基中便可以抑制农杆菌的生长,侵染60 min不会造成后期农杆菌的过度繁殖[7]。

表4 侵染时间对遗传转化的影响†Table 4 Effects of different infection time on agrobacterium mediated genetic transformation of E.grandis clone Eg5
2.4 共培养pH
低于6.0的pH可以活化农杆菌的Vir区,从而增强遗传转化效果,pH降至5.1~5.8将使Vir区基因的诱导将达到最高水平[8]。表5显示随着pH的升高,叶柄GUS瞬时表达率和瞬时表达率指数呈现先升高后降低的趋势。pH为5.2时GUS瞬时表达率和瞬时表达率指数最低,5.4~6.2各个水平间GUS瞬时表达率和瞬时表达率指数无显著差异,当pH维持在5.8~6.0时,GUS瞬时表达率和染色效果达到最高值,所以适宜GV3101转化叶柄的共培养pH应维持在5.8~6.0之间。

表5 共培养pH值对遗传转化的影响†Table 5 Effects of different Co-culture pH on agrobacterium mediated genetic transformation of E.grandis clone Eg5
2.5 共培养时间
农杆菌附着、T-DNA的转移及整合都在共培养时期内完成,共培养时间是决定转化能否成功的关键[8],国内外研究也表明共培养时间是影响遗传转化的重要参数[9-10]。多重比较分析表明(表6),共培养时间1 d时GUS瞬时表达率和瞬时表达率指数均达到最大值,且与2、3、4、5 d存在显著差异,而共培养2、3、4、5 d各处理间没有显著差异,所以最佳共培养时间为1 d。随着共培养时间的延长,笔者也发现叶片外植体褐化率逐渐增大,所以较短的共培养时间既能减少农杆菌的过度繁殖还可以提高遗传转化的效率。
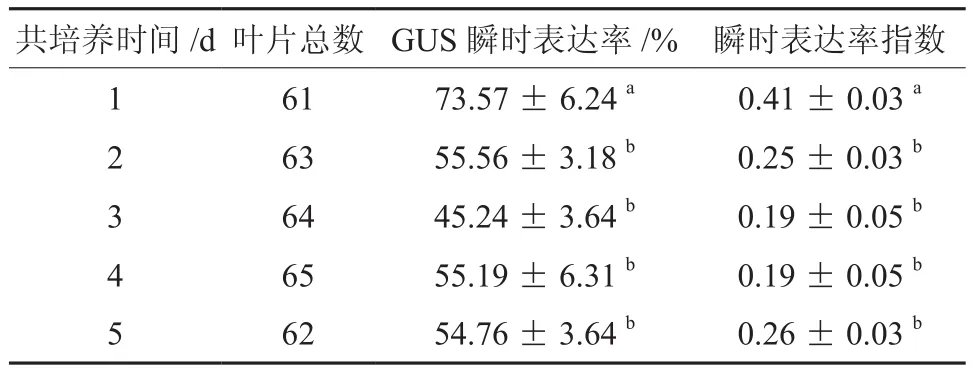
表6 共培养时间对遗传转化的影响†Table 6 Effect of Co-culture time on the agrobacterium mediated genetic transformation of E.grandis clone Eg5
2.6 乙酰丁香酮的添加试验
乙酰丁香酮作为农杆菌Vir区基因活化的诱导物被广泛应用于农杆菌介导的遗传转化研究工作中。许多研究表明不同的乙酰丁香酮添加方式对于遗传转化效率的提高至关重要[11-13]。
2.6.1 菌液中添加乙酰丁香酮
本研究表明,菌液中添加乙酰丁香酮并未显著提高GUS瞬时表达率和瞬时表达率指数。表7的多重比较表明虽然GUS瞬时表达率随AS添加浓度的增大有逐渐增大的趋势,但是各处理间的GUS瞬时表达率和瞬时表达率指数的差异未达到显著差异的水平;菌液中添加乙酰丁香酮并没有显著改善农杆菌的侵染力,相反随着GUS瞬时表达率的变大,叶柄瞬时表达率指数没有明显变化,却使得叶柄的相对染色效果变差,对遗传转化造成了不利影响。

表7 菌液中添加乙酰丁香酮对遗传转化的影响†Table 7 Effects of different AS concentration in bacterium liquid on agrobacterium mediated genetic transformation of E.grandis clone Eg5
2.6.2 共培养基中添加乙酰丁香酮
与对照相比,共培养基中添加乙酰丁香酮极大提高了叶柄的GUS瞬时表达率和瞬时表达率指数。表8显示共培养基中添加50~200 mg·L-1的乙酰丁香酮与对照相比,显著改善了叶柄GUS瞬时表达率,其中以添加100~200 mg·L-1的乙酰丁香酮使叶柄瞬时表达率指数达到最佳,添加150 mg·L-1的乙酰丁香酮时瞬时表达率指数达到最高。

表8 共培养基中添加乙酰丁香酮对遗传转化的影响†Table 8 Effects of different AS concentration in medium on agrobacterium mediated genetic transformation of E.grandis clone Eg5
3 结论与讨论
本研究首次提出采用瞬时表达率指数作为评价转化效果的一项指标,目前,国内外研究多采用瞬时表达率作为单一的评价指标,但瞬时表达率存在不能确切表示出叶柄染色程度的不足,瞬时表达率指数的提出很大程度上弥补了单一采用瞬时转化率的不足,使转化评价体系更为精确合理。目前有关巨桉遗传转化的研究在国内还未见报道,国际上也只有Yao J L等关于LBA4404介导巨桉的报道,其转化研究仅局限于茎段再生阶段抗生素敏感性和菌液浓度两方面[14],本研究初步建立了农杆菌GV310介导巨桉Eg5叶片外植体的遗传转化体系,对影响巨桉Eg5遗传转化的因素预培养时间、菌液浓度、侵染时间、共培养pH值、共培养时间和乙酰丁香酮等一系列因素进行了全面报道。
3.1 预培养时间对遗传转化的影响
农杆菌侵染外植体前一般要经过一段时间的预培养使外植体细胞处于最佳的分裂状态,以更好地接受外源基因的整合,许多研究也表明预培养对于遗传转化的重要性[15-21]。桉属植物的农杆菌转化研究表明预培养时间大多维持在2~3 d[15-18,21],本研究也表明巨桉Eg5叶片外植体的最佳预培养时间为3 d,杨树属植物的农杆菌转化研究预培养时间一般在0~1 d[19,22],席梦利等确定了杉木的最佳预培养时间为1~3 d[20],柚木的农杆菌遗传转化研究表明最佳的预培养时间为11~15 d[23],由以上可知不同的树种预培养时间存在一定的差异,可能是不同树种在不同的诱导培养基上进入最佳脱分化状态的时间不同所致,所以预培养时间的确定关键在于使外植体细胞处于最佳的脱分化状态,否则,则会由脱分化状态进入分化状态,从而妨碍外源基因的整合,对遗传转化造成不利影响。
3.2 菌液光密度与侵染时间对遗传转化的影响
菌液光密度和侵染时间是农杆菌介导的遗传转化的重要影响因素。本研究表明采用GV3101菌液OD600nm值0.5侵染巨桉Eg5叶片30~60 min瞬时染色效果最佳,这与桉树属植物多采用OD600nm值0.5以上的较浓菌液处理外植体10~30 min[14,17-18,21]的结果相一致,杨树属多采用OD600nm值0.2~0.4较稀菌液处理外植体10~20 min[19,22,24-25],小麦的遗传转化研究中,采用OD600nm值1.0以上菌液侵染1 h以上,方能达到较好的转化效果[26-28]。以上表明不同植物的最佳农杆菌菌液OD600nm值及侵染时间不尽相同,相对杨属树种,这说明桉属树种对农杆菌不太敏感,小麦由于是单子叶植物对农杆菌最不敏感,桉属树种的转化仍需要用相对较高的菌液浓度处理一定时间才能达到较好的效果。
3.3 添加乙酰丁香酮对遗传转化的影响
本文中研究了菌液中添加乙酰丁香酮和培养基中添加乙酰丁香酮两种添加方式对遗传转化的影响。很多研究表明菌液中添加乙酰丁香酮并不能显著改善遗传转化效果,甚至会降低遗传转化率[19,29-31],本研究也得出了同上述研究相一致的结论,对于没能提高转化率,分析可能有以下原因:一是乙酰丁香酮加入菌液时间不当,有研究认为在工程菌液使用前4~6 h加入,也有研究主张在制备好工程菌液后加入并放置一定时间之后再用于侵染,使农杆菌既处于对数生长期,又处于Vir基因高度活化状态[8]。二是由于乙酰丁香酮需要加入有毒的二甲基亚砜溶解,二甲基亚砜的加入可能在一定程度上抑制了农杆菌的侵染活力,使农杆菌受到了毒害。三是加入的乙酰丁香酮浓度与工程菌液浓度之间存在一定协同效应,菌液浓度过高,加入一定乙酰丁香酮则不能使遗传转化率提高,菌液浓度得到稀释后,加入乙酰丁香酮则可显著提高遗传转化率[11]。
本研究表明共培养基中添加150 mg·L-1乙酰丁香酮则大大提高了遗传转化率,许多研究也表明了共培养基中添加乙酰丁香酮对于遗传转化的积极作用[11,12,32]。由于共培养阶段是转化的最关键阶段,共培养时期添加乙酰丁香酮酚类物质促进了农杆菌Vir区基因的表达和外源基因的整合,使遗传转化率获得了大大提高。但也有研究认为乙酰丁香酮与培养基pH值存在协调效应,一定pH值条件下乙酰丁香酮才可以更好发挥其高效作用[12,33]。所以乙酰丁香酮与培养基pH值的交互作用还有待进一步研究。
3.4 因素优化顺序
研究采用单因素逐步优化法建立巨桉Eg5的转化体系,一些实验数据存在后期优化结果低于前期优化结果的问题,究其原因,可以从以下方面解释:一是提供叶片外植体的幼苗生理状态较差,某一批次的叶片外植体生长时间过长造成后期优化结果较低。Tournier, V等[34]和Aggarwal, D等[35]曾报道幼嫩组织的遗传转化率和器官发生率均较高。二是活化的不同批次的农杆菌之间可能存在侵染活力的差异。三是不同批次的GUS染色液其染色效果可能也存在一定差异。
[1] 范春节. 尾赤桉再生体系及农杆菌介导的转基因体系研究[D]. 北京:中国林业科学研究院学位论文,2008.
[2] Jefferson R A, Kavanagh T A, Bevan M W. GUS fusions: betaglucuronidase as a sensitive and versatile gene fusion marker in higher plants.[J]. The EMBO journal, 1987,6(13):3901-3907.
[3] 方中达. 植病研究方法[M]. 农业出版社,1979.
[4] 唐克轩,张献龙. 植物生物技术[M]. 科学出版社,2004.
[5] Sharma M, Kothari-Chajer A, Jagga-Chugh S, et al. Factors influencing Agrobacterium tumefaciens-mediated genetic transformation of Eleusine coracana (L.) Gaertn[J]. Plant Cell,Tissue and Organ Culture, 2011,105(1): 93-104.
[6] 杨 波,丁莉萍,姚 璐,等. 苗龄和农杆菌侵染时间对小麦茎尖转化效率的影响(英文)[J]. 分子植物育种,2008,6(2):358-362.
[7] 郭利军,曾炳山,刘 英,等. 巨桉无性系Eg5的卡那霉素和头孢霉素敏感性研究[J]. 中南林业科技大学学报,2012,32(3): 75-80.
[8] 王关林, 方宏筠. 植物基因工程[M]. 科学出版社,2002.
[9] Dutt M, Grosser J. Evaluation of parameters affecting Agrobacterium-mediated transformation of citrus[J]. Plant Cell,Tissue and Organ Culture, 2009,98(3):331-340.
[10] 赖家业,石海明,刘 凯,等. 尾巨桉遗传转化系统建立的研究[J]. 四川大学学报:自然科学版,2007, 44(2): 415-419.
[11] Huang F H, Li X Y. Effects of concentration of vacetosyringone and Agrobacterium tumefaciens on Gus gene transformation efficiency of Populus[J]. In Vitro Cell Dev Biol, 1994,30(3): 67.
[12] Godwin I, Todd G, Ford-Lloyd B, et al. The effects of acetosyringone and pH on Agrobacterium-mediated transformation vary according to plant species[J]. Plant Cell Reports, 1991,9(12):671-675.
[13] 陈 志, 陈金慧, 李婷婷, 等. 杂交鹅掌楸转双价抗病基因影响因子研究[J]. 分子植物育种,2007,5(4):588-592.
[14] Yao J L, Lin-Wang K. Eucalyptus transformation method[Z].WO Patent WO/2005/032,241, 2005.
[15] Ho C K, Chang S H, Tsay J Y, et al. Agrobacterium tumefaciensmediated transformation of Eucalyptus camaldulensis and production of transgenic plants[J]. Plant Cell Reports,1998,17(9): 675-680.
[16] Prakash M, Gurumurthi K. Genetic transformation and regeneration of transgenic plants from precultured cotyledon and hypocotyl explants of Eucalyptus tereticornis Sm.using Agrobacterium tumefaciens[J]. In Vitro Cellular &Developmental Biology - Plant, 2009,45(4):429-434.
[17] Aggarwal D, Kumar A, Sudhakara Reddy M. Agrobacterium tumefaciens mediated genetic transformation of selected elite clone(s) of Eucalyptus tereticornis[J]. Acta Physiologiae Plantarum, 2011,33(5):1603-1611.
[18] Da Silva A L L, de Oliveira Y, Da Luz Costa J. Preliminary results for genetic transformation of shoot tip of Eucalyptus saligna Sm. via Agrobacterium tumefaciens[J]. Journal of Biotechnology and Biodiversity, 2011,2(1):1-6.
[19] 诸葛强, 王婕琛, 陈 英, 等. 新疆杨高效遗传转化系统的建立[J]. 植物资源与环境学报,2003,12(4):6-10.
[20] 席梦利, 施季森. 不同因素对农杆菌介导的杉木转化效率的影响[J]. 林业科学,2007,43(3):46-50.
[21] Alcantara G B D, Bespalhok Filho J C, Quoirin M.Organogenesis and transient genetic transformation of the hybrid Eucalyptus grandis × Eucalyptus urophylla [J]. Scientia Agricola, 2011,68:246-251.
[22] Confalonieri M, Balestrazzi A, Bisoffi S. Genetic transformation of Populus nigra by Agrobacterium tumefaciens[J]. Plant Cell Reports, 1994,13(5):256-261.
[23] 曾炳山, 裘珍飞, 李湘阳, 等. 柚木愈伤组织的LBA 4404转化条件[J]. 中南林业科技大学学报,2008, 28(3): 60-64.
[24] Liu T, Pang X, Long C, et al. Successful Agrobacteriummediated transformation of Populus tomentosa with apple SPDS gene[J]. Forestry Studies in China, 2008, 10(3): 153-157.
[25] 郝贵霞, 朱 祯, 朱之悌. 毛白杨遗传转化系统优化的研究[J]. 植物学报,1999,41(9): 936-940.
[26] Cheng M, Fry J E, Pang S, et al. Genetic transformation of wheat mediated by Agrobacterium tumefaciens[J]. Plant Physiology,1997,115(3):971-980.
[27] 王永勤, 张爱民. 农杆菌介导的小麦遗传转化几个影响因素的研究[J]. 遗传学报,2002,29(003):260-265.
[28] 张志清, 郑有良, 王丕武, 等. 农杆菌介导转化小麦几个影响因素的再研究[J]. 四川农业大学学报,2006, 24(1):1-6.
[29] 刘小琳, 王继峰, 胡晓艳, 等. 根癌农杆菌介导的紫花苜蓿遗传转化体系的建立与优化[J]. 中国草地学报,2007, 29(2):102-106.
[30] 郑树松, 安成才, 李启任, 等. 乙酰丁香酮对棉花下胚轴遗传转化效率的影响[J]. 棉花学报,2003,15(2):125-126.
[31] 杨秀荣, 陈永文, 方 平, 等. 乙酰丁香酮对根癌农杆菌介导的甘薯遗传转化的影响[J]. 西南师范大学学报:自然科学版,2002,27(5):751-754.
[32] 董喜才, 杜建中, 王安乐, 等. 乙酰丁香酮在植物转基因研究中的作用[J]. 中国农学通报,2011, 32(5): 292-299.
[33] Holford P, Hernandez N, Newbury H J. Factors influencing the efficiency of T-DNA transfer during co-cultivation of Antirrhinum majus with Agrobacterium tumefaciens[J]. Plant Cell Reports, 1992,11(4): 196-199.
[34] Tournier V, Grat S, Marque C, et al. An efficient procedure to stably introduce genes into an economically important pulp tree(Eucalyptus grandis× Eucalyptus urophylla)[J]. Transgenic Research, 2003,12(4): 403-411.
[35] Aggarwal D, Kumar A, Reddy M S. Shoot organogenesis in elite clones of Eucalyptus tereticornis[J]. Plant cell, tissue and organ culture, 2010,102(1): 45-52.
Study on the factors influencing Agrobacterium tumefaciens mediated transformation of Eucalyptus grandis clone Eg5
GUO Li-jun, ZENG Bing-shan, LIU Ying, LI Xiang-yang, QIU Zhen-fei
(Research Institute of Tropical Forestry, Chinese Academy of Forestry, Guangzhou 510520, Guangdong, China)
∶ By taking Eucalyptus grandis clone Eg5 leaves as explants, the GUS gene transient expression efficiency and transient expression efficiency index as evaluation indicators, effects of the pre-culture time, bacterial concentration, infection time, co-culture pH, co-culture time,Acetosyringone(AS)concentration in the bacterium liquid and Acetosyringone concentration in the medium on genetic transformation were investigated. The results show that pre-culture 3 days, 0.5 of OD600nm, 30~60 min of infection time, 5.8~6.0 of co-culture pH, 150 mg·L-1AS of the medium, and no AS in the bacterium liquid, 1day of co-culture time, the best transformation effects were achieved. Thus, an effective system for Agrobacterium-mediated transformation of Eucalyptus grandis clone Eg5 was established.
∶ Eucalyptus grandis; Agrobacterium tumefaciens; Eg5; genetic transformation
S792.39;Q943.2
A
1673-923X(2012)06-0061-06
2012-03-09
863高新技术项目“白桦、桉树等分子育种与品种创制”项目编号(2011AA100202)
郭利军(1983—),男,河北蠡县人,硕士研究生,主要从事热带林木组培快繁和桉树转基因研究
曾炳山(1969—),男,江西井冈山人,博士,研究员,主要从事热带林木组培快繁和基因转化研究
[本文编校:吴 彬]
