水葫芦修复富营养化湖泊水体区域内外底栖动物群落特征
2012-12-26张志勇张君倩张迎颖严少华江苏省农业科学研究院农业资源与环境研究所江苏南京210014
王 智,张志勇,张君倩,张迎颖,严少华 (江苏省农业科学研究院农业资源与环境研究所,江苏 南京 210014)
水葫芦修复富营养化湖泊水体区域内外底栖动物群落特征
王 智,张志勇,张君倩,张迎颖,严少华*(江苏省农业科学研究院农业资源与环境研究所,江苏 南京 210014)
于2010年8~10月对滇池白山湾人工控制性种养的约70hm2的水葫芦区、近水葫芦区和远水葫芦区采样分析,探讨了水葫芦种养工程区域内外底栖动物群落结构特征.结果表明,在水葫芦区、近水葫芦区及远水葫芦区,底栖动物总密度分别为 294.5,159,261ind/m2,其中寡毛类的霍甫水丝蚓(Limnodrilus hoffmeisteri)为绝对优势种,分别占各自区域总密度的 68.3%,59.6%和 86.0%.逐步回归分析显示,水体总磷(TP)和底泥非稳定态磷(Labile-P)与霍甫水丝蚓密度呈显著性正相关(P < 0.01),表明霍甫水丝蚓对水体的富营养状况有很好的指示作用.水葫芦区物种组成及生物多样性指数均高于近水葫芦区和远水葫芦区(P < 0.05),在水葫芦区、近水葫芦区和远水葫芦区分别共采集到底栖动物14种、10种和6种;Shannon-Wiener多样性指数分别为1.10,0.57和0.54.种植水葫芦后,在水葫芦区及近水葫芦区,10月份的Margalef、Shannon-Wiener、Simpson和Peilou指数较8月份和9月份有显著性增加(P < 0.05),而远水葫芦区,却未出现类似的结果.一定面积控制性种养水葫芦对大型富营养化湖湾水体无脊椎底栖动物群落结构未表现出不利影响.
水葫芦;富营养化;水体修复;群落结构;底栖动物
目前,在亚太地区,54%的湖泊水体富营养化[1];在我国,富营养化湖泊及水库达66%以上[2].湖泊富营养化不仅对湖泊水质有严重影响,而且影响到周边水环境和人文景观,甚至通过给水系统危害到公众的健康[3].因此,水体富营养化治理是当前世界的热点.水生植物修复技术由于具有投资成本低、操作简单、不易产生二次污染、且能有效地去除有机物、氮磷等多种元素等优点,已成为世界各国控制水体富营养化的主要措施之一[4-6].水葫芦,又名“凤眼莲”,雨久花科凤眼莲属,为多年生漂浮性草本植物.由于其具有极强的氮、磷吸收能力以及重金属富集能力而被广泛用于水环境污染的治理[7-9].采用漂浮的水葫芦净化水质,不仅可以省去浮床建设费用,也无需曝气或搅拌等能源消耗,并且不需要反复播种或移栽,其繁殖速度快,打捞相对于其他水生植物更容易[9].由于水葫芦作为一种重要的外来生物入侵种,一些专家学者担忧水葫芦的生长会对水体生物群落的结构造成影响,而对其大规模应用于生态工程持保留态度[7,10].
水葫芦一方面在其生长过程中对水面的大面积覆盖,影响水下生物对光能的利用率,而且会造成水体溶解氧下降,从而给水生态系统产生不利影响[11];但是另一方面由于水葫芦能吸收水体富营养物质及其他污染物[7-9],对蓝藻水华具有抑制作用[12],并且其发达的根系能为水生动物及微生物提供避难场所和栖息地[11],因而可能给水生生物群落结构带来有利的影响.先前的研究主要集中在水葫芦的去除技术及其对污染物的吸收去除上,而关于水葫芦对水体生态系统的影响研究较少[11].在我国,自然泛滥及人工利用的水葫芦常常在富营养化水体大量生长,而关于水葫芦对富营养化水体的生态效应报道甚少[13-14].
大型无脊椎底栖动物是湖泊生态系统多样性的重要组成部分,在湖泊生态系统物质循环和能量代谢中具有不可替代的作用.由于其具有生活周期长,活动场所比较固定,易于采集、鉴定,且不同种类对不同生境的敏感性差异大等优点,故常作为重要的指示生物,被广泛应用于水质评价及环境监测上[15].本研究以滇池白山湾大水域控制性种养的用于水体修复的水葫芦为依托,通过对水葫芦区域内外大型底栖动物种群结构的调查分析,探讨水葫芦对大型底栖动物群落结构的影响,以期为水葫芦应用于富营养化湖泊水体生态修复提供参考.
1 材料与方法
1.1 工程区简介
白山湾位于滇池西南岸,如图1所示.面积约0.7km2,平均水深约2.5m (范围2.2~2.8m),水体富营养化,蓝藻水华频发.由于受湾外风浪的影响,白山湾水体藻类密度较大.调查发现,湖湾的水生植物主要有红线草、眼子菜、狐尾草、水花生、水葫芦、大薸及菱等.2010年春夏,江苏省农业科学院利用水葫芦快速吸收氮磷的优势,利用泡沫浮球、不锈钢钢管及围网在白山湾控制性种养水葫芦70 hm2,通过后期打捞处置、资源化利用等一系列措施来达到去除湖泊内源污染的目的.由于受风向等原因,水葫芦密集分布于工程区内侧(图1).
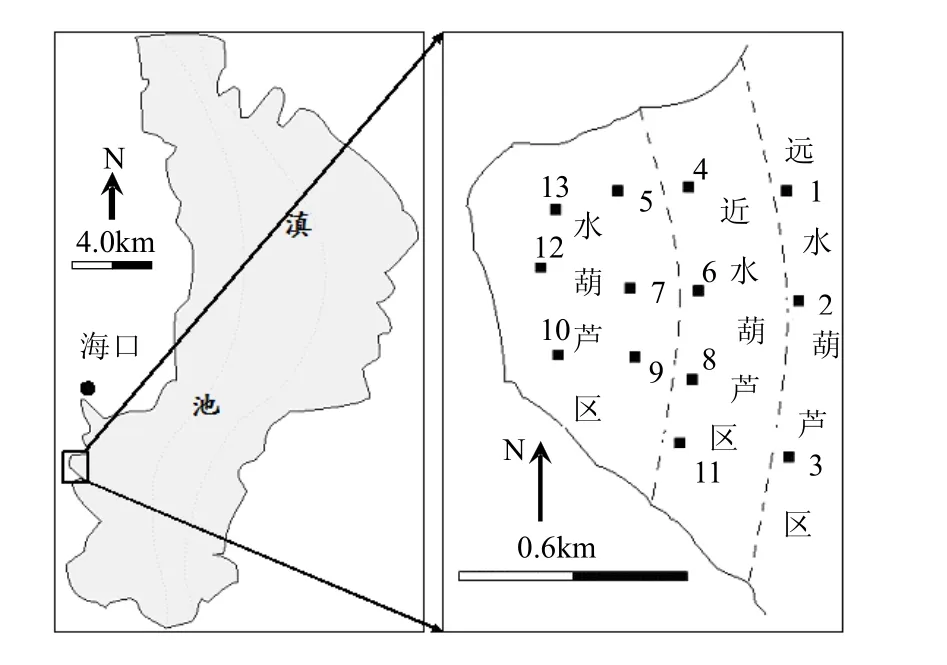
图1 试验区域采样点分布Fig.1 Sampling sites in the testing area of Baishan Bay, Lake Dianchi
1.2 样品采集与分析
本研究于白山湾水葫芦区域内外设置13个采样点,根据水葫芦分布特征将采样区分为3个区域(图 1),水葫芦区(样点 5、7、9、10、12和13号),近水葫芦区(样点4、6、8和11号)和远水葫芦区(样点1、2和3号).
于水葫芦种植后生长旺盛期至水葫芦打捞前(2010年8~10月),以1次/月的频率,对13个样点利用1/16m2的改良彼得森氏采泥器进行大型无脊椎底栖动物的采样.采集的泥样经450μm的铜筛洗净后,用肉眼将动物标本从白色解剖盘中捡出,后用10%福尔马林进行固定.在实验室将标本鉴定至尽可能低的分类单元,然后计数和称重,并换算成单位面积的含量[16].在大型底栖动物采集的同时,采集表层(0.5m)、中层(1m)及底层(2m)混合水样,现场测定 pH值、溶解氧(DO)、透明度及水温(T)后带回实验室测定总氮(TN)、氨氮(NH4+-N)、硝氮(NO3--N)、总磷(TP)及正磷酸盐(PO43--P)等;同时利用彼得森采泥器采集表层(0~10cm)泥样现场测定pH值、Eh后带回实验室测定TN、NH4+-N、TP、不稳定态磷(L-P)、含水率及有机质含量等.
水体理化指标根据《水和废水监测分析方法》测定[17]. 底泥含水率采用 105℃下烘干法,有机质采用550℃煅烧法测定[18];TN采用半微量开氏法, NH4+-N采用KC1浸提蒸馏法, TP采用高氯酸一硫酸消化法, Labile-P采用 NH4Cl 提取法测定[19].
1.3 数据处理
本研究中用到的生物多样性指数选择为[20]:
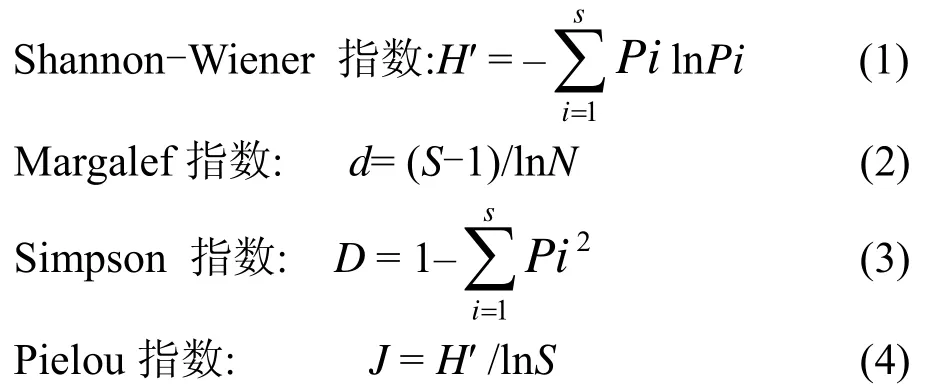
式中: N为所在群落的所有物种的个体数之和;S为群落总物种数;Pi为样品中属于第i种的个体的比例.
水葫芦区、近水葫芦区及远水葫芦区水体及底泥环境因子及底栖动物群落特征指数的差异判断采用单因素方差分析(One-way AVONA),利用 Levene’s-test进行不同组间方差齐次性检验,若方差不齐则利用Mann-Whitney U检验.利用逐步线性回归探讨水体及底泥环境理化因子与优势种密度及总密度的关系.数据分析使用SPSS for Windows 16.0统计软件处理.
2 结果与分析
2.1 采样区域环境理化性质
由表1可见,在整个采样周期,10月份水体TN、NH4+-N、NO3-、TP 及PO43-较8月份和9月份显著上升,其主要原因一方面是 10月份水葫芦开始出现腐败死亡现象;另一方面是由于 10月份风浪较大.各采样区域水体理化性质的统计分析表明,水葫芦区DO和pH值显著性低于近水葫芦区和远水葫芦区(P < 0.05),而TN和TP的浓度表现为水葫芦区>远水葫芦区>近水葫芦区的规律.水葫芦区水体氮磷浓度高于周围水体主要是由于:一、由于水葫芦能降低其覆盖水体的溶解氧,而溶解氧的降低有利于水体氮磷的释放;二、水葫芦根系能够吸附水体悬浮颗粒物及藻类,造成水体总氮磷含量升高;三、一些水葫芦根系的腐败分解,造成水葫芦区域氮磷含量升高.在水葫芦区,底泥TN、NH4+-N、TP及L-P浓度在8月份至9月份显著降低,之后趋于稳定, 而在近水葫芦区和远水葫芦区却未表现出这样的规律.水葫芦区底泥主要营养盐指标降低可能主要是由于水葫芦吸收的缘故.从3个区域来看,水葫芦区底泥TN、NH4+-N及TP略高于近水葫芦区和远水葫芦区(P>0.05,表1).
2.2 底栖动物物种组成及现存量
在滇池湖湾工程区的3次采样中,共采集到底栖动物18种(表2).其中,寡毛类8种(占物种总数的44.4%),水生昆虫5种(占物种总数的27.8%),软体动物1种(占物种总数的5.6%),甲壳纲3种(占物种总数的16.7%),此外线虫纲1种(占物种总数的5.6%).在水葫芦区,共采集到底栖动物14种,分别为寡毛类7种,软体动物1种,水生昆虫2种,甲壳纲3种及线虫纲1种.近水葫芦区,采集到底栖动物10种,分别为寡毛类6种,水生昆虫3种和线虫纲1种.而在远水葫芦区,仅采集到底栖动物6种,分别为寡毛类4种,水生昆虫2种.在3个区域共同出现的物种为霍甫水丝蚓、巨毛水丝蚓及正颤蚓,而软体动物椭圆萝卜螺及甲壳纲螃蟹、米虾及钩虾仅出现在水葫芦区(表2).
在水葫芦区、近水葫芦区及远水葫芦区,底栖动物密度分别为294.5,159,261ind/m2.3个采样区域中底栖动物主要以寡毛类(主要为霍甫水丝蚓和巨毛水丝蚓)为主,其密度分别达到264、151和 250ind/m2,分别占各区域底栖动物总密度的89.6%、95%和95.8%(表3).
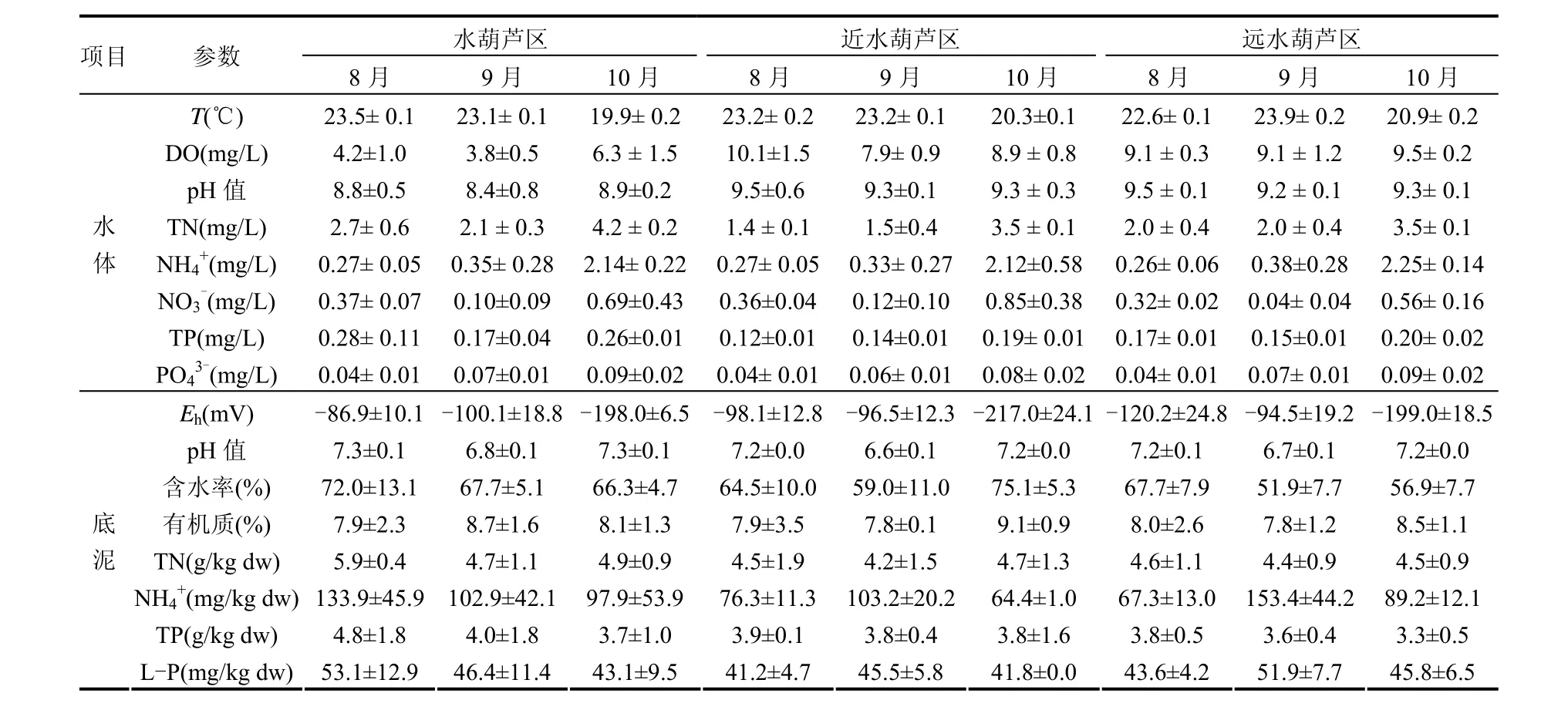
表1 不同采样区域水体及底泥理化性质Table 1 Physical and chemical parameters in the water and sediment of the three sampling areas
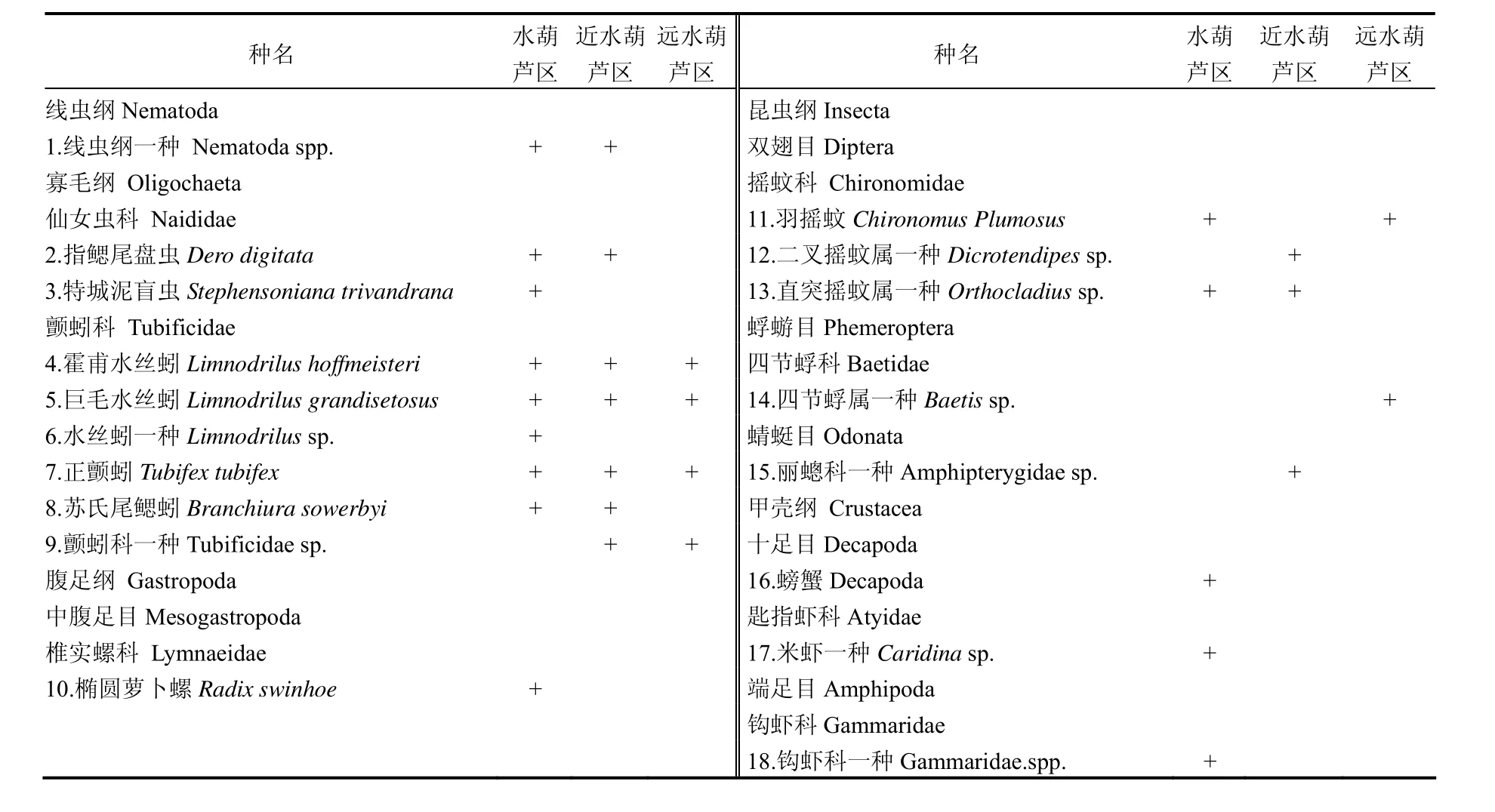
表2 不同采样区域底栖动物物种组成Table 2 Species compositions of benthic macro-invertebrates in the different sampling areas
由于底栖动物个体重量不同,其生物量分布与密度存在一定的差异.在水葫芦区,底栖动物生物量的构成主要以寡毛类(主要为霍甫水丝蚓及巨毛水丝蚓)和水生昆虫(主要为摇蚊科)为主,其生物量分别占总生物量的 55.8%和 29.7%;在远水葫芦区,其生物量与水葫芦区具有相似的构成,寡毛类和水生昆虫生物量分别占总生物量的61.1%和38.9%;而在近水葫芦区,则主要是寡毛类,其生物量占总生物量的99.3%(表3).
功能摄食类群[21]分析显示,水葫芦区的物种组成是收集者(密度:97.0%,生物量:93.3%),寄生者(密度:1.3%,生物量:0.6%)、刮食者(密度:1.3%,生物量:1.8%)及撕食者(密度:0.6%,生物量:3.0%);近水葫芦区物种组成是收集者(密度:97.2%,生物量:96.4%),以及少量的寄生者(密度:1.8%,生物量:2.9%)和捕食者(密度:1.0%,生物量:0.7%);而在远水葫芦区,仅采集到收集者.
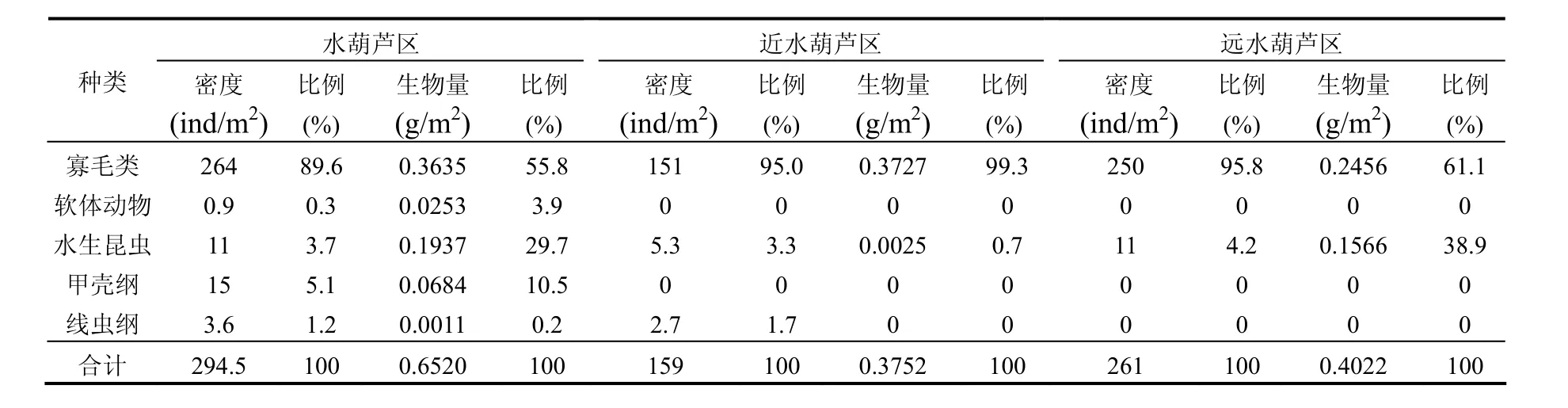
表3 不同采样区域底栖动物密度及生物量Table 3 Densities and biomasses of benthic macro-invertebrates in the different sampling areas
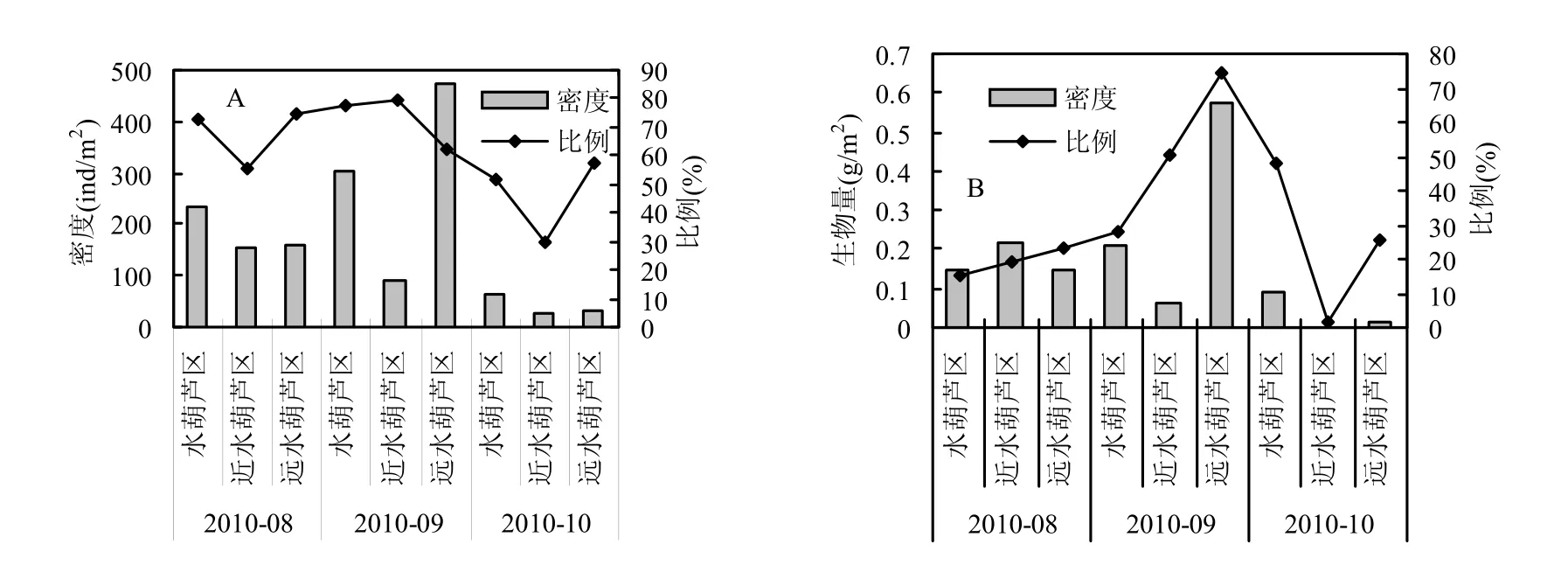
图2 不同采样区域霍甫水丝蚓密度及生物量的动态变化Fig.2 Density and biomass dynamic changes of L.hoffmeisteri in the different sampling areas
2.3 优势种
在整个采样区域中,寡毛类占绝对优势,其平均密度为 259ind/m2,占总密度的 92.5%.其中,霍甫水丝蚓是主要的优势种,其平均密度为200.5ind/m2,占总密度的 71.6%.霍甫水丝蚓在水葫芦区、近水葫芦区和远水葫芦区的平均密度分别为218.7、104.0和281.1ind/m2,分别占各自区域总密度的68.3%,59.6%和86.0%.霍甫水丝蚓在3个采样区域8~10月密度的动态变化如图2A所示,可以看出,种植水葫芦后,霍甫水丝蚓密度在水葫芦区和远水葫芦区增加后降低;而在近水葫芦区,则逐步下降.生物量在3个采样区域的动态变化规律与密度变化规律类似(图 2B).由于所采集样品中的次优势种摇蚊类个体较寡毛类大,其所占较大比例的生物量,因此霍甫水丝蚓生物量占其所在区域底栖动物总生物量的比值较小(图2B).
为探讨理化因子对采样区域优势种霍甫水丝蚓密度与底栖动物总密度的影响,以表1所示的16种理化因子为自变量,霍甫水丝蚓密度和底栖动物总密度为因变量进行逐步回归分析表明,水体 TP与底泥非稳定态磷Labile-P为影响霍甫水丝蚓密度的主要因素,TP及底泥含水率为影响采样区域大型底栖动物总密度的主要因素(表4).
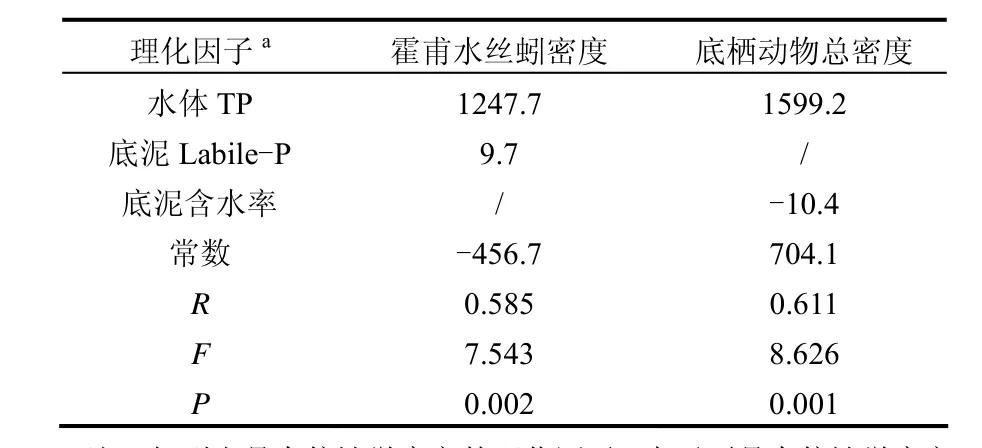
表4 霍甫水丝蚓及大型底栖动物总密度与环境因子的回归分析系数Table 4 Coefficients of stepwise regression analysis between Limnodrilus hoffmeisteri or total densities and physical-chemical factors
2.4 群落特征指数
表 5可见,从时间变化来看,在水葫芦区及近水葫芦区,Margalef、Shannon-Wiener、Simpson和Peilou指数在8~9月份均降低,而到了10月份明显增加.方差分析显示,在水葫芦区及近水葫芦区,Margalef、Shannon-Wiener、Simpson和Peilou指数在8月份和9月份间差异不显著(P > 0.05),但到10月份,其多样性指数显著性增加(P < 0.05).而在远水葫芦区,多样性指数Margalef、Simpson 和Shannon-Wiener 在8~10月份逐步降低,且在10月份显著低于8月份和9月份;均匀度指数Peilou在9月份和10月份基本一致.
从不同区域比较来看,在水葫芦区多样性指数Margalef、Simpson和Shannon-Wiener显著高于远水葫芦区和近水葫芦区;而均匀度指数Peilou在3个区域差异不显著(P > 0.05,表5).
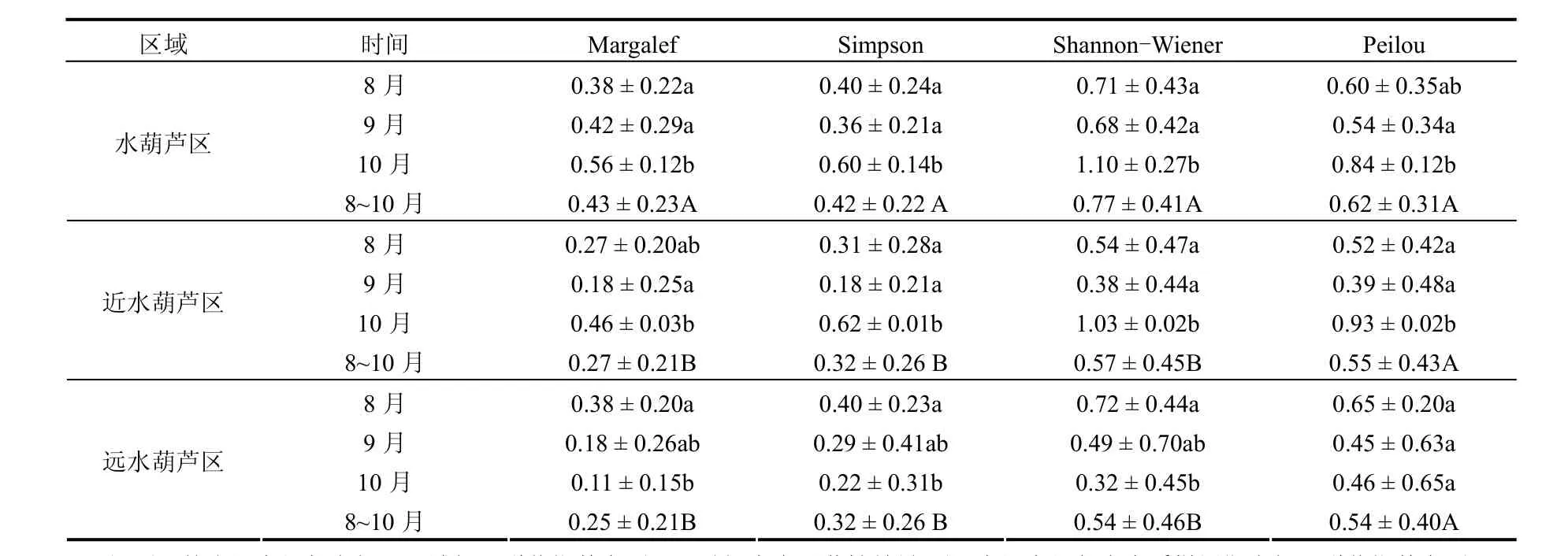
表5 不同采样区域底栖动物群落特征指数Table 5 Community characteristic indexes of benthic macro-invertebrates in the three sampling areas
2.5 水质的生物学评价
Margalef指数规定的水质标准为:d > 3.5为清洁;2~3.5为轻污染;1~2为中污染;0~1为重污染;0为严重污染[22].Simpson指数规定:D > 6为清洁;3~6为轻污染;2~3为中污染;1~2为重污染;<1为严重污染[23].Shannon-Wiener指数规定:H′ > 3为清洁;2~3为轻污染;1~2为中污染;0~1为重污染;0为严重污染[22].依据此标准评价不同采样区域的水质如表6所示.可见除了10月份在水葫芦区和近水葫芦区Shannon-Wiener指数指示的污染状态为中污染外,其他均为重污染状态.
3 讨论
在本研究的整个调查区域,共采集到底栖动物18种,在水葫芦区为14种,近水葫芦区为10种,而在远水葫芦区仅为6种;生物多样性指数表明,在水葫芦区Margalef、Simpson和Shannon-Wiener显著高于近水葫芦区及远水葫芦区,并未显示出水葫芦对于湖泊大型底栖动物的不利影响,其主要原因是水葫芦一方面能吸收水体有毒有害污染物质;另一方面具有复杂的根系,能一定程度上为大型无脊椎动物提供栖息繁殖场所[11].例如,椭圆萝卜螺、螃蟹、米虾及钩虾仅出现在水葫芦区(表2).先前也有文献报道了水葫芦对湖泊大型脊椎动物的积极影响,如对佛罗里达州欧基求碧湖水葫芦区域的大型无脊椎动物的研究发现,水葫芦区域大型无脊椎动物为典型的底栖动物,其丰度明显高于其他植物根系区域及无植物区域[24]; Brendonck等[25]的研究发现,水葫芦区域出现大量无脊椎动物如腹足类及蜘蛛类;Villamagna[26]对墨西哥查帕拉湖的研究也表明在水葫芦区域由于其根系发达,大型无脊椎动物的种群密度及多样性都要高于无水葫芦区域及含沉水植被的水体;最近,刘国锋等[14]对太湖水葫芦区域内外的底栖动物研究表明,在水葫芦区内软体动物密度及生物量明显高于水葫芦区外,水葫芦区底栖动物Simpson多样性指数也较高.本研究的结果与上述结果一致,也证实了水葫芦区大型无脊椎动物的生物多样性要高于水葫芦区外围.这似乎与水体DO降低存在矛盾,事实上在富营养化湖泊中由于藻类的光合作用,水体的 DO一般处于过饱和的状态[27-28],只要控制水葫芦在一定的覆盖度,其水体DO能维持在一个可以接受的水平,如本工程区水葫芦区域水体DO > 3.8mg/L(表 1).在富营养化湖泊中,水体大型无脊椎底栖动物主要为耐污种,其对水体的DO 要求较低[29-30].从功能摄食类群来分析,发现在水葫芦区、近水葫芦区及远水葫芦区其主要的摄食类群均为收集者,这主要是由于收集者主要以有机碎屑为食,在整个采样区域存在着一定数量的水草,水草的腐烂为这些底栖动物提供了食物.但是,在3个区域其功能摄食类群存在一定的差异,例如在水葫芦区其功能摄食类群较多,出现撕食者和刮食者,甚至出现寄生者,在近水葫芦区还出现了捕食者,而在远水葫芦区仅出现收集者,这一定程度上说明水葫芦对于富营养化湖泊的生境的改善可能存在积极作用.在种植水葫芦后,其近水葫芦区域水体TP、TN等理化指标明显优于水葫芦区及远水葫芦区,水葫芦区底泥 TP浓度也随着水葫芦的生长而逐渐降低(表1),说明水葫芦对工程区域水质的改善作用.
利用生物多样性指数的水质进行评价发现,工程区域水体主要处于重污染水体,表明对该区域实施生态工程以削减水体污染物质的必要性.从表5可知,在水葫芦区及近水葫芦区,10月份水质要好于8月份和9月份,而在远水葫芦区其水质在 8~10月份表现为逐步下降的趋势.可见,水葫芦控制性种养生态工程的实施,对于改善滇池湖湾水体水质特征具有一定积极的作用.
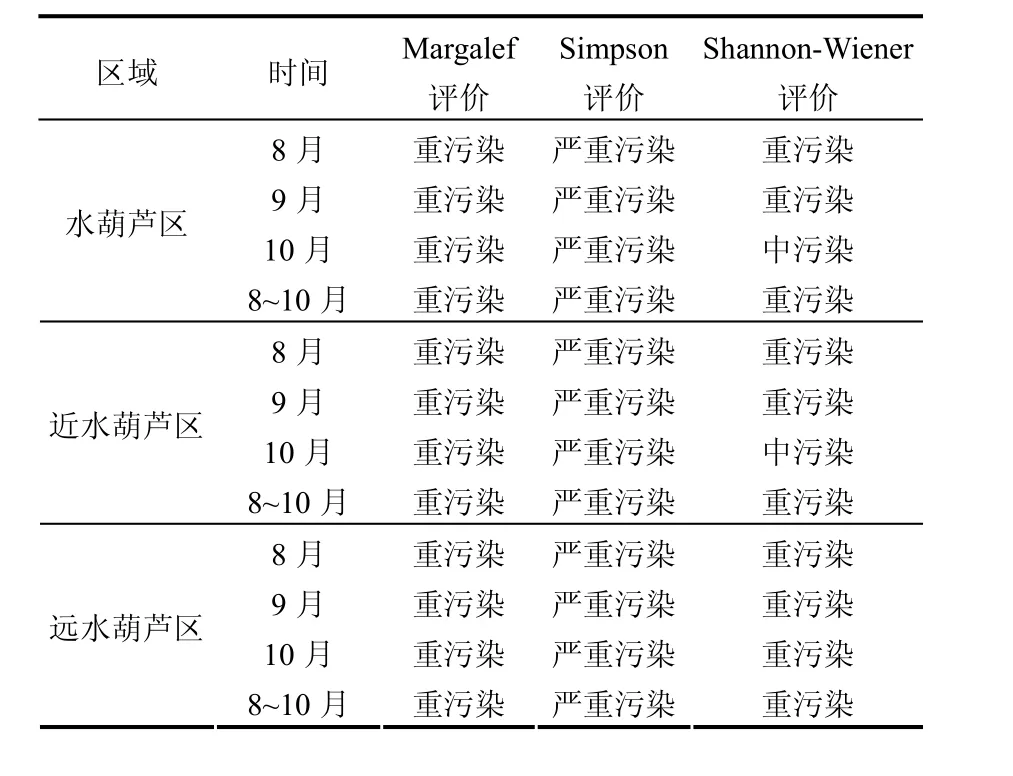
表6 利用Margalef、Simpson和Shannon-Wiener指数进行水质评价的结果Table 6 Results of water quality assessment according to Margalef, Simpson and Shannon-Wiener indexes
本研究仅仅在空间的尺度上,短期地跟踪调查了水葫芦控制性种养后滇池湖湾大型无脊椎底栖动物的动态变化.大型无脊椎浮游动物也是湖泊生态系统的一个重要组成部分,并且能直接地受到水葫芦根系的影响.为了正确地评价水葫芦用于湖泊生态修复的生态风险,今后将在现有工作的基础上,对水葫芦种养前后,在时间和空间的尺度上,长期地监测评价水葫芦用于生态修复对湖泊生态系统大型无脊椎动物的影响.
4 结论
4.1 通过短期的原位调查发现,在滇池湖湾大水域控制性种养水葫芦对于湖湾大型无脊椎底栖动物群落未产生不利影响.
4.2 水葫芦区出现底栖动物物种 14种,而近水葫芦区为10种,远水葫芦区为6种;水葫芦区底栖动物功能摄食类群较近水葫芦区及远水葫芦区复杂.
4.3 水葫芦区生物多样性指数 Margalef、Simpson和Shannon-Wiener均显著性高于近水葫芦区及远水葫芦区.
[1] Chorus I, Bartram J. Toxic cyanobacteria in water: a guide to their public health consequences, monitoring, and management [M]. London: E and FN Spon, 1999,416.
[2] 金相灿,胡小贞.湖泊流域清水产流机制修复方法及其修复策略[J]. 中国环境科学, 2010,30(3):374-379.
[3] 刘聚涛,高俊峰,赵家虎,等.太湖蓝藻水华灾害程度评价方法[J]. 中国环境科学, 2010,30(6):829-832.
[4] 成小英,王国祥,濮培民,等.冬季富营养化湖泊中水生植物的恢复及净化作用 [J]. 湖泊科学, 2002,14(2):139-144.
[5] Rodriguez-Gallego L, Mazzeo N, Gorga J, et al. The effects of an artifcial wetland dominated by free-foating plants on the restoration of a subtropical, hypertrophic lake [J]. Lakes and Reservoirs: Research and Management, 2004,9:203-215.
[6] 庞 燕,叶碧碧,储昭升,等.洱海湖滨带茭草收割管理关键参数研究 [J]. 中国环境科学, 2011,31(6):1007-1012.
[7] Malik A. Environmental challenge vis a vis opportunity: The case of water hyacinth [J]. Environment international, 2007,33:122-138.
[8] Skinner E, Wright N, Porter-Goff E. Mercury uptake and accumulation by four species of aquatic plants [J]. Environmental Pollution, 2007,145:234-237.
[9] 常志州,郑建初.水葫芦放养的生态风险及控制对策 [J]. 江苏农业科学, 2008,3:251-253.
[10] 吴 丹,望志方,冯 利.水葫芦繁殖过度的危害及其防治措施[J]. 环境科学与技术, 2001,2:35-37.
[11] Villamagna A M, Murphy B R. Ecological and socio-economic impacts of invasive water hyacinth (Eichhornia crassipes): a review [J]. Freshwater biology, 2010,55:282-298.
[12] 耿小娟,范 勇,王晓青,等.水葫芦化感物质 N-苯基-2-萘胺对铜绿微囊藻生长的影响 [J]. 四川大学学报, 2009,5:1493-1496.
[13] 蔡雷鸣.福建闽江水口库区飘浮植物覆盖对水体环境的影响[J]. 湖泊科学, 2006,18(3):20-254.
[14] 刘国锋,刘海琴,张志勇,等.大水面放养凤眼莲对底栖动物群落结构及其生物量的影响 [J]. 环境科学, 2010,31(1):92-99.
[15] Morse J C, Bae Y J, Munkhjargal G, et al. Freshwater biomonitoring with macroinvertebrates in East Asia [J]. Frontiers in Ecology and the Environment, 2007,5:33-42.
[16] 熊 晶,谢志才,陈 静,等.转基因鲤鱼对大型底栖动物群落及多样性的影响 [J]. 长江流域资源与环境, 2010,19:377-382.
[17] 国家环境保护总局.水和废水监测分析方法 [M]. 北京:中国环境出版社, 2002
[18] Hakanson L, Jansson M. Principles of lake sedimentology [M]. New York: Springer-Verlag, 1983.
[19] 鲍士旦.土壤农化分析 [M]. 北京:中国农业出版社, 2000.
[20] Pielou E C. Ecological diversity [M]. New York: John Wiley. 1975
[21] Barbour M T, Gerritsen J, Snyder B D, et al. Rapid bioassessment protocols for use in streams and wadeable rivers [M]. Washington DC:USA/EPA, 1999.
[22] 赵永晶,沈建忠,王 腾,等.基于大型底栖动物的乌伦古湖水质生物学评价 [J]. 水生态学杂志, 2010,3:7-11.
[23] 龚志军,谢 平,唐汇涓,等.水体富营养化对大型底栖动物群落结构及多样性的影响 [J]. 水生生物学报, 2001,25:210-216.
[24] O’Hara J. Invertebrates found in water hyacinth mats [J]. Quarterly Journal of the Florida Academy of Sciences, 1967,30: 73-80.
[25] Brendonck L, Maes J, Rommens W, et al. The impact of water hyacinth (Eichhornia crassipes) in a eutrophic subtropoical impoundment (Lake Chivero, Ximbabwe).II. Species diversity [J]. Arch. Hydrobiol., 2003,158:389-405.
[26] Villamagna A. The ecological effects of water hyacinth (Eichhornia crassipes) on Lake Chapala, Mexico [D]. Blacksburg: Virginia Polytechnic Institute and State University, 2009.
[27] Wang Z, Xiao B D, Wu X Q, et al. Linear alkylbenzene sulfonate (LAS) in water of LakeDianchi-spatial and seasonal variation, and kinetics of biodegradation [J]. Environmental Monitoring Assessment, 2010,171:501-512.
[28] 王仕禄.太湖梅梁湾温室气体(CO2, CH4和N2O) 浓度的昼夜变化及其控制因素 [J]. 第四纪研究, 2010,30:1186-1192.
[29] 王丑明,谢志才,宋立荣,等.滇池大型无脊椎动物的群落演变与成因分析 [J]. 动物学研究, 2011,31(2):1-10.
[30] Gong Z J, Xie P. Impact of eutrophication on biodiversity of the macrozoobenthos community in a Chinese shallow lake [J]. Journal of Freshwater Ecology, 2001,16:171-178.
The fauna structure of benthic macro-invertebrates for environmental restoration in a eutrophic lake using waterhyacinths.
WANG Zhi, ZHANG Zhi-yong, ZHANG Jun-qian, ZHANG Ying-ying, YAN shao-hua*(Institute of Agricultural Resource and Environmental Sciences, Jiangsu Academy of Agricultural Sciences, Nanjing 210014, China). China Environmental Science, 2012,32(1):142~149
From August to October in 2010, approximately 70 hectares of water hyacinth were planted at the Baishan Bay in Lake Dianchi and benthic macro-invertebrates were sampled. The densities of benthic macro-invertebrates in water hyacinth area (WHA), near water hyacinth area (NWHA) and far water hyacinth area (FWHA) were 294.5,159 and 261 ind/m2, respectively. Amongst of all present species, oligochaete Limnodrilus hoffmeisteri was the dominant species, representing 68.3% (WHA), 59.6% (NWHA) and 86.0% (FWHA). Stepwise regression analysis showed a significantly positive relationship (P < 0.01) between the densities of Limnodrilus hoffmeisteri to the total phosphorus (TP) in the water and Labile-P in the sediment. Limnodrilus hoffmeisteri was a good indicator of eutrophication. The richness and biodiversity in WHA were higher (P < 0.05) than that in the NWHA and FWHA. The richness of benthic macro-invertebrates was 14 in WHA, 10 in NWHA and 6 in FWHA, respectively. Shannon-Wiener diversity indexes in WHA, NWHA and FWHA were 1.10, 0.57 and 0.54, respectively. After planting water hyacinth in the lake, in WHA and NWHA, the Margalef index, Shannon-Wiener index, Simpson index and Peilou index in October 2010 were significantly increased comparing to August and September 2010 (P < 0.05). However, these indexes were not significantly different at FWHA during the research intervals. A controlled presence of water hyacinth is not harmful to benthic invertebrates in a eutrophic lake.
water hyacinth (Eichhornia crassipes);eutrophication;environmental restoration;fauna structure;benthic macro-invertebrates
2011-04-10
“十一五”国家科技支撑计划项目(2009BAC63B01);云南省社会发展专项项目(2009CA034);江苏省人社厅博士后基金(5311105)
* 责任作者, 研究员, shyan@jaas.ac.cn
X52
A
1000-6923(2012)01-0142-08
致谢:感谢中国科学院水生生物研究所博士生蒋小明、湖北省环境监测中心熊晶硕士在大型无脊椎底栖动物鉴定方面给予的帮助.
王 智(1983-),男,湖北黄冈人,助理研究员,博士,主要从事湖泊污染生态学方面的研究.发表论文10余篇.
