克氏螯虾虾壳Protamex 蛋白酶水解物的抗氧化活性*
2012-12-25李松林
李松林
1(淮阴工学院 生命科学与化学工程学院,江苏 淮安,223003)
2(南京大学 淮安高新技术研究院,江苏淮安,223003)
利用克氏螯虾(Procambarus clarkii)生产1 t虾仁约会产生5~6 t的下脚料——虾壳[1]。虾壳中含有20%~30%的甲克素,20% ~30%的蛋白质等有机物,以及30% ~40%的钙等无机物[2]。如果不对虾壳进行处理,既造成了资源的浪费,又导致污染环境。食品蛋白质经过酶水解,可以在不影响营养价值的前提下提高或者改进蛋白质的功能特性[3]。水解产生的多肽不仅可以提高生物体对蛋白质的进一步消化吸收,而且可以获得抗氧化活性肽。
自由基是有机体正常新陈代谢的产物,过量的自由基会引起脂质的过氧化而导致严重的疾病,如癌症、风湿性关节炎和衰老等[4]。由于化学合成抗氧化剂可能具有潜在的毒性,因此人们更加关注天然抗氧化剂的开发与应用[5]。本研究运用Protamex蛋白酶对克氏螯虾虾壳进行水解,对虾壳蛋白肽(CSPH)的DPPH·清除能力,ABTS·+清除能力,OH·清除能力,还原能力和Fe2+螯合力进行研究。同时对水解物的分子质量分布与抗氧化性之间的关系进行了探讨。
1 材料与方法
1.1 材料与仪器
克氏螯虾虾壳,江苏淮安盱眙县;Protamex蛋白酶,南宁庞博生物工程有限公司;菲洛嗪,丹麦诺维信公司;DPPH(二苯代苦味酰基自由基),GSH(谷胱甘肽),ABTS[2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐],美国Sigma-aldrich公司;其他试剂均为分析纯。
HH-600数显恒温水浴锅,UV752N紫外可见分光光度计,上海精科实业有限司;FreeZone 6L真空冷冻干燥机,美国Labconco公司;FA-2104N电子分析天平,上海精密科学仪器有限公司;Éppendorf 5430台式高速离心机,艾本德中国有限公司。
1.2 实验方法
1.2.1 虾壳蛋白肽的制备工艺
虾壳→干燥→研磨→虾壳粉→脱脂虾壳→碱提酸沉→离心→沉淀物真空冷冻干燥→虾壳蛋白→酶解→灭酶(100℃水浴10 min)→离心(10 000 r/min,30 min)→上清液→浓缩→真空冷冻干燥→虾壳蛋白肽
其中酶解条件为:酶∶底物=1∶500,虾壳粉∶水=1∶7,温度 55℃,pH7.0,时间 320 min。
1.2.2 虾壳蛋白肽抗氧化功能评价
DPPH·清除能力测定[6],ABTS·+清除能力的测定[7],OH·清除能力的测定[8],还原能力测定[9],Fe2+螯合力测定[10]。
1.2.3 水解物的分子质量分布
采用高效凝胶渗透色谱法测定,色谱柱:TSK gel G2000 SWXL(7.8 mm×30 cm)。洗脱液:V(水)∶V(乙腈)∶V(三氟乙酸)=55∶45∶0.1)。柱温为室温,流速为0.5 mL/min。检测波长:220 nm。制作标准曲线的标准样品:Gly-Gly-Gly(189 Da),Gly-Gly-Tyr-Arg(451 Da),杆菌肽 (1450 Da)和细胞色素C(12 384 Da)。
2 结果与分析
2.1 还原力
还原力通常用来评价抗氧化剂作为电子供体提供电子或者氢原子的能力[6]。具有还原力的物质可以减少脂质过氧化反应过程的氧化中间物[11]。如图1所示,虾壳蛋白肽的还原力随着浓度的增加而增强,并且具有较好的线性关系(y=0.122 9x-0.035 6,R2=0.994 3,P <0.05)。Yang等人发现,金枪鱼头的蛋白水解物的还原力同样随着蛋白肽浓度的增加而增强,并具有良好的线性关系[12]。虾壳蛋白肽在浓度为3.0 mg/mL时,吸光度值为0.33。Jia等人研究发现阿拉斯加鳕鱼皮蛋白水解物在浓度为3.0 mg/mL 时,吸光度值为 0.2[13]。
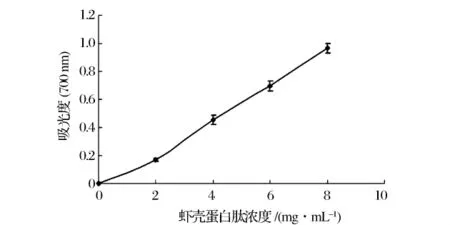
图1 虾壳蛋白肽的还原能力
2.2 Fe2+螯合力
过渡态金属,例如Fe2+,通过螯合作用可以延迟过氧化反应,进而阻止食品的酸败[14]。如图2所示,虾壳蛋白肽Fe2+螯合力随着浓度的增大而增大。在浓度为2 mg/mL时,虾壳蛋白肽(CSPH)的螯合率为22.3%而EDTAD的螯合率则为79.9%。但是当浓度值超过10 mg/mL时,两者的螯合力趋于一致。Yaowapa等人通过研究证明圆竹荚鱼蛋白的水解物同样具有一定的螯合活力[15]。
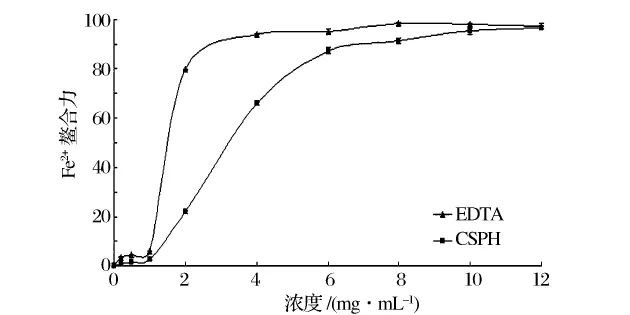
图2 虾壳蛋白肽的Fe2+螯合能力
2.3 对DPPH·的清除能力
DPPH·清除实验被广泛应用于测定蛋白水解物的抗氧化性[16]。当DPPH·遇到质子供体时,例如具有抗氧化能力的物质,自由基将被清除,同时吸光值下降[13]。如表1所示,对CSPH在不同浓度下的DPPH·清除活力进行了测定,同时使用GSH作为自由基清除的对照。虾壳蛋白肽的自由基清除活力随着浓度的增加而增加,同时具有良好的线性关系(y=50.48x+7.027 3,R2=0.982 1,P <0.05)。Dong等人同样发现了牡蛎肉蛋白肽的浓度与DPPH·清除活力之间具有线性关系[17]。通过实验发现,GSH具有更强的清除自由基活力,其IC50=0.76 mg/mL,而虾壳蛋白肽的IC50=0.85 mg/mL。这是由于GSH本身为强抗氧化剂。而虾壳蛋白肽是由不同的多肽组合而成。其中某些分子质量范围的多肽可能具有较强的抗氧化性,然而其中可能还包括某些多肽只有较弱的抗氧化性,甚至不具有抗氧化性活力。
2.4 对ABTS+·的清除能力
对ABTS+·的清除能力以电子转移和氢原子转移为基础,被广泛应用于评价抗氧化活力[18]。如表1所示,虾壳蛋白肽浓度与ABTS+·的清除能力之间存在着线性增加的关系(y=47.6x+8.507 8,R2=0.986 8,P<0.05)。与DPPH·清除能力相似,虾壳蛋白肽的IC50(0.87 mg/mL)大于GSH的IC50(0.44 mg/mL)。与虾壳蛋白肽相似,Zhu等人发现,小麦蛋白水解物的ABTS+·的清除能力同样随着蛋白肽的浓度增加而增加[19]。
2.5 对羟自由基(OH·)清除能力
OH·寿命较短,但具有较强的反应性,只能与邻近的分子发生反应,对机体具有较大的危害性[20]。表1中比较了虾壳蛋白肽和GSH在浓度0.2~1.2 mg/mL对OH·的清除能力。由表1可见,随着浓度的增大,虾壳蛋白肽和GSH对OH·清除能力均增大。在浓度相同时,二者对羟基自由基的清除能力存在显著性差异(P<0.05)。在浓度为1.0 mg/mL时,虾壳蛋白肽的自由基清除能力为65.82%,而GSH则为79.16%。
2.6 虾壳蛋白水解物分子质量分布
分子质量是反应蛋白水解的重要参数,与蛋白水解物的生物活性密切相关[21]。Wang发现抗氧化性取决于水解物的分子质量分布。如图3和表2所示,92.79%的虾壳蛋白水解物的分子质量小于1 000 u。这说明水解物中包含了大量的低分子量多肽。这些低分子量多肽主要由分子质量范围在180~500 u的多肽组成(50.51%)。Sitthipong等报道了来源于虹色金线鱼蛋白水解物的低分子量多肽具有较强的抗氧化能力。其中1个1.3 kDa的肽段展示出最强的ABTS自由基清除能力[22],说明分子质量对抗氧化性具有显著的影响。
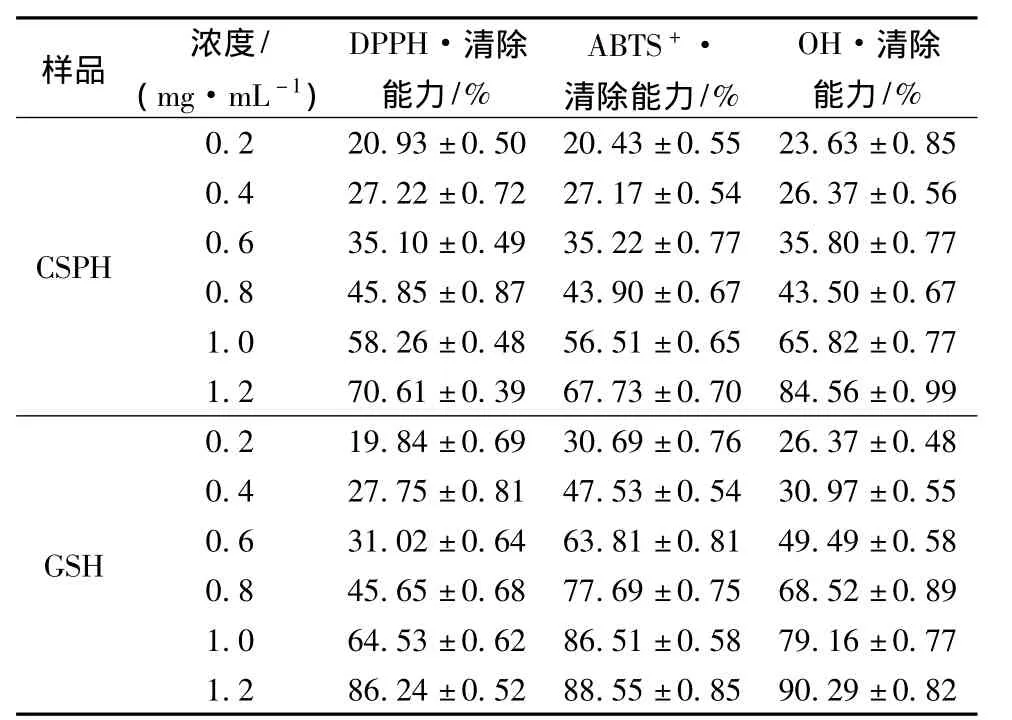
表1 虾壳蛋白肽对DPPH·、ABTS+·和OH·的清除能力
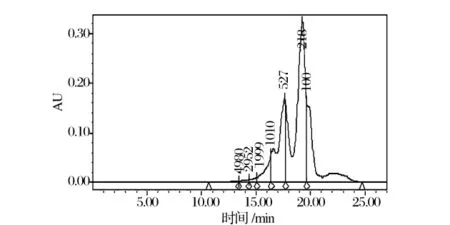
图3 虾壳蛋白水解物的分子质量分布
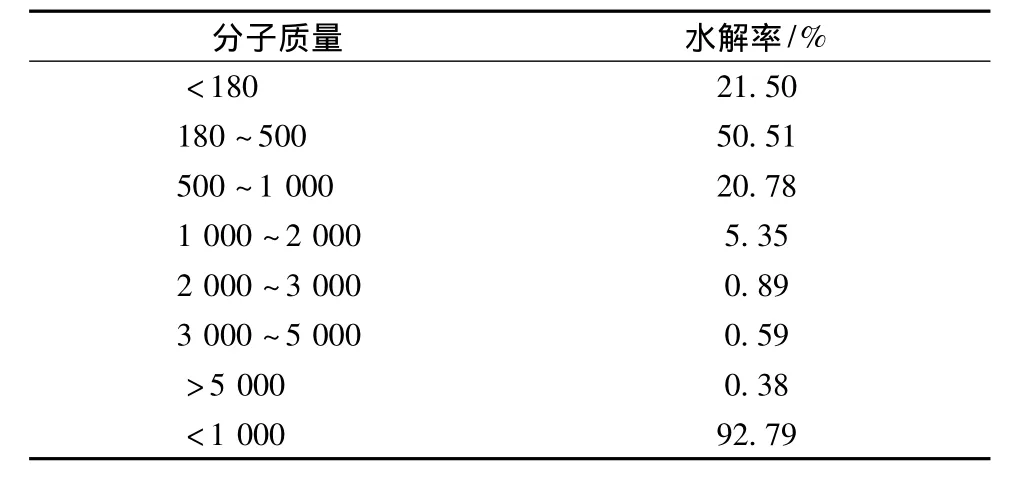
表2 虾壳蛋白水解物的分子量分布
3 结论
虾壳蛋白肽的还原能力和自由基清除能力随肽浓度的增大而增大。Fe2+螯合力同样与蛋白肽的浓度之间存在着量效关系,但是当浓度达到10 mg/mL时,螯合力不再继续增大。通过对蛋白肽的分子质量分布进行研究发现,92.79%的多肽的分子质量小于1 000 u,其中21.50%的多肽分子质量小于180 u,50.51%的多肽分子量为180~500 u,20.78%的多肽分子质量为500~1 000 u。
[1] 陈乃富,刘文中,闵运江.克氏螯虾虾壳制备氨基葡萄糖盐酸盐的工艺研究[J].氨基酸和生物资源,2002,24(3):40-41.
[2] 丁纯梅,陶庭先,吴之先.龙虾虾壳的综合利用[J].化学世界,1995(8):444-445.
[3] Kristinsson H G,Rasco B A.Biochemical and functional properties of Atlantic salmon(Salmo salar)muscle hydrolyzed with various alkaline proteases[J].Journal of Agricultural and Food Chemistry,2000,48(3):657-666.
[4] Jia Jian-ping,Zhou Yang-gang,Lu Jian-zhang,et al.Enzymatic hydrolysis of Alaska pollack(Theragra chalcogramma)skin and antioxidant activity of the resulting hydrolysate[J].Journal of the Science of Food and Agriculture,2010,90(4):635-640.
[5] Yang Ping,Ke Hong-qiao,Hong Peng-zhi,et al.Antioxidant activity of bigeye tuna(Thunnus obesus)head protein hydrolysate prepared with Alcalase[J].International Journal of Food Science and Technology,2011,46(12):2 460-2 466.
[6] Bougatef A,Hajji M,Balti R,et al.Antioxidant and free radical-scavenging activities of smooth hound(Mustelus mustelus)muscle protein hydrolysates obtained by gastrointestinal proteases[J].Food Chemistry,2009,114(4):1 198-1 205.
[7] Re R,Pellegrini N,Proteggente A,et al.Antioxidant activity applying an improved ABTS radical cation decolorization assay[J].Free Radical Biology and Medicine,1999,26(9-10):1 231-1 237.
[8] Avellar I G,Magalhaes M M,Silva A B,et al.Reevaluating the role of 1,10-phenanthroline in oxidative reactions involving ferrous ions and DNA damage[J].Biochimica et Biophysica Acta,2004,1675(1-3):46-53.
[9] Yildirim A,Mavi A,Kara A A.Determination of antioxidant and antimicrobial activities of Rumex crispus L.extracts[J].Journal of Agricultural and Food Chemistry,2001,49(8):4 083-4 089.
[10] Decker E A,Welch B.Role of ferritin as a lipid oxidation catalyst in muscle food [J].Journal of Agricultural and Food Chemistry,1990,38(3):674-677.
[11] Yen G C,Chen H Y.Antioxidant activity of various tea extracts in relation to their antimutagenicity [J].Journal of Agricultural and Food Chemistry,1995,43(1):27-32.
[12] Yang P,Ke H Q,Hong P Z,et al.Antioxidant activity of bigeye tuna(Thunnus obesus)head protein hydrolysate prepared with Alcalase[J].International Journal of Food Science and Technology,2011,46(12):2460-2466.
[13] Jia J P,Zhou Y G,Lu J Z,et al.Enzymatic hydrolysis of Alaska Pollack(Theragra chalcogramma)skin and antioxidant activity of the resulting hydrolysate[J].Journal of the Science of Food and Agriculture,2010,90(4):635-640.
[14] Zhang L,Li J R,Zhou K Q.Chelating and radical scavenging activities of soy protein hydrolysates prepared from microbial proteases and their effect on meat lipid peroxidation[J].Bioresource Technology,2010,101(7):2084-2089.
[15] Yaowapa T,Soottawat B,Fereidoon S.Compositions,functional properties and antioxidative activity of protein hydrolysates prepared from round scad(Decapterus maruadsi)[J].Food Chemistry,2007,103(4):1 385-1 394.
[16] Li Y,Jiang B,Zhang T,et al.Antioxidant and free radical-scavenging activities of chickpea protein hydrolysate(CPH)[J].Food Chemistry,2008,106(2):444-450.
[17] Dong X P,Zhu B W,Zhao H X,et al.Preparation and in vitro antioxidant activity of enzymatic hydrolysates from oyster(Crassostrea talienwhannensis)meat[J].International Journal of Food Science and Technology,2010,45(5):978-984.
[18] Raghavan S,Kristinsson H G,Leeuwenburgh C.Radical scavenging and reducing ability of tilapia(Oreochromis niloticus)protein hydrolysates[J].Journal of Agricultural and Food Chemistry,2008,56(21):10 359-10 367.
[19] Zhu K X,Su C Y,Guo X N,et al.Influence of ultrasound during wheat gluten hydrolysis on the antioxidant activities of the resulting hydrolysate [J].International Journal of Food Science and Technology,2011,46(5):1 053-1 059.
[20] Sakanaka S,Tachibana Y,Okada Y.Preparation and antioxidant properties of extracts of Japanese persimmon leaf tea(kakinoha-cha)[J].Food Chemistry,2005,89(4):569-575.
[22] Sitthipong N,Soottawat B,Hideki K,et al.Functionalities and antioxidant properties of protein hydrolysates from the muscle of ornate threadfin bream treated with pepsin from skipjack tuna [J].Food Chemistry,2011,124(4):1 354-1 362.
