酶解法提取紫玉米多糖技术的研究
2012-12-05魏俊青刘晓娟肖春玲
魏俊青,刘晓娟,肖春玲
(山西师范大学工程学院,山西临汾041004)
玉米是世界上产量最高的粮食作物,作为活性多糖的提取原料,它具有明显的优势[1]。紫玉米因其独特的色泽和丰富的营养,成为玉米家族中非常珍稀的品种,其含活性糖量比普通玉米高很多,是提取多糖很好的原料。玉米多糖(corn polysaccharide)具有预防便秘、抗肿瘤、减肥降脂、清热利胆、调节免疫及预防癌症等作用[2],可作为保健食品或保健食品的原料使用,所以越来越受到人们的关注。目前对玉米多糖的研究只是局限于普通玉米的玉米须、玉米皮、玉米芯[3]、玉米花粉和玉米花丝中的多糖等[4],还没有见到关于从紫玉米中提取多糖的报道。大量资料表明,目前多糖的提取主要采用热水浸提、碱浸提、酸浸提等化学方法[5]。随着生物技术的发展,酶的来源愈来愈多[6]。本研究主要用酶解法提取紫玉米多糖,以期为紫玉米的进一步开发利用提供参考。
1 材料和方法
1.1 材料与仪器
紫玉米 2011年9月7日摘采于山西农业科学院玉米研究所;纤维素酶(30u/mg)、果胶酶(50u/mg)、木瓜蛋白酶(300wu/mg) 购于华科生化试剂商城,均为日本原装进口;无水葡萄糖 标准品;无水乙醇、95%的乙醇、浓硫酸、苯酚 为分析纯。
UV-1100型紫外-可见分光光度计 上海隆拓仪器设备有限公司;FA-1004型电子天平 上海精科实业有限公司;pHS-3TC精密数显酸度计 上海沪粤明科学仪器有限公司;RJ-TDL-40C低速离心机 上海比朗仪器有限公司。
1.2 实验方法
1.2.1 酶解法提取紫玉米多糖 紫玉米粒在65℃下烘干后磨粉,过40目筛,称取0.5g置于25mL蒸馏水中混匀。在紫玉米粉的浑浊液中加3mL的酶溶液于水浴锅中反应2h后将温度调至90℃,静置30min促使酶钝化。然后在3000r/min的条件下离心10min,取出上清液,加入95%的乙醇,静置一晚上,使其充分沉淀[7]。吸出上清液,将剩下的液体在3000r/min的条件下再次离心15min。沉淀用无水乙醇洗涤,干燥后就可以得到粗多糖,称其质量[8]。最后,将粗多糖溶解稀释,测其吸光度。
1.2.2 多糖含量的测定 紫玉米粉多糖的含量采用苯酚硫酸法[9]。以葡萄糖标准溶液为标准品。建立的回归方程为:y=0.0567x-0.0032(0~14μg/mL,R2=0.9998),其中y表示吸光度,x表示葡萄糖浓度。多糖的得率(%)=粗提物中含有的多糖质量/最初紫玉米粉的质量×100。
1.2.3 选择酶类型 选用果胶酶、纤维素酶、木瓜蛋白酶,采用单一加入[10]、混合加入和分步加入的组合方法[11],在同一条件下对相同的样液进行处理,得出最佳的酶组合。通过所购买的酶的说明介绍得知纤维素酶的适宜温度为45~60℃,pH为4.0~5.5;果胶酶的适宜温度为45~50℃,pH为3.0~6.0;木瓜蛋白酶的适宜温度为60℃左右,pH为4.5~7.0。为了保证3种酶在实验中的活性,综合考虑它们的适宜条件,选择50℃、pH5.0为酶解液的条件[12]。然后按照步骤1.2.1进行实验。
1.2.4 酶法提取多糖 在3个样液中分别加入3种不同的酶液各3mL来提取多糖;混合酶法提取紫玉米多糖:混合酶是由这3种酶各1mL混合,再加入到样液中用来提取多糖;分步酶法提取多糖:1mL纤维素酶、果胶酶、木瓜蛋白酶依次加入同一个样液进行处理来提取多糖[10]。
1.2.5 紫玉米提取工艺的优化 在不同pH、酶解温度、酶解时间、酶浓度[13]单因素实验结果的基础上,用Design-Expert 8.0软件对其中重要的3个因素进行响应面分析,进一步优化紫玉米多糖的提取工艺参数。各因素水平及编码见表1所示。

表1 实验因素水平及其编码Table 1 Factors and levels of response surface experiment
2 结果与分析
2.1 酶种类的选择
图1为3种不同类型酶的单一提取法、混合提取法和分步提取法得出的紫玉米多糖的得率。由图1看出,分步酶法具有一定的优势。因此,在后面的实验中选择用分步酶法来进行多糖的提取实验。
2.2 分步酶组合提取紫玉米多糖的单因素实验
2.2.1 不同pH对紫玉米多糖得率的影响 固定酶浓度0.03mg/mL、酶解温度50℃、酶解时间2h[14]的条件下,分别采用不同的酶解 pH4.0、4.5、5.0、5.5、6.0、6.5,按1.2.1操作,研究提取多糖的最适pH。结果见图2。由图2看出,紫玉米多糖的得率在pH5.5时最大,pH继续增大得率反而下降,酶对pH的变化表现出很高的敏感度,如果酶反应的pH偏离了某个适宜范围,活性就会降低。据此,选出的最适pH为5.5。
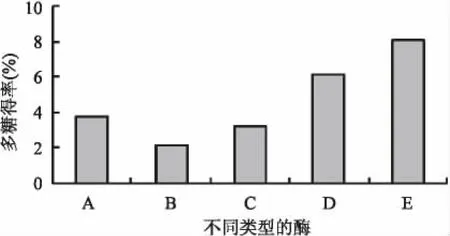
图1 不同种类酶对紫玉米多糖得率的影响Fig.1 Yields rate of polysaccharide of using different enzymatic hydrolysis
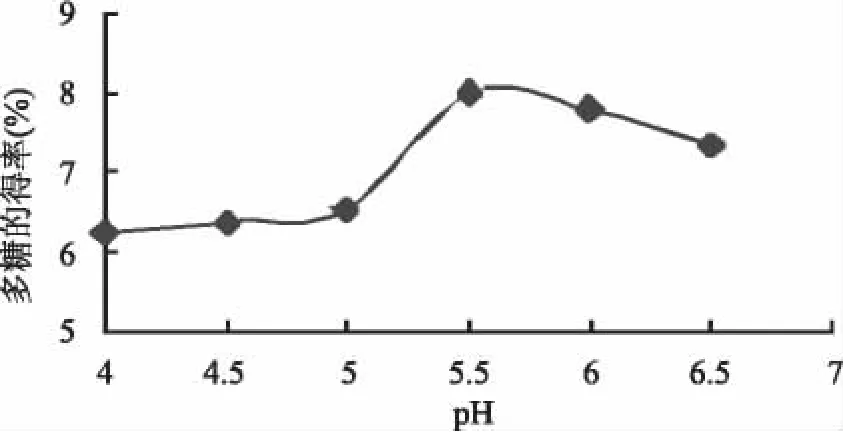
图2 pH与紫玉米多糖得率的关系Fig.2 Relationship of enzymatic hydrolysis of pH and the yield rate of polysaccharide
2.2.2 不同酶解温度对紫玉米多糖得率的影响固定酶浓度为0.03mg/mL、pH5.5、酶解时间2h的条件下,分别采用不同的酶解温度30、40、50、60、70、80℃,按1.2.1操作,研究提取多糖的最佳温度。结果见图3。由图3看出,温度在60℃时得率最大,而后随着温度的继续升高,得率反而降低。可能是因为温度除了影响反应中多糖的浸出速度,而且还影响着加入的酶的活性的大小。温度升高,酶活性增加,促使多糖溶出。但是超过60℃后,酶活性可能会降低,继续升高温度,甚至会丧失活性,表现为得率降低。因此紫玉米多糖的最佳酶解温度为60℃。
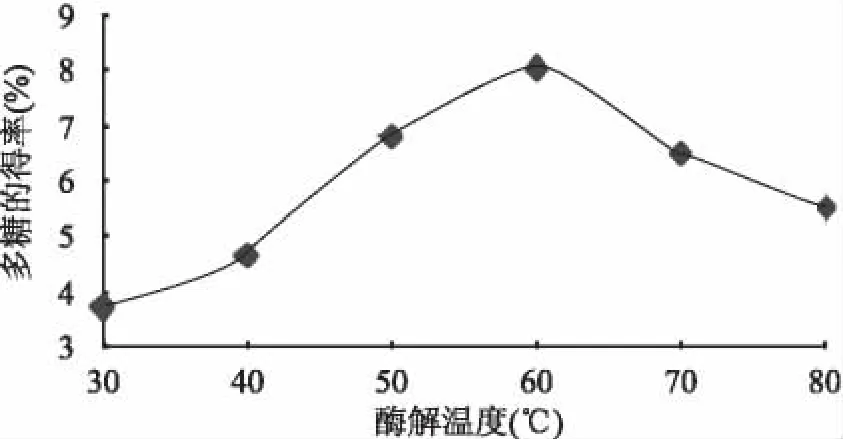
图3 酶解温度与紫玉米多糖得率的关系Fig.3 Relationship of temperature and the yield rate of polysaccharide
2.2.3 不同的酶解时间对紫玉米多糖得率的影响固定酶浓度0.03mg/mL、pH5.5、60℃的条件下,分别采用不同的酶解时间 1、2、3、4、5、6h 研究提取多糖的最佳时间。按1.2.1操作,由图4看出,多糖的得率随着酶解时间的延长呈现出上升的趋势,当时间为3h时,得率最高,继续延长时间,得率反而下降。分析原因,可能是酶的量在逐渐减少,不足以维持反应的进行。通过对实验结果的分析,而且考虑到时间的效率和有限性,最后选择3h为最佳酶解时间。
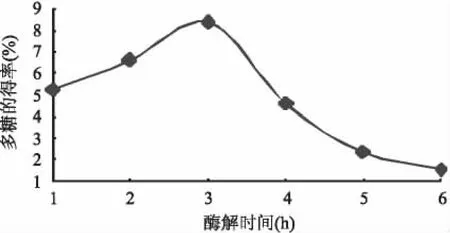
图4 酶解时间与紫玉米多糖得率的关系Fig.4 Relationship of extraction time and the yield rate of polysaccharide
2.2.4 不同酶浓度对紫玉米多糖得率的影响 固定pH5.5、60℃、3h的提取条件,分别采用不同的酶浓度0、0.01、0.02、0.03、0.04、0.05mg/mL,以确定最佳的酶浓度。按1.2.1操作,结果见图5。由图5看出,多糖得率在酶浓度为0.03mg/mL时最大,然后又出现回落趋势。通过实验结果,可得最佳酶浓度为0.03mg/mL。
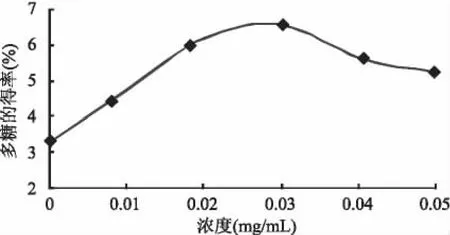
图5 酶浓度与紫玉米多糖得率的关系Fig.5 Relationship of enzyme dosage and the yield rate of polysaccharide
2.3 响应面优化
2.3.1 响应面优化设计结果 综合上述的实验结果,当最适酶浓度在0.03mg/mL附近时,它的变化对多糖的得率没有引起太大的影响,因此选择对多糖得率产生影响较大的pH、酶解温度和酶解时间,进行响应面实验设计。并应用软件Design Expert 8.0来分析处理数据,实验结果见表2。
利用Design-Expert 8.0软件对该实验结果进行响应面分析,通过回归拟合,得到了pH(X1)、酶解温度(X2)、酶解时间(X3)这3个因素与紫玉米多糖得率Y的回归方程Y=8.42+0.41X1+0.23X2-0.37X3-0.39X1X2-0.045X1X3-0.45X2X3-1.55X12-对回归模型进行方差分析结果见表3。由表3可知,回归模型p<0.0001,表示该模型高度显著,可以用来进行响应值预测,而模型失拟项不显著,证明该模型选择合适。校正决定系数0.9614,表示该模型能解释96.14%的响应值变化,相关系数R2=0.9831,说明该模型的拟合度良好,表明该模型是可行的,可以用来预测紫玉米多糖的得率。
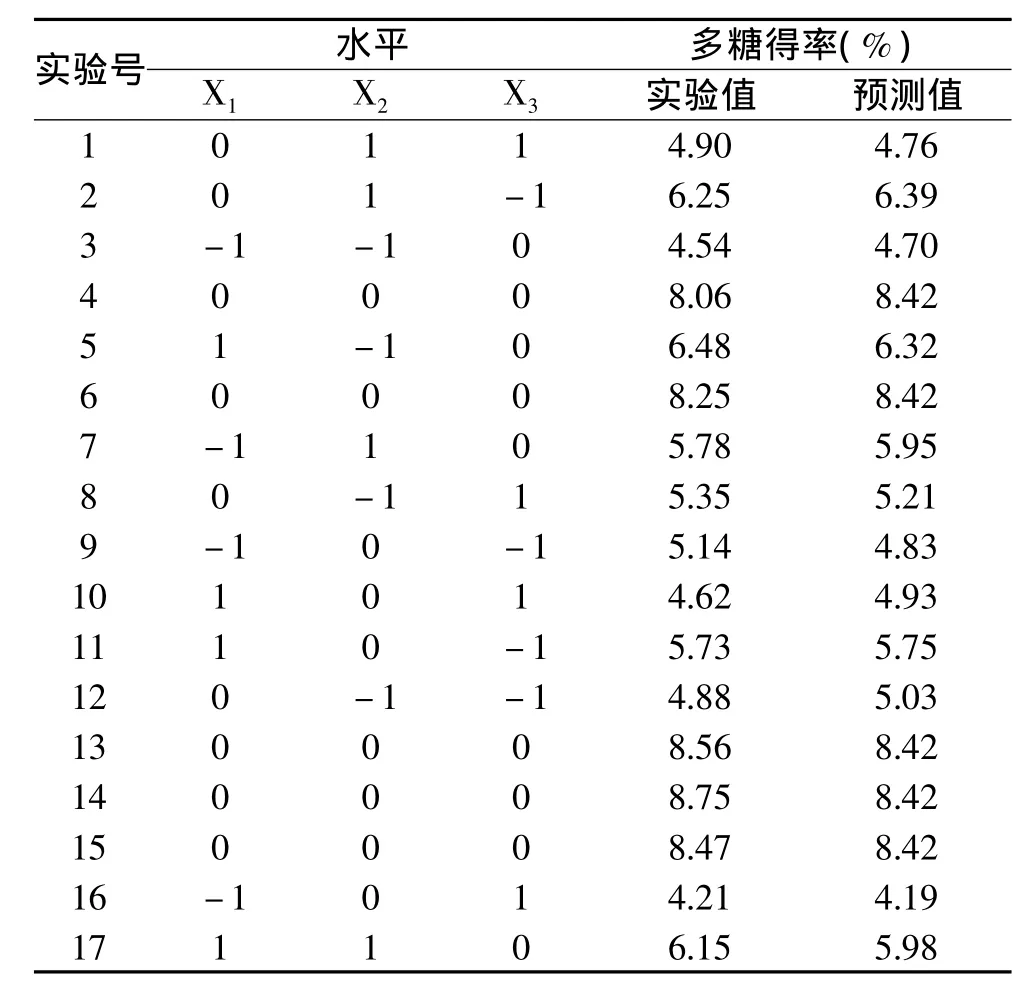
表2 响应面设计方案与实验结果Table 2 Response surface design and results
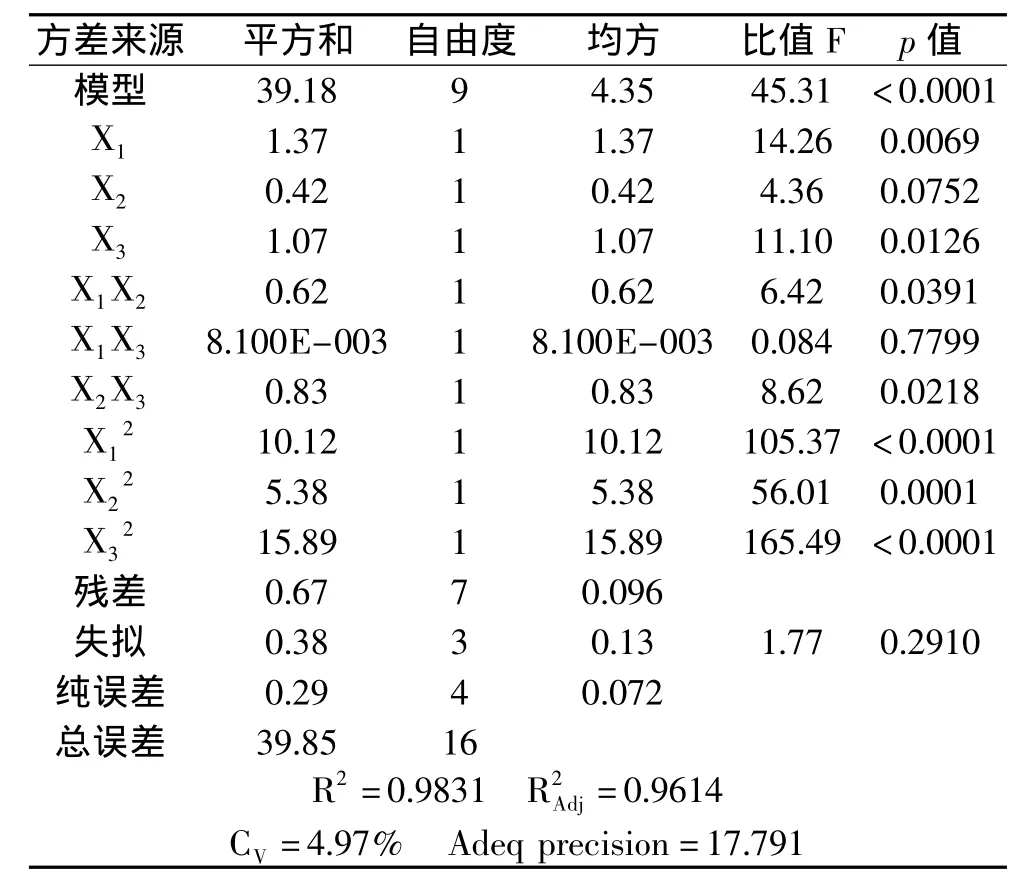
表3 回归模型方差分析表Table 3 Variance analysis of regression equation
因素X1(pH)对紫玉米多糖得率的影响的线性效应p<0.01,是极显著的,X3(酶解时间)产生的影响是显著的,而X2(酶解温度)不显著。X1X2、X2X3对多糖得率的交互影响是显著的,而X1X3不显著,但的曲面效应都极显著。说明各个因素与响应值之间没有表现出简单的线性关系。可以由单因素F值的大小判断各因素对多糖得率的影响顺序。由此得出对多糖得率影响强弱的顺序为pH>酶解时间>酶解温度。
2.3.2 双因素间的交互作用的分析 由表3可知:本实验所建立的数学回归模型中,在α=0.05水平上,X1与X2、X2与X3交互作用显著,而X1与X3交互作用不显著。依据实验所取得的数据,作出X1与X2、X2与X3三维空间响应面图,据此可分析和评价双因素交互作用的影响,如图6所示,其中的Y表示多糖得率。由图6可以看出,时间一定时,pH与酶解温度的交互作用比较显著,当酶解时间在零水平上时,即3h时,随着pH与酶解温度的变大,得率显著增加,之后呈下降趋势,坡度较缓;当pH在零水平上时,即为5.5时,酶解温度与酶解时间的交互作用表现显著。响应值随着酶解温度和酶解时间的缓慢增加而增加,当达到最大值之后,多糖的得率反而随着条件的增加而下降。经软件分析酶法提取紫玉米多糖的最佳条件:pH5.62,酶解温度60.10℃,酶解时间2.83h(约170min),在此条件下,紫玉米多糖得率的理论值为8.47%。综合实际操作,紫玉米多糖最佳提取条件为:pH5.5、酶解温度 60℃、酶解时间170min,最后进行三次验证多糖的实际得率为8.42%,与理论值的贴近度达99.41%。
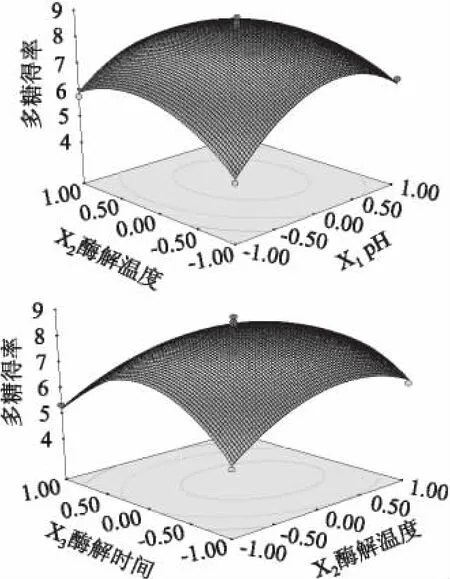
图6 不同因素交互作用对紫玉米多糖得率的影响Fig.6 Effect of interaction of different factors on polysaccharide content from purple corn
3 结论
实验以紫玉米为原料,从酶组合、pH、酶解温度、酶解时间、酶浓度这五个方面考虑多糖的得率。首先筛选出了分步法是最好的酶组合方法。在单因素实验的基础上,对提取参数采用响应面实验进行分析优化,所得结果为:紫玉米多糖最佳提取条件为pH5.5、酶解温度60℃、酶解时间170min,最后进行三次验证多糖的实际得率为8.42%,与理论值的贴近度达99.41%。由响应曲面和等高线图可知,pH、酶解温度、酶解时间对多糖得率的影响的强弱顺序依次为pH>酶解时间>酶解温度。
[1]吴谋成.玉米花粉多糖的分离、纯化、结构鉴定及抗氧化活性的研究[D].武汉:华中农业大学,2005.
[2]张艳荣,张雁南,王大为.玉米活性多糖的抗便秘作用[J].吉林大学学报:医学版,2005,31(4):509-511.
[3]张静文,张风清,张培刚,等.玉米芯多糖得提取及其单糖组成研究[J].食品工业科技,2010,31(3):241-244.
[4]何余堂,潘孝明,王兵兵.玉米花丝多糖的酶法提取研究[J].食品科技,2010,35(3):230-232.
[5]张守文,孟庆虹,杨春华,等.玉米抗性淀粉酶解法制备工艺的研究[J].中国粮油学报,2007,22(5):53-56.
[6]付宏媛,张坤生,任云霞.酶解法提取甘薯多糖技术研究[J].中国食品学报,2008,8(2):133-137.
[7]孟志芬.木瓜蛋白酶酶解法提取大枣多糖的工艺研究[J].河南科技学院学报,2006,33(4):49-50.
[8]李桂峰,王向东,赵国建,等.酶解双孢菇蛋白制备抗氧化肽的研究[J].中国食品学报,2011,11(5):43-49.
[9]杨勇杰.苯酚-硫酸法测多糖含量研究[J].中成药,2005,29(8):706-708.
[10]程俊文,吴学谦,贺亮,等.香菇子实体多糖酶解法提取研究[J].食用菌学报,2009,16(2):67-71.
[11]董晶晶,李晓坤,杨云.首乌藤多糖酶法提取工艺研究[J].中国现代应用药学,2011,28(6):519-523.
[12]ZHANG C,ZHU Y C,ZHOU D Z.Study on enzymatic extraction of polysaccharide from Banqiao Codonopsis pilosulc[J].Food Sci,2008,29(11):30.
[13]刘骅,吴月国,张萍.酶法在石斛多糖提取中的应用[J].中药标准与质量控制,2010(3):392-395.
[14]杨靖,李硕,陈大勇,等.正交实验法筛选蛤蟆油粗多糖酶解提取工艺的研究[J].吉林农业大学学报,2011,33(4):11-16.
