制备工艺对西番莲种子膳食纤维理化性质影响的比较研究
2012-12-05陈良云蒋琳兰
陈良云,蒋琳兰
(1.华南理工大学生物科学与工程学院,广东广州510640;2.广州军区广州总医院药剂科,广东广州510010)
膳食纤维是一种不能被人体的消化酶消化、也不被小肠吸收的以多糖为主体的高分子物质的总称,并被誉为21世纪食品工业中最受关注,具有特殊保健功能和食品改性作用的一种食品添加剂。随着社会的发展和生活水平的提高,人们在膳食结构中对高热量、高蛋白和高脂肪食品和精细食品摄入量大大增加,肥胖症、高血压、高血脂、脂肪肝、糖尿病等现代“富贵病”越来越普遍。膳食纤维能够平衡人体营养,调节机体功能,被列为继糖、蛋白质、脂肪、水、矿物质和维生素传统的六大营养素之后的“第七大营养素”[1]。西番莲(Passiflora edulis Sims)为西番莲科西番莲多年生藤本植物,别名百香果、鸡蛋果,是著名的热带水果,有“果汁之王”的美誉。在我国台湾、广东、福建、海南、云南南部及四川攀西等地已有很长的种植历史,并形成了一定的商业规模,被誉为第三代新兴果树[2]。西番莲在我国主要应用于果汁加工工业,其种子往往作为废弃物被加工厂丢弃,造成大量的资源浪费[3]。本实验分别用酶法和化学法对西番莲种子膳食纤维进行提取、改性,并对其性质进行分析比较,以期为西番莲种子和相关膳食纤维食品的研究开发提供参考。
1 材料与方法
1.1 材料与仪器
紫果西番莲种子 采自于广东省五华县,来源稳定;耐高温α-淀粉酶、胆固醇 阿拉丁试剂公司;木瓜蛋白酶,800u/mg、淀粉葡萄糖苷酶 威佳科技,100u/mg,货号:1098923;2-N-吗啉代-乙烷磺酸(MES)(超纯级)、三羟甲基氨基甲烷(Tris) 威佳科技;胆酸钠 晶欣生物科技公司;柠檬酸 天津市福晨化学试剂厂;金福鱼牌花生油 市售;猪油 自制;其他试剂均为市售分析纯。
SX2箱式电炉 山海金沪电热仪器联营厂;KPQ-1200型超声波清洗器 广州市科普超声电子技术有限公司;SHZ-DⅢ循环水式真空泵 巩义市予华仪器有限责任公司;PHS-3D型pH计 上海精密科学仪器有限公司;KGN-102F自动定氮仪 上海纤检仪器有限公司;YPJ-337型紫外可见分光光度计 北京莱伯泰科仪器有限公司;BP210S型分析天平 Sartorius公司;HH-2数显恒温水浴锅 金坛市富华仪器有限公司。
1.2 实验方法
1.2.1 西番莲种子膳食纤维的提取
1.2.1.1 化学法制备西番莲种子膳食纤维 50g种子洗净,干燥,粉碎,石油醚脱脂3 次(1∶40,mg/mL),每次1h,回收石油醚,加入15倍体积的3%柠檬酸溶液,调节 pH3.0,超声提取 50min(40℃,1200W),过滤,残渣70℃碱溶1h,过滤合并2次滤液,浓缩后用4倍体积的95%乙醇室温沉淀,干燥即得可溶性膳食纤维;滤渣用蒸馏水洗至中性,干燥即得不可溶性膳食纤维。
1.2.1.2 酶法制备西番莲种子膳食纤维 按1.2.1.1进行脱脂,加柠檬酸溶液超声提取30min(40℃,1200W),调节pH至中性,加入100μL耐高温α-淀粉酶,于85℃水浴20min,冷却至65℃,加入50mg/mL木瓜蛋白酶溶液1mL,65℃水浴30min,过滤,滤渣水洗至中性,干燥即得不可溶性膳食纤维;滤液浓缩后用4倍体积的95%乙醇沉淀,干燥后得可溶性膳食纤维。
1.2.2 膳食纤维的化学成分分析 灰分含量的测定:采用GB/T5009.4.2003灼烧称量法;粗蛋白含量的测定:采用GB/T5009.5.2003凯氏定氮法;粗脂肪含量的测定:采用GB/T5009.6.2003索氏抽提法;膳食纤维含量的测定:采用AOAC991.43酶-重量法;水分含量的测定:采用GB 5009.3-2010直接干燥法。
1.2.3 膳食纤维物理性质测定 膨胀力的测定参考文献[4];持水力的测定参考文献[5];结合水力的测定参考文献[6];脂肪结合能力的测定参考文献[7]。
1.2.3.1 胆酸盐体外吸附实验[8]胆酸钠标准曲线的绘制:精确称取胆酸钠0.1000g,用蒸馏水溶解并定容至50mL,得到浓度为2mg/mL的对照液。准确吸取0、1.0、2.0、4.0、6.0、8.0mL 对照液至 10mL 容量瓶中,加蒸馏水至刻度得到浓度分别为0、0.2、0.4、0.8、1.2、1.6mg/mL的稀释液。分别吸取lmL不同浓度的胆酸钠稀释液于10mL比色管中,分别加入6mL 45%硫酸,混匀后加入lmL 0.3%糠醛溶液,混匀,置于65℃恒温水浴中反应30min,冷却至室温,以0号管为参比,在620nm处测定吸光度,以胆酸钠浓度为横坐标,吸光值为纵坐标绘制标准曲线。
1.2.3.2 膳食纤维吸附胆酸钠能力的测定 准确称取1.00g样品于250mL锥形瓶中,加入分别含0.05、0.10、0.15g胆酸钠的 0.15mol/L NaCl溶液 100mL,用0.1mol/L HCl溶液调节pH7.0,37℃恒温下电磁搅拌反应2h,4000r/min离心20min,后移取1mL样液测定其中的胆酸钠的含量,同时做空白实验。根据反应前后溶液中胆酸钠的含量差异计算出样品对胆酸钠的吸附量。
1.2.3.3 胆固醇体外吸附实验[9]胆固醇标准曲线的绘制:分别精确吸取0.3mg/mL胆固醇标准溶液0.00、0.05、0.16、0.32、0.48、0.64mL 于比色管中,加入冰乙酸至0.80mL,然后依次加入1mg/mL邻苯二甲醛0.4mL及混合酸(浓硫酸∶冰乙酸=1∶1)8.0mL,静置15min,于550nm处测定各标准管的吸光值。以吸光值为纵坐标,胆固醇含量(μg)为横坐标绘制标准曲线。
样品对胆固醇吸附能力测定:取市售鲜鸡蛋蛋黄,加入9倍量的蒸馏水充分搅打混匀成乳液。取1.00g样品于250mL的锥形瓶中,加入50mL稀释蛋黄液,搅拌均匀,分别调节体系pH至2.0和7.0,置摇床中,37℃水浴振荡4h,4000r/min离心30min,吸取0.1mL上清液,采用邻苯二甲醛法在550nm测定胆固醇含量。
1.2.4 实验相关指标计算 根据式(1)~式(2)计算各膳食纤维得率及膳食纤维净产率:

1.3 实验数据处理
显著性采用 SPSS 17.0 Independent-Samples T test进行。图表中同一列(行)字母a、b不同表示有显著性差异,取显著性水平p<0.05,用“*”表示,取极显著性水平p<0.01,用“**”表示。
2 结果与分析
2.1 膳食纤维得率和外观形状
由表1可知,制备工艺对膳食纤维的感官和得率影响较大:酶法制备的膳食纤维在粒径分布和粗糙程度方面具有较大的优势,它可以减小颗粒粒径,使其颗粒分布均匀。其次,酶法制备的膳食纤维得率比化学法的高出10%,可溶性膳食纤维得率比后者高出53%,而可溶性膳食纤维含量是衡量膳食纤维品质的一个重要指标,这说明酶法制备的膳食纤维具有较优的品质。

表1 两种方法制备的种子膳食纤维外观形态和得率比较Table 1 The comparison between two kinds of dietary fibers on appearance and yield
2.2 膳食纤维的化学组成分析
由表2看出,西番莲种子膳食纤维含量丰富,是一种潜在的膳食纤维资源。酶法制备的产品蛋白含量比化学法的高出22.8%,这一方面可能是因为酸碱对蛋白质的变性程度更剧烈且选择性小,而木瓜蛋白酶具有一定的专一性,另一方面由于蛋白质网络中包裹着淀粉颗粒,淀粉高温糊化,同时蛋白质受热后凝固,阻止蛋白酶与酶的反应,使得蛋白质去除不彻底[10]。而对于膳食纤维含量方面,酶法制备的样品纯度较高,其TDF含量为81.44%,而化学法的为74.71%。但结合得率因素来看,酶法所得的TDF和SDF的净产率分别为60.31%、2.98%,而化学法的TDF和SDF的净产率分别为50.21%、2.48%,由此可见酶法提取的膳食纤维净产率明显高于化学法的。这可能是因为样品经过酸碱处理后,仅可保留20%的半纤维素,10%~40%的木质素,50%~90%的纤维素,损失了大部分的可溶性膳食纤维和部分的不可溶性膳食纤维[11]。

表2 两种方法制备膳食纤维的化学成分比较(g/100g)Table 2 The comparison of chemical constituents of the two kinds of dietary fibers(g/100g)
2.3 膨胀力的测定
由图1可知,西番莲种子膳食纤维具有较低的膨胀力,且随着时间的延长而增加,化学法制备的样品的膨胀力明显高于酶法的,且在4h时两者的差异具有显著性,这与之前的大多数报道不相一致。这可能是由于西番莲种子脂肪含量过高,使更多的疏水性基团暴露,使干燥后相同目数的纤维颗粒溶于水后能充分伸展产生更大的容积,表现为膨胀力的增大减小,而酸碱处理可以使这些亲水基团发生改变。

图1 膨胀力的比较Fig.1 The comparison of swelling capacity
2.4 持水力测定
从图2可以看出,酶法制备的膳食纤维比化学法的具有较好的持水力,可能一方面是因为它含有更高的可溶性膳食纤维含量,另一方面可能是因为酶解可以使膳食纤维结构变得疏松,粒径减小而均匀,颗粒的比表面积、表面能和孔隙率均增大,更多的纤维素和半纤维素转化为可溶性成分,因而亲水基团暴露出来[12]。在24h时,酶法所得膳食纤维的持水力是2.87g/g,化学法制备的为2.06g/g,此时两者具有显著性差异,这说明提取工艺对膳食纤维的持水力影响较大。
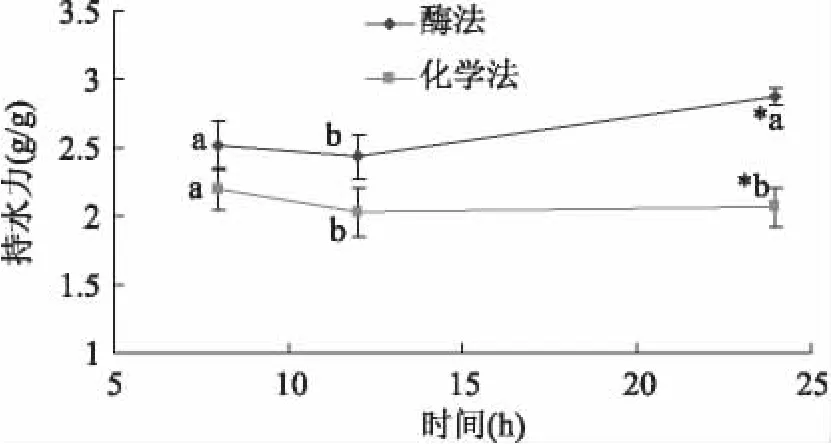
图2 持水力的比较Fig.2 The comparison of water-holding capacity
2.5 结合水力的测定
相对于化学法,酶法制备的膳食纤维的结合水力对时间较为敏感,随着时间的延长有很大的提高。这一方面可能是因为酶法制备的膳食纤维的颗粒粒径较小,分子网格排列紧密,水分子不能迅速结合到亲水基团,而化学法在一定程度上破坏了分子微观结构,另一方面是因为酶法制备膳食纤维的可溶性膳食纤维和蛋白质含量较高,网状结构中含有更多的半乳糖醛酸等亲水性基团。由图3所示,在4h时,化学法制备的膳食纤维结合水力为3.36g/g,酶法的是2.48g/g,随着时间延长到6h时,后者略高于前者。

图3 结合水力的比较Fig.3 The comparison of water-bonding capacity
2.6 脂肪结合能力的测定
由图4可知,不同方法制备的膳食纤维对不同脂肪酸的吸附能力具有较大差异:从总体上看,西番莲种子膳食纤维对饱和脂肪酸的吸附力高出对不饱和脂肪酸的吸附力高达22%;对于不饱和脂肪酸吸附力而言,化学法提取的膳食纤维比酶法制备的膳食纤维高出近11%;而在饱和脂肪酸的吸附能力方面,酶法制备的膳食纤维较化学法制备的膳食纤维吸附力强,且差异具有显著性。
2.7 胆酸钠体外吸附实验

图4 脂肪结合能力的比较Fig.4 The comparison of fat-bonding capacity
由图5可知,胆酸钠标准溶液在0~1.6mg/mL质量浓度范围内与吸光度值线性关系良好。从图6可以看出,西番莲种子膳食纤维的胆酸钠吸附能力高于已经报道的多数膳食纤维。当胆酸钠浓度为0.05g/100mL时,酶法制备的膳食纤维的吸附量为17.52mg/g,化学法制备的膳食纤维吸附量为25.89mg/g,后者高出前者48%,且差异极具显著性,这说明提取方法对胆酸钠浓度为0.05g/100mL时的膳食纤维吸附力影响明显。随着胆酸钠浓度的提高,膳食纤维的吸附力发生一定的变化,当胆酸钠浓度为0.15g/100mL时,酶法制备的膳食纤维的吸附量为77.01mg/g,吸附力提高4倍多,化学法制备的膳食纤维吸附量为51.48mg/g,吸附力提高约2倍,前者高出50%,这说明体系中胆酸钠浓度也是影响膳食纤维吸附能力的一个重要影响因素。

图5 胆酸钠紫外吸收标准曲线Fig.5 The standard curve of the adsorption of sodium cholate
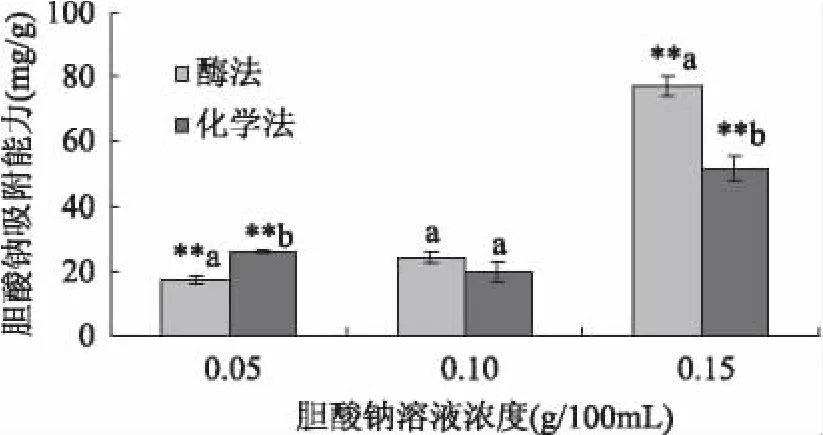
图6 胆酸钠吸附能力比较Fig.6 The comparison of sodium cholate adsorption
2.8 胆固醇体外吸附实验
由图7~图8可知:在中性条件下(模拟小肠的pH环境),各膳食纤维对胆固醇的吸附力均高于酸性条件下(模拟胃的酸碱条件)的吸附能力,这与张宁等报道的大豆、小麦和水果膳食纤维相一致[13]。当pH2时,酶法制备的膳食纤维吸附力为4.69mg/g,高出化学法13%;当pH7时,化学法所得膳食纤维吸附力为7.47mg/g,略高于酶法的7.16mg/g,这说明制备工艺对西番莲种子膳食纤维的胆固醇吸附能力影响不明显。

图7 胆固醇紫外吸收标准曲线Fig.7 The standard curve of the adsorption of cholesterol

图8 胆固醇吸附能力比较Fig.8 The comparison of cholesterol adsorption
3 结论
化学法方法简单,易操作,水解彻底;但非特异性,且需要高碱高酸的条件,对设备要求高;在去除杂质的同时也对膳食纤维造成破坏,而且会污染环境;而酶法处理反应条件温和,专一性强,不会影响膳食纤维的产量和质量,但要求严格的工艺条件且生产成本较高。本实验比较了两种方法对制备西番莲种子膳食纤维物化性质的影响:
3.1 酶法制备的膳食纤维粒径均匀,质地细腻、柔软,粗蛋白和脂肪含量较高;化学法制备出的样品颗粒较大,较粗糙,灰分含量较高。
3.2 酶法提取膳食纤维的净产率为60.31%,SDF净产率为2.98%,化学法的分别为50.21%、2.48%,由此可见酶法制备的膳食纤维不仅产率较高,且SDF含量高。
3.3 两种方法制备出的膳食纤维在物化性质方面各具优势:酶法制备的膳食纤维的持水力、饱和脂肪结合能力、胆酸钠吸附能力都高于化学法的,而化学法制备的样品在膨胀力、结合水力、不饱和脂肪酸结合力方面较有优势,在对胆固醇吸附能力上两者差异不大。
[1]艾仄宜,张洁,杨晓萍.茶叶非水溶性膳食纤维的提取及其理化特性研究[J].食品科学,2010,31(8):121-124.
[2]Ingale A G,Hivrale A U.Pharmacological studies of Passiflora sp.and their bioactive compounds[J].African Journal of Plant Scienc,2010,4(1):417-426.
[3]郑文武,郑颂,刘华.我国西番莲生产现状及发展探讨[J].中国热带农业,2008(6):8-9.
[4]FEMENIA A,LEFEBVR C,THEBAUDIN Y,et al.Physical andsensory properties of model foods supplemented with cauliflower fiber[J].Journal of Food Science,1997,62(4):635-639.
[5]ESPOSITO F,ARLOTTIB G,BONIFATI A M,et al.Antioxidant activity and dietary fibre in durum wheat bran by products[J].Food Research International,2005,38(10):1167-1173.
[6]郑刚,何李,赵国华.高压蒸煮对苹果膳食纤维理化特性及发酵性能的影响[J].食品与发酵工业,2009,35(5):90-93.
[7]Sangnark A,Noomhorm A.Effect of particle sizes on function properties of dietary fibre prepared from sugarcane bagasse[J].Food Chemistry,2003,80:221.
[8]胡国华,黄绍华.米糠膳食纤维对胆酸钠吸附作用的研究[J].中国食品添加剂,2001(2):10-12.
[9]陈亚飞,赵谋明.水溶性与水不溶性膳食纤维对油脂、胆固醇和胆酸钠吸附作用研究[J].现代食品科技,2005(3):58-60.
[10]李鹏飞,陆红佳,任志远.不同方法提取麦麸膳食纤维的比较研究[J].现代农业科学,2009,16(6):7-9.
[11]吴生文,高红娟,张水华.工业中药渣的膳食纤维含量研究分析[J].现代食品科技,2008,24(9):940-942.
[12]何李,李灿明,李绍振.高制备工艺对果渣膳食纤维水合性质的影响[J].食品工业科技,2012,33(3):186-190.
[13]张宁,欧仕益,黄才欢.膳食纤维对有害元素吸附的研究[J].食品研究与开发,2006,27(8):163-166.
