单增李斯特氏菌快速检测方法的建立
2012-12-02刘旸张海英刘国红张宏伟张霞
刘旸,张海英,刘国红,张宏伟,2,张霞,2,*
(1.天津出入境检验检疫局,天津 300461;2.天津科技大学,天津 300457)
单核细胞增生李斯特氏菌(Listeria monocytogenes)(L.mon)简称单增李斯特氏菌,是一种重要的人兽共患病病原体,感染人和多种动物,引起人和动物脑膜炎、败血症、流产等症状。该菌也是一种最为常见的食源性病原菌,WHO将其列为20世纪90年代食品中四大致病菌之一。它在自然界中分布广泛,4℃的环境中仍可生长繁殖,是冷藏食品威胁人类健康的主要病原菌之一,极易污染食品而引起食物中毒和李氏杆菌病的暴发,尤其是在欧美国家经常发生[1-3],给人类的健康及畜牧业的生产带来严重的威胁,所以建立快速准确的检测方法是保证食品卫生安全和有效防治本病的重要手段。
目前对该菌的检测主要有分离培养方法、免疫学方法[4]及PCR方法[5]等。分离培养法操作步骤繁琐,检测周期长,一般需要5 d~7 d完成,不能满足快速检测的要求[6],免疫学方法具有操作简单,检测通量大的优点,但是由于该菌与同属异种菌具有交叉抗原,免疫学方法不能进行李斯特氏菌种间特异性鉴定[7],而且检测结果容易受多种因素影响,容易出现假阳性,不能满足检测的要求。PCR方法具有特异性强、灵敏度高等特点,但这类方法通常检测成本高,需要比较昂贵的PCR仪,对实验环境和操作者技术要求也比较高,常引起非特异性扩增,扩增反应时间较长,一般需要几小时,不利于快速检测和基层实验室推广应用。因此,发展新的快速准确、操作简便、成本低廉的检测与鉴定单增李斯特氏菌的方法对于提高食品卫生水平、保证食品安全具有重要的意义。
1 材料
1.1 主要材料与试剂
dNTPs (Fermentas),10×Bst buffer(New England Biolabs),Bst DNA polymerase large fragment(New England Biolabs),MgSO4(Sigma),betaine(Sigma),核酸快速检测试纸条(杭州优思达公司)。
菌株采用单增李斯特氏菌10株,包括2株标准菌株、食品中分离出的野生株8株及6株其他李斯特氏菌属菌株,24株食源性致病菌详见表1。
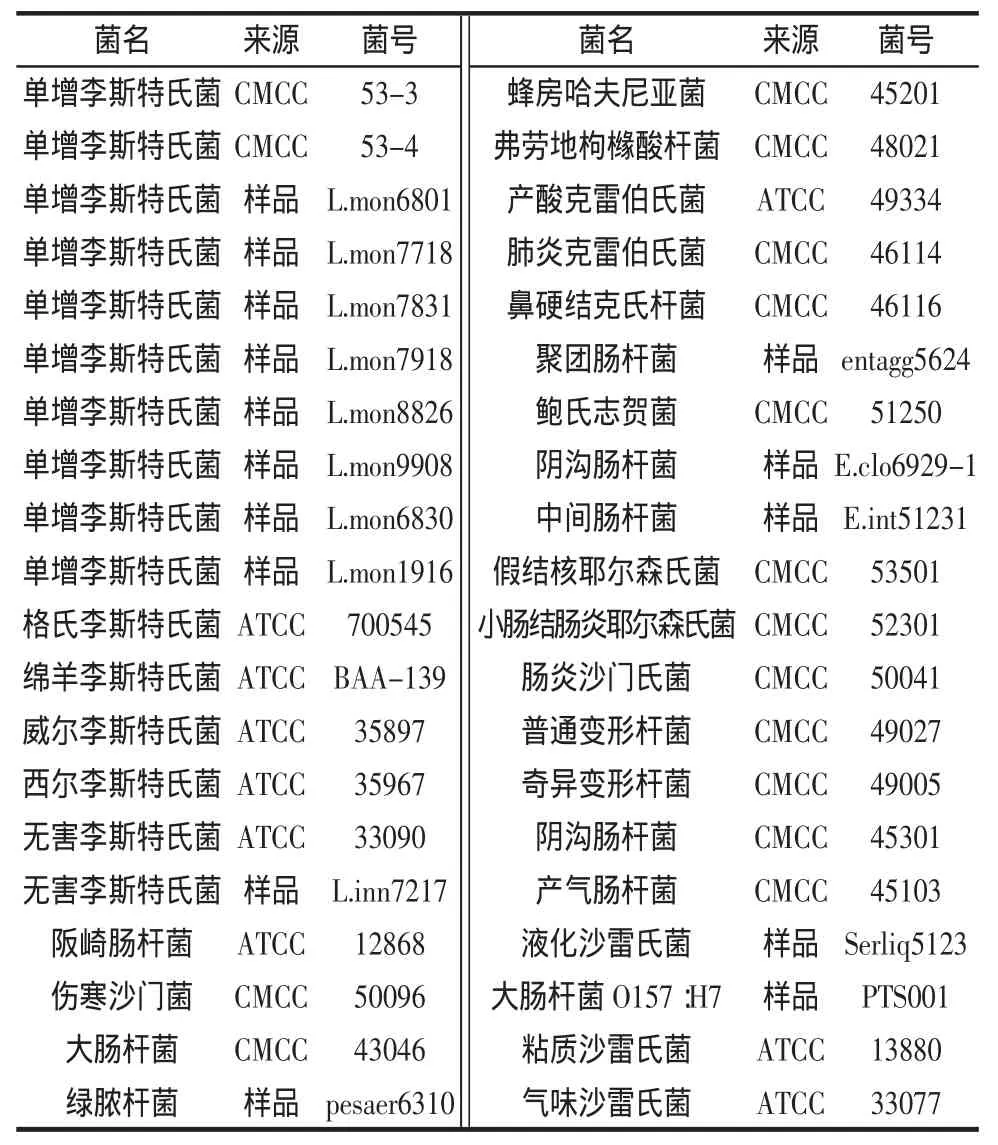
表1 试验菌株Table 1 Bacterial strains for detection
1.2 主要仪器与设备
PCR扩增仪(Biometra)、离心机(Eppendorf,5417R)、DNA/RNA/蛋 白 分 析 仪(BHIMUZDA,Bio Specmini)。
2 方法
2.1 DNA的提取及定量
单增李斯特氏菌C53-3为试验菌株,接种于10 mL营养肉汤中,37℃培养16 h,取1 mL用于细菌基因组提取,利用紫外分光光度计检测DNA质量及纯度。
2.2 引物及探针的设计
利用单核细胞增生李斯特氏菌vir R基因序列(accession no.DQ449868.1)设计特异性引物及探针为:D1:5 -BIOTIN -GTCGGTCAATTGCAAAGAG;D2:5 -FITC-CTAGCCTGTGCCAAAGCA;D3:5-BIOTINTTATCATGCAAGTGCGAAC;CPR:5-GTCGGTCAATTG CAAAGAGACTTGATTAATATATAATTAGCCGTT;F:5-GTACACAGAAAAGCGCTG;R:5-TAGGCAAGTCATCT TGTTC。
组成两套扩增体系,第一套扩增体系为CPR+F+R+D2+D1,第二套扩增体系为CPR+F+R+D2+D3。
2.3 反应体系和反应条件
反应体系为:10×ThermoPol buffer 2μL,10 mmol/L dNTP 0.8μL,100 mmol/L MgSO40.8μL,5 mol/L Betaine 2μL,8 U/μL Bst DNA pol 1μL,20μmol/L F/R 0.1μL/0.1μL,10μmol/L CPR 0.8μL,20μmol/L D1/D20.8μL/0.8μL,模板 1μL,ddH2O 补足至 50μL。
反应条件:61℃反应60 min。
2.4 结果检测
将等温PCR扩增产物滴加在核酸快速检测试纸条上,15 min~30 min观察,在质控区出现红色线条,以检测区是否出现红色线条判断反应结果阴阳性。
2.5 特异性试验及引物筛选
对表1中菌株核酸样本应用两套引物探针体系进行试验,以筛选一套合适引物及探针,同时证明该体系是否具有通用性及特异性。
2.6 灵敏度试验
以C53-3为试验菌株,接种于10 mL营养肉汤中,37℃培养16 h。(1)取1 mL用于细菌基因组提取,利用紫外分光光度计检测DNA质量及纯度,进行DNA定量灵敏度检测。(2)取1 mL做细菌计数,用PBS对菌液进行10倍梯度稀释至10-8,取1 mL提取细菌基因组做实验模板。
3 结果与分析
3.1 检测体系的筛选及特异性实验
对多株标准菌株、来自各国样品中检测出的阳性野生菌及其他相关阴性菌(见表1)核酸样本进行试验,进行引物的筛选及特异性实验,以证明检测方法是否具有通用性及特异性。
试验结果表明两套体系对于单增李斯特氏菌无论标准株或野生株检测均为阳性,其他24株食源性致病菌检测均为阴性,但是在针对李斯特菌属其他菌种检测时具有差别,第一套体系特异性良好,只在西尔李斯特菌检测出现假阳性,而第二套体系特异性较差,在威尔李斯特氏菌及绵羊李斯特氏菌检测均为假阳性。所以后续灵敏度试验均采用第一套引物检测体系。
3.2 灵敏度检测
3.2.1 DNA检测灵敏度
利用紫外分光光度计检测C53-3 DNA纯度为1.672,质量34.08μg/mL。用TE对DNA原液进行10倍梯度稀释至10-6,按照反应体系进行试验,如图1所示,当DNA稀释10-1至10-4即浓度至3.4 pg/μL时检测为阳性,在检测区可见红色条带;稀释至10-5至10-6更低稀释浓度时,检测结果为阴性,在检测区无条带显示,说明该方法DNA检测灵敏度可达到100pg/test。

图1 单增李斯特氏菌DNA灵敏度试验Fig.1 Sensitivity of detecting DNA of L.mon
3.2.2 纯菌液灵敏度检测
C53-3过夜菌液计数为5.4×108CFU/mL,用PBS对菌液进行10倍梯度稀释至10-8即5.4×100CFU/mL,各取1 mL提取细菌基因组做实验模板,检测灵敏度结果见图2,10-1至10-5稀释时,结果为阳性,在检测区可见红色条带;稀释至10-6至10-8稀释时检测结果为阴性,在检测区无条带显示,说明该方法菌液检测灵敏度达到102CFU/test。

图2 单增李斯特氏菌液灵敏度试验Fig.2 Sensitivity of detecting L.mon in pure culture
4 结论
与传统检测手段相比,分子生物学检测技术能更快,更可靠发现食品安全隐患,尤其是目前得到广泛应用的等温扩增方法将检测提高到一个新的高度,很好地解决了目前基因检测对仪器的依赖,使得分子生物学方法在基层及偏远经济不发达地区得到广泛使用。
本研究建立的单增李斯特氏菌恒温扩增方法较环介导等温扩增方法(LAMP)在检测结果方面有了很好的改善。LAMP如果使用电泳来观察,存在交叉污染的可能;如果采用肉眼观察沉淀或颜色变化,那么阳性结果标准不能客观地界定。本研究建立的方法结合核酸快速检测试纸条进行检测,依据试纸条上检测线的有无可以明确判定阴阳性结果,其检测DNA灵敏度可达到100pg/test、纯菌液灵敏度达到102CFU/test可满足样品增菌后的检测需求。虽然本方法在李斯特菌属检测中存在西尔李斯特氏菌检测假阳性问题,但较免疫金标试纸条检测只能检测到李斯特氏菌属的特异性上已经有了很大程度的提高。结合实际样品检测结果表明,该方法灵敏度较高,无漏检现象,操作简便,不需要特殊设备,特别适合于基层实验室检测以及样品的快速筛选检测。
[1]MacDonald P D,Whitwam R E,Boggs J D,et al.Outbreak of Listeriosis among Mexican immigrants as a result of consumption of illicitly produced Mexican-style cheese[J].Clin Infect Dis,2005,40(5):677-682
[2]Gottlieb S L,Newbem E C,Grifin P M.Multistate outbreak of Listeriosis linked to turkey deli meat and subsequent changes in US regulatory policy[J].Clin Infect Dis,2006,42(1):2-36
[3]Mead P S,Dunne E F,Graves L.Nationwide outbreak of Listeriosis due to contaminated meat[J].Epidemiol Infect,2006,34(4):744-751
[4]Scheu P,Gasch A,Berghof K.Rapid detection of Listeria monoeytogenes by PCR-ELISA[J].Lett Appl Microbiol,1999,29(6):416-420
[5]Karpiskova R.Appilcation of a chromogenic medium and the PCR method for the rapid confirmation of L.monocytogenes in foodstuffs[J].J Mierobiol Methods,2000,41:267-271
[6]Nguyen L T,Gillespie B E,Nam H M,et al.Detection of Escherichia coli O157:H7 and Listeria monocytogenes in beef products by realtime polymerase chain reaction[J].Foodborne Pathog Dis,2004:1(4):231-240
[7]巢国祥,徐勤,周晓辉,等.单核细胞增生性李斯特菌PCR快速检测方法建立及应用[J].中国人兽共患病杂志,2004,20(9):797-800
[8]Notomi T,Okayama H,Masubuchi H,et al.Loop-mediated isothermal amplification of DNA[J].Nucleic Acids Res,2000,28(12):E63
[9]Mori Y,Kitao M,Tomita N,et al.Real-time turbidimetry of LAMP reaction for quantifying template DNA[J].Biochem Biophys Methods,2004,59:145-157
