静电纺纳米纤维基组织工程大孔支架的研究进展
2012-11-27赵仕芳袁卉华张彦中
赵仕芳 袁卉华 张彦中
(东华大学化学化工与生物工程学院,上海 201620)
引言
组织工程的目的是开发生物替代品来修复受损的组织或器官[1]。在组织工程中,支架是决定组织工程成败的关键因素之一,起到细胞外基质(ECM)的作用,因而在原理上应对细胞外基质的结构和功能实现仿生[2]。天然的ECM主要由蛋白纤维(如10到几百纳米的纤维状的胶原蛋白和弹性蛋白)交织在一起,构成了三维网络结构。由于ECM超细纤维状的多孔形貌对于细胞的基本生理活动有重大的影响,所以用纳米纤维状的仿生材料取代传统的多孔支架将是合理的对ECM结构和形态的仿生[3]。在过去10年中,纳米科技的飞速发展已使越来越多的研究者把仿生纳米纤维应用于组织工程。在制备纳米纤维的各种方法(如自组装、相分离、静电纺丝等)中,静电纺丝方法具有简便快捷、成本低廉、结构可控等优点,被认为是最有可能实现连续纳米纤维工业化生产的一种技术,有望成为理想的组织工程仿生支架的制备方法[4]。
静电纺丝制备的纤维直径通常在亚微米级(俗称纳米纤维),在尺寸和形貌上对ECM有较好的仿生,是当今组织工程支架材料研究的热门[5-6]。近年来,静电纺支架已被广泛应用在软骨、骨、皮肤、角膜、神经、肌腱和韧带等组织工程研究领域[7-8]。但是,由于静电纺支架的纤维排列紧密、纤维之间的空隙过小,使细胞难以长入,无法构建出较厚的组织[3]。据文献报道,只有小的纳米粒子(<300 nm)可以穿过静电纺无纺布的膜,而大的粒子(>1 μm)则被截留[9]。具体到组织工程应用,多数的动物细胞的大小一般为10~100 μm,而静电纺纤维直径通常在500 nm左右的无纺布的孔径是小于10 μm的,二者尺寸上的不相称显然不利于细胞的向内生长,尽管也有研究表明纳米纤维支架能一定程度上促进细胞的长入[10-12]。为了解决这一问题,近年来有各种各样的方法被用来扩大静电纺纳米纤维支架的孔尺寸。笔者首先讨论了组织工程支架中微孔的重要性及对细胞的影响,然后对最近发展的各种扩大孔尺寸的方法进行了总结、归类和分析,并指出这些方法的不足及今后的发展方向。
1 组织工程支架中大孔对细胞的影响
在组织构建(再生)过程中,尤其对于皮肤、骨骼、肌肉的组织工程构建,细胞长入支架的程度是很重要的因素[13]。组织工程支架的孔尺寸、孔隙率和相连的孔形态对细胞的行为有很大的影响,尤其决定了细胞和组织长入支架的程度。这一结论已在聚已酸内酯(PCL)[14]、聚氨基甲酸乙酯、聚(乳酸-乙醇酸)(PLGA)[16-17]、聚乳酸(PLA)[18]、明胶[19]等聚合物上,通过培养成纤维细胞[14]、骨髓间质干细胞[20]、软骨细胞[21]、人脐静脉内皮细胞[22]得到证实。此外,支架的微孔对细胞的黏附、迁移、增殖、形态、分化、细胞外基质的分泌等方面都有影响。
对于不同的细胞,支架的最适孔径尚无定论,但几十到几百微米的孔径对于细胞的迁移和长入支架内部通常认为是必需的[23]。合适的孔尺寸、高的孔隙率(>90%)和相连的孔形态,对于大量细胞的种植、细胞和组织的生长、细胞外基质的形成、氧气和营养的传输、代谢物的排泄以及血管和神经的内生长起着决定作用[24]。
2 扩大静电纺纤维支架孔径的方法
近年来,不同的研究者利用各种方法来扩大静电纺纤维支架的孔径,大致包括沥滤法、光刻蚀法、微-纳米纤维复合法、改变接收装置法、和超声法等(见表1)。这些方法制备出的支架,其培养细胞的结果和在组织工程中的应用分述如下。
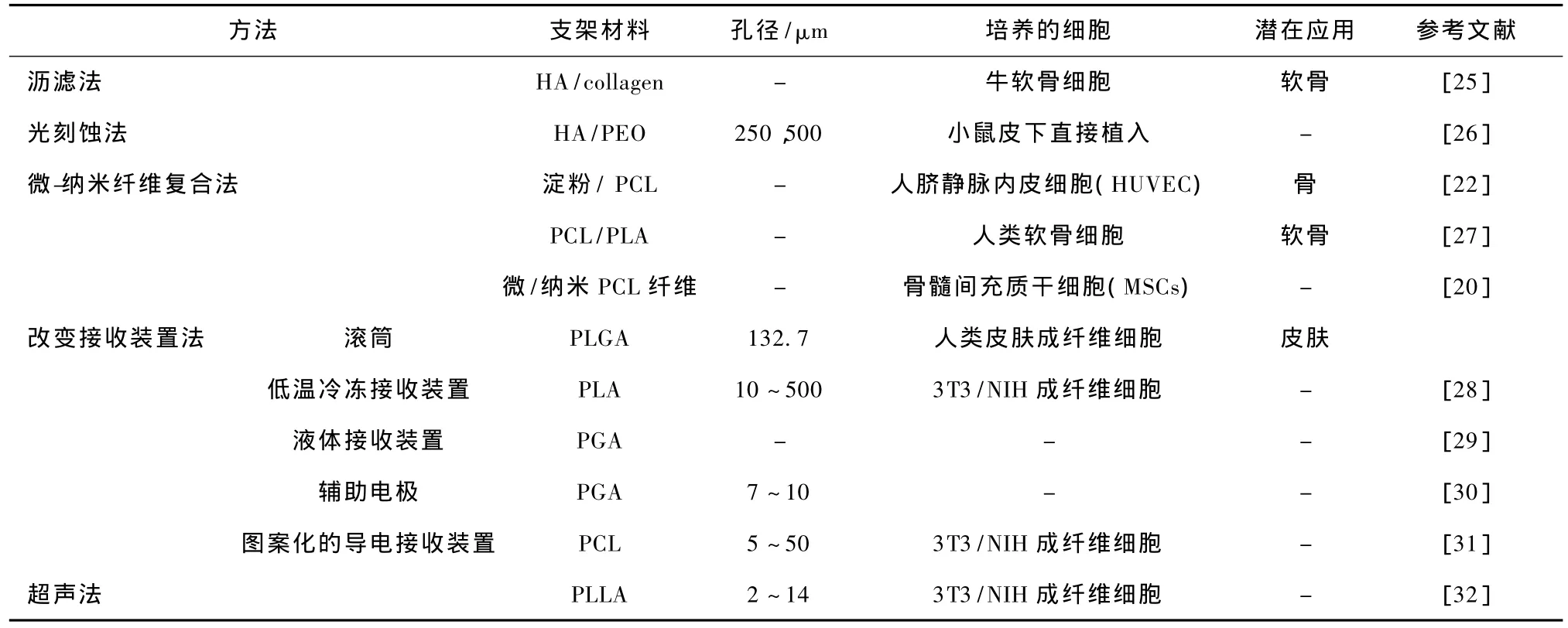
表1 扩大静电纺支架孔尺寸的方法汇总Tab.1 Techniques used to increase the pore size of electrospun scaffolds
2.1 沥滤法
沥滤法或其结合气体发泡等技术已被广泛应用于组织工程支架的制备。沥滤法首先将组织工程材料和致孔剂粒子制成均匀的混合物,然后利用二者不同的溶解性或挥发性,将致孔剂粒子除去,最后粒子所占有的空间变为孔隙。所制备支架的孔隙率由粒子含量决定,孔尺寸由粒子尺寸决定。Lee等在2005年首次将电纺与盐粒沥滤/气体发泡相结合,制备了具有双重孔道结构的聚乳酸(PLLA)纳米纤维大孔支架(见图1(a))[33],即先用静电纺制备出蒙脱土(MMT)增强的复合支架,随后将支架与NH4HCO3/NaCl等物质在低温下压铸成膜,再分别经气体发泡和盐粒沥滤工序除去NH4HCO3和NaCl颗粒,冻干后得到孔径在50~300 μm的大孔支架。Nam等利用类似同轴电纺的装置,将NaCl盐粒子从壳层喷出,PCL聚合物溶液从芯层喷出,使盐粒子和纤维连在一起形成串珠状的结构[21]。通过模压成型,得到了层层叠加的纳米纤维和盐粒子的复合结构,进而除去盐粒子制备出了大孔支架。其中,电纺纤维层与层之间的大孔是由20~300 μm的盐粒子被除去后得到的。
在静电纺丝过程中,也可以用一个自动振动的筛子使盐粒子与纤维同时沉积在接收装置上(见图1(b)),Kim等制得了透明质酸/胶原(HA/collagen)纤维和 NaCl盐粒子的复合物(见图 1(c)),再把纤维/NaCl复合物加工成所需的形状和尺寸。盐粒子去掉后,支架会发生一定程度的萎缩,但仍保持了完整的大孔结构(见图 1(d))[25]。值得指出的是,该方法虽然可行,但在较厚支架内部的盐不易被除去;盐去除后,支架会发生萎缩,力学性能差,而孔和孔之间的连通性也是个问题。

图1 沥滤法扩大静电纺纤维支架的孔径。(a)盐浸/气体发泡后的 PLLA/MMT复合纤维的SEM[33];(b)静电纺纤维和盐粒子同时沉积的装置;(c)纤维/盐的复合物;(d)除掉盐后形成的大孔[25]Fig.1 Salt/polymer leaching used to enlarge pore size of electrospun scaffolds.(a)SEM micrograph of PLLA/MMT nanocomposite scaffold by electrospinning and salt leaching/gas foaming methods[33] ;(b)Schematic diagram of the electrospinning and salt deposition set-up;(c)Photograph of HA/collagen nanofibers/NaCl salts composite;(d)SEM image of macroporous scaffolds after leaching of the sample in Fig.1(c)[25]
类似于去掉盐粒子一样,选择性地去掉复合纤维中的一种纤维的方法也被用来扩大静电纺纤维支架的孔径。Kidoaki等提出了同步混合电纺的概念,即用聚氨酯(SPU)和聚氧化乙烯(PEO)分别将两个喷丝头同时沉积到一个高速旋转并水平运动的接收辊上,获得了两种材料在单根纤维水平上能进行相互交叉的复合纤维膜[34]。如果把PEO纤维水溶掉,就可以扩大支架的孔径。Baker等利用这种方法得到PCL/PEO单向复合纤维膜,去掉 PEO后,实验证明在一定程度上利于细胞的长入[35],但他们选用的是取向纤维膜(其内部孔径比一般的无纺布要小)。Ekaputra等进一步比较了混合电纺得到的PCL/Col-PEO无纺布纤维膜、PCL/Col微米纤维膜和PCL/Col微米纤维膜复合水凝胶这三种支架,发现PCL/Col-PEO无纺布纤维膜仅能略微促进细胞长入支架,远不如另外两种支架[36]。这是因为,选择性地去掉纤维法只能非常有限地增加支架的孔隙率和孔径。
2.2 光刻蚀法
光刻蚀法用高强度的光(如激光)消融掉纤维,形成空隙,得到大孔纤维支架。由于其尺度上精确的可控性,已广泛地应用于组织工程支架的制备。光刻蚀法可以制备出规则的几何图案(如沟槽,见图2(a))[37]。光刻蚀法制备出大孔纤维支架,可以促进细胞的长入[26]。Dong等则利用一个多孔挡板(见图2中(b)和(c)),用紫外线照射,制备出多孔纤维结构[38]。Lootz等研究发现,用 CO2激光切割聚羟基丁酸酯(PHB)时造成管脆化;化学分析和分子质量测量显示被激光切割的材料边缘理化性能已发生改变,加工过程会严重损坏材料原有的性质,使得传统的长脉冲激光在组织工程支架加工制备中的应用受到限制[39]。以掺钛蓝宝石为代表的新一代超短、超强的飞秒(fs)脉冲激光器的出现,避免了热扩散的影响,同时也克服了上述传统的长脉冲激光在加工生物组织工程支架上的局限[40]。但用于纳米纤维时,还是会产生纤维之间的黏结,有待进一步改进。

图2 光刻蚀法扩大静电纺纤维支架的孔径。(a)用激光产生的沟槽[37];(b)紫外线照射多孔挡板得到大孔纤维的装置;(c)用紫外线光刻处理1 h后的静电纺PLGA膜[38]Fig.2 Light was used to enlarge pore size of electrospun scaffolds.(a)Groove pattern formed by laser[37];(b)Schematic diagram of UV photolithography with porous mask;(c)Electrospun PLGA nanofibers after 1 hr UV photolithography[38]
2.3 微-纳米纤维复合法
静电纺纳米纤维的孔径小,不利于细胞的长入;而微米纤维孔径大,但纤维的比表面积小,不利于细胞的黏附。自然构建出纳米纤维和微米纤维的复合支架,就可结合这两种纤维的优势,克服其各自的缺点。Santos等用纤维黏合工艺制备出淀粉微米纤维支架,再用静电纺丝技术将400 nm的聚己内酯(PCL)纳米纤维灌入微米支架中,得到纳米纤维和微米纤维复合支架[22]。他们的研究结果表明,人脐静脉内皮细胞(HUVEC)可以长入上述复合支架的内部,并具有生成血管的潜力(见图3(a))。
按顺序交替静电纺纳米纤维和微米纤维,可以实现多层纳米/微米纤维的复合结构(见图3(b))[20]。在灌注条件下,细胞可以很明显地长入多层纳米/微米纤维复合支架的内部,但是其纳米纤维网还是会阻碍细胞的长入。为了解决这一问题,Thorvaldsson等提出在单根微米纤维表面沉积一层纳米纤维,形成纳米纤维的涂层[27]。如此接收到具有纳米纤维涂层的微米纤维,可以手动地构建成任意的孔径和孔隙率的支架(见图3(c))。在该支架的纳米纤维涂层上,细胞可以很好地生长和长入支架的内部(见图3(d))。可见,这种纳米纤维涂层能为细胞生长提供适当的接触位点和结构环境。
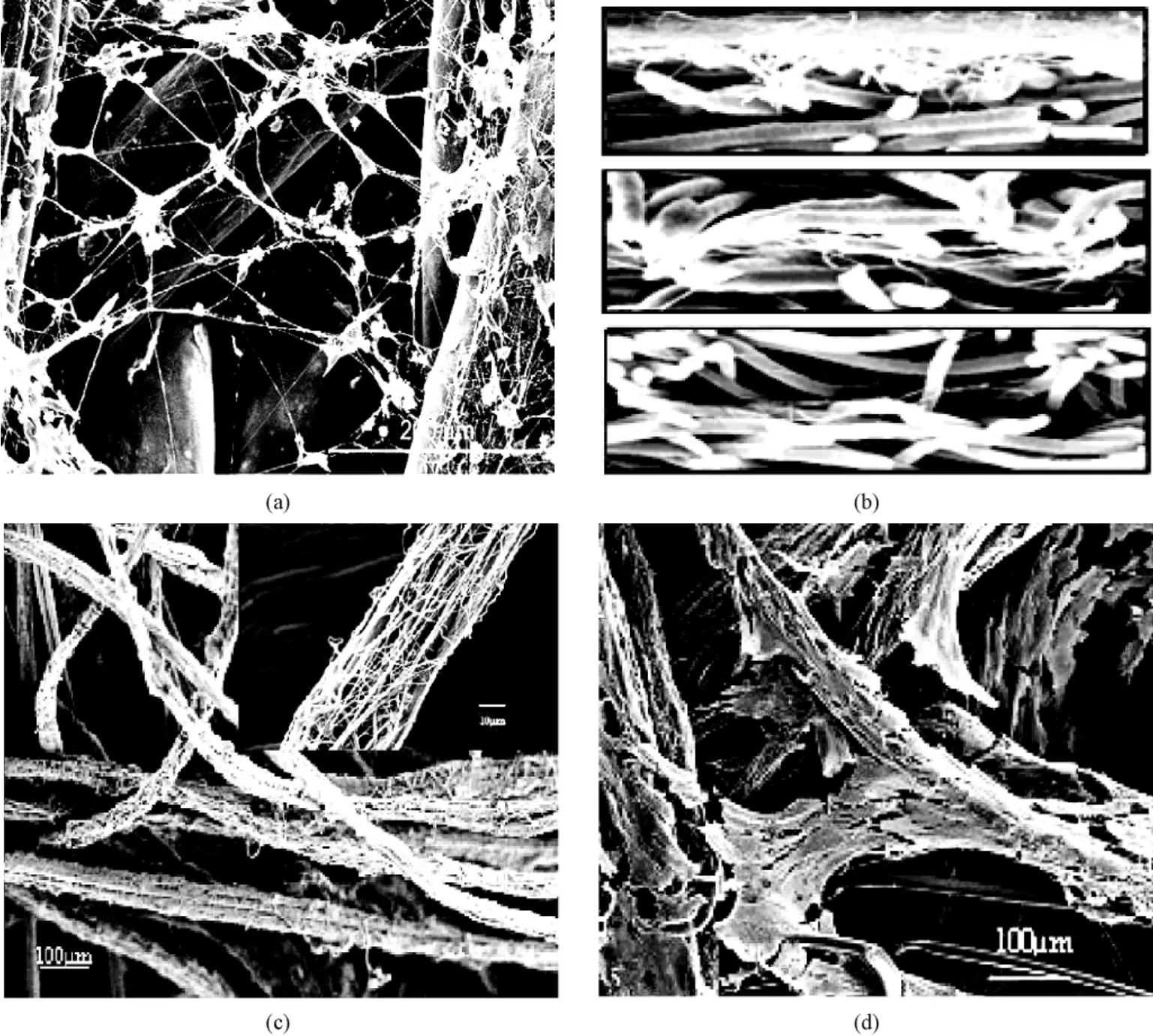
图3 纳米纤维/微米纤维混纺扩大纤维支架的孔径。(a)人脐静脉内皮细胞长入淀粉/PCL(微米/纳米)复合支架[22];(b)使用交替电纺制备的多层微/纳米纤维[20];(c)微米纤维上有纳米纤维的涂层,右上角为放大图;(d)软骨细胞接种到 (c)中的支架上,培养2周后的图片[27]Fig.3 Hybrids of nanofibers and microfibers for enlarging pore size of electrospun scaffolds.(a)SEM micrograph of HUVEC cells on Starch/PCL nano/micro-fiber-combined scaffolds[22];(b)Multilayered nano-and microfibers by alternative electrospinning[20];(c)Nanofiber-coated microfibers with the insert of magnified view of a single microfiber coated with nanofibers;(d)Chondrocytes seeded on the scaffold of the microfibers coated with nanofibers,after 2 weeks of culture[27]
2.4 改变接收装置法
在最初的静电纺中,人们直接用金属平板作为接收装置,得到无纺布的纤维毡。随后,改用滚筒来收集得到有取向的纤维膜或纤维束。现在,人们利用各种各样的接收装置来制备出适应不同要求的纤维毡。具体到静电纺大孔纳米纤维支架,各种接收装置被用来制备出不同孔径大小的大孔纳米纤维支架,并用于不同的组织构建。如Li等利用缓慢旋转的滚桶作为接收装置,增大静电纺纤维支架的孔径和孔隙率,得到了孔隙率为92.4%、平均孔径为 132.7 μm 的纤维毡[16-17]。细胞实验表明,人类皮肤成纤维细胞长入该支架的深度可以超过100 μm,并检测到细胞分泌出了胶原蛋白。进一步的实验表明,该方法制备出的支架可用于皮肤组织工程[16]。改变接收装置致孔法还包括:利用低温接收装置,具有特定形貌的可导电接收装置或辅助电极、液体接收装置和具有特定形貌的不可导电接收装置。
2.4.1 利用低温冷冻的接收装置
McCann等以液氮为凝固浴,在纤维成形到达接收装置前先经过液氮将溶剂冷却,纺丝射流迅速分相为溶质相和溶剂相[41]。因此通过控制溶剂挥发速度,可以有效地控制单根纤维的孔隙率,即单根纤维的横截面是高度多孔的结构。该研究将接收装置浸于低温液体中,利用高聚物溶质和残余溶剂间的相分离作用,最终得到高孔隙率的聚丙烯腈(PAN)、聚己内酯(PCL)纤维。
Simonet等利用静电收集装置上的冰晶层来制备大孔支架。在中空的滚筒中间装载有冷源(如干冰或液氮),从而在滚筒表面形成了一层冰晶(见图4(a))[42]。利用冰晶凹凸不平的形貌,电纺纤维沉积到表面带有冰晶的滚筒上;冰晶被除去后,会形成大孔的纳米纤维结构。Leong等利用类似的方法,制备出了 10~500 μm 的大孔纤维支架[28]。进一步的体外和体内实验表明,细胞可渗透到支架内部达50 μm,而在传统的静电纺支架上没有观察到细胞渗透到支架内部的现象。从图4(b)可以看出,在支架的内部,孔径越来越小。在较厚的支架上,很难形成孔径一致的贯通孔,这是其局限之处。

图4 冷冻接收装置扩大静电纺纤维支架的孔径。(a)冷冻滚筒表面上形成的冰晶[42];(b)用冰晶作为接收装置,得到PLLA大孔纤维支架[28]Fig.4 Ice crystal for electrospinning collecting device used to enlarge pore size.(a)The chilled drum with ice crystals formed on the surface[42];(b)Electrospun scaffolds of PLLA fabricated using ice crystals[28]
2.4.2 利用液体接收装置的干喷湿法静电纺丝法[43]
干喷湿法静电纺丝过程主要由注射推进装置、静电发生器和凝固浴接受装置3部分组成。最初,Smit等提出利用水浴槽收集,即把静电纺纤维毡首先沉积到水浴中水的表面,然后被拉到水浴槽的边缘,用旋转圆辊接收纱线[44]。Yokoyama等将传统的干喷湿法纺丝和静电纺丝相结合,以水、50% 叔丁醇、99%叔丁醇为凝固浴,有效地分散聚集纤维,制备得到海绵状三维结构的聚羟基乙酸(PGA)纤维毡,并且有效控制其纤维密度,纤维直径为200~400 nm[29]。以此干喷湿法获得的三维结构纤维孔隙率高达96.6%,比普通静电纺纤维毡高11%,密度为50.8 mg/cm3,仅为普通静电纺纤维毡的1/4。
2.4.3 改变电场控制纳米纤维的沉积
利用不同的辅助电极,形成特定电场分布,可以控制电纺纤维的沉积。例如,Carnell等利用辅助电极来控制电场的形状和大小,进而影响纤维沉积和排列,制备出了高度取向的纤维和非编织布(见图5)[30]。辅助电极(不锈钢针,负电极)位于旋转接收器(光滑表面的转筒)上方,与正电极共同构成了一个统一的球形电场(见图5(a))。利用正、负电场相互吸引的原理,控制了电纺中常见的射流不稳定鞭甩,形成了稳定射流,从纺丝头抽出了单根微/纳米纤维。而纤维在到达负电极之前被旋转接收器拦截,得到了均匀间隔的取向纤维,通过层层叠加得到非编织布。电纺聚酰亚胺(CP2)得到非编织布的孔径25~30 μm,纤维的平均直径是(9.9±3.3)μm;电纺聚乙醇酸(PGA)得到非编织布的孔径7~10 μm,纤维的平均直径是(0.91±0.4)μm(见图5中(b)~(e))。该方法的局限是得到的纤维直径较粗,不能很好仿生;支架的孔径不易控制,孔径会随着支架的厚度而逐渐变小。
另有文献报道,利用不同图案的可导电接收装置来控制纤维沉积,得到不同图案的纤维膜[45]。其原理也是通过改变电场分布来控制电纺纤维的沉积,得到大孔支架,而纤维的排列、沉积以及图案结构的形成主要是由静电力决定的。这种方法可以制备出微孔或有规律图案结构的支架[45-46],在组织工程、药物缓释、催化和传感等领域有潜在的应用。Vaquette等利用空心的金属圆孔网(见图6(a))作为接收装置,制备出大孔纤维支架(见图6(b)),并进一步研究了细胞在该支架上的生长情况[31]。研究发现,成纤维细胞可以长入支架的内部250 μm处,说明这种纤维大孔支架利于细胞的长入(见图6(c)和(d))。但该支架孔径过大,力学性能较差,纤维直径也较粗(1.5 μm左右)。
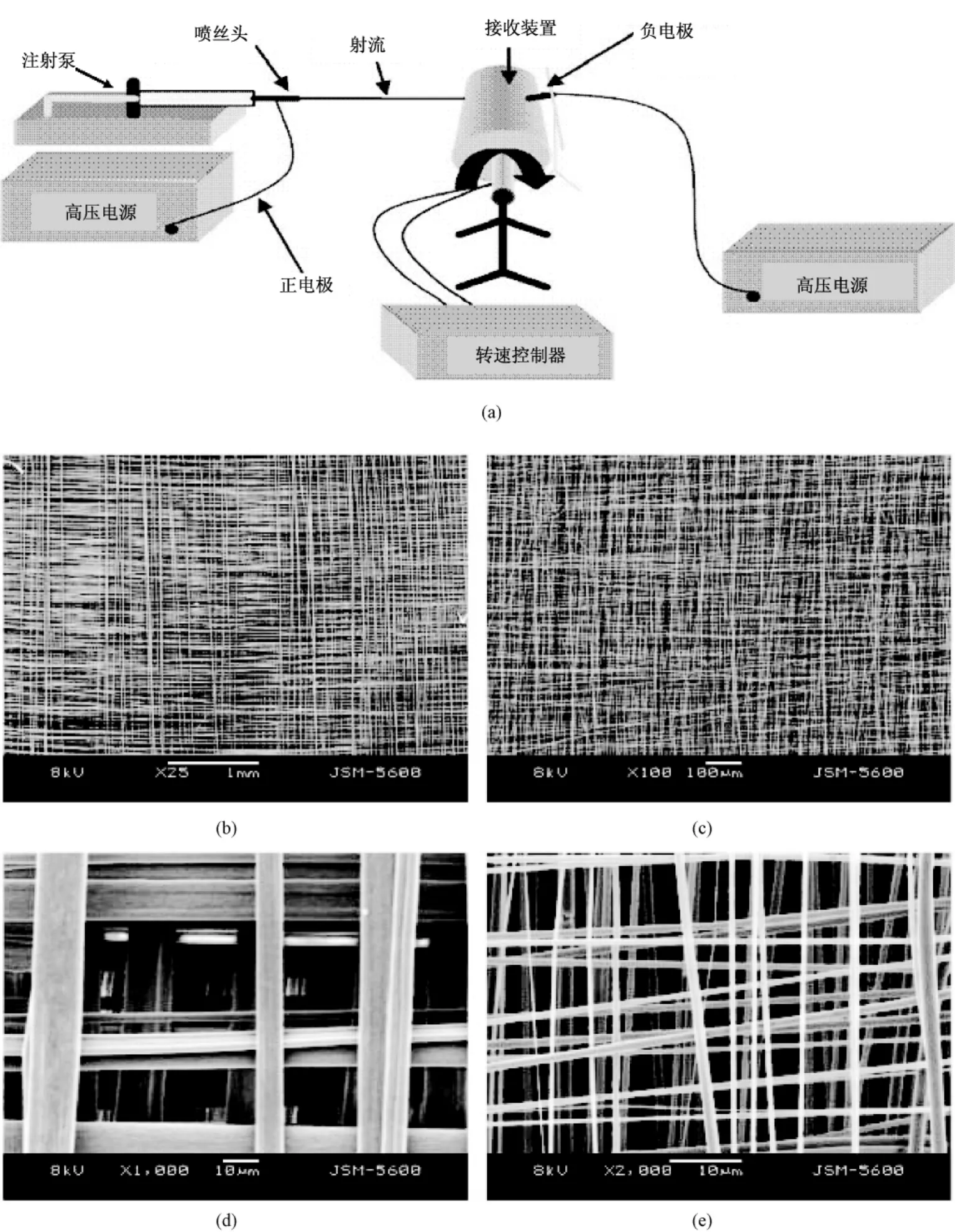
图5 利用辅助电极来扩大静电纺纤维支架的孔径。(a)利用负电极控制纳米纤维的沉积;(b)电纺聚酰亚胺(CP2)得到的非编织布;(c)电纺聚乙醇酸(PGA)得到的非编织布;(d)是(b)的局部放大;(e)是(c)的局部放大[30]Fig.5 Auxiliary electrode used to enlarge pore size.(a)Electrospinning setup incorporating the auxiliary electrode configuration;Electrospun mats from(b)CP2(magnification 25×)and(c)PGA(magnification 100×);(d)Higher magnified(1000×)CP2 scaffolds in(b);(e)Higher magnified(2000×)PGA scaffolds in(c)[30]
2.4.4 拓扑形貌控制纳米纤维的沉积
图6 利用电场来控制纤维的沉积。(a)金属空心圆孔接收器;(b)用(a)装置接收到的纤维膜;(c)成纤维细胞接种到(b)所述的支架上培养7 d后的图像;(d)是(c)的放大,可以看到细胞明显地长入支架的内部(如黑色箭头所示)[31]Fig.6 Using electric field to pattern the electrospun scaffolds.(a)“Metal”collector with round holes;(b)The round patterned electrospun scaffolds collected using(a);(c)Morphology of fibroblasts seeded on the round patterned electrospun matafter for 7 days of culture;(d)Higher magnified scaffold in Fig.6(c),indicating that cells were able to infiltrate into the scaffold,as shown by the black arrow[31]
本实验室的最新研究表明,沉积的纳米纤维可以一定程度上复制接收装置表面的拓扑形貌(未发表)。不同表面形貌的接收装置可以得到不同形貌的大孔支架。如把日常生活中常用的卫生纸作为接收装置,可以得到与卫生纸表面形貌非常相似的纳米纤维膜(见图7中(a)和(b))。本方法与电场控制纤维沉积不同,因为选用的接收装置都是绝缘材料。如选用一种厚度为25 mm的聚苯乙烯泡沫作为接收装置,可得到与泡沫表面拓扑形貌相似的大孔支架(见图7中(c)和(d))。聚苯乙烯电导率(σ)为10~16 S/m,电阻率为1020~1022 Ω·cm,电绝缘性能好。因此,可以认为是由于接收装置的表面拓扑形貌,即材料表面的凹凸结构,控制了电纺纤维的沉积。材料凸起的部分较易沉积纤维,材料凹陷的部分不易沉积纤维。选用具有合适表面拓扑形貌的材料作为接收装置,就可以得到与接收装置表面拓扑形貌相似的大孔支架。该方法简便快捷、成本低廉,易于控制孔径和孔的形貌,有望成为一种潜在的组织工程三维纳米纤维状大孔支架的制备方法。
2.5 超声法
Lee等利用超声波来扩大静电纺纤维的孔径。他们发现在水溶液中,对静电纺纤维支架进行超声波处理,可以扩大支架的孔径、孔隙率和厚度[32]。支架的孔径、孔隙率和厚度的大小取决于超声波的强度和超声处理的时间。在对支架进行超声处理后,发现支架的纤维密度降低,纤维之间的空隙增大,支架整体膨胀变厚(见图8中(a)~(d)),利于细胞的长入。这是由于超声波的振动使支架中的纤维相互分离,产生了较大空隙。进一步的实验表明,成纤维细胞可以长入经过超声处理的支架内部300 μm处(见图8(f)),而成纤维细胞只在未经处理的支架表面生长(见图8(e))。在经过超声处理的支架中,由于细胞的迁移、增殖,使支架内部的细胞数量大为增加。该方法在制备大孔支架方面具有潜在的用途,但由于超声波的作用,支架的机械性能会变差,这是需要改进的地方。
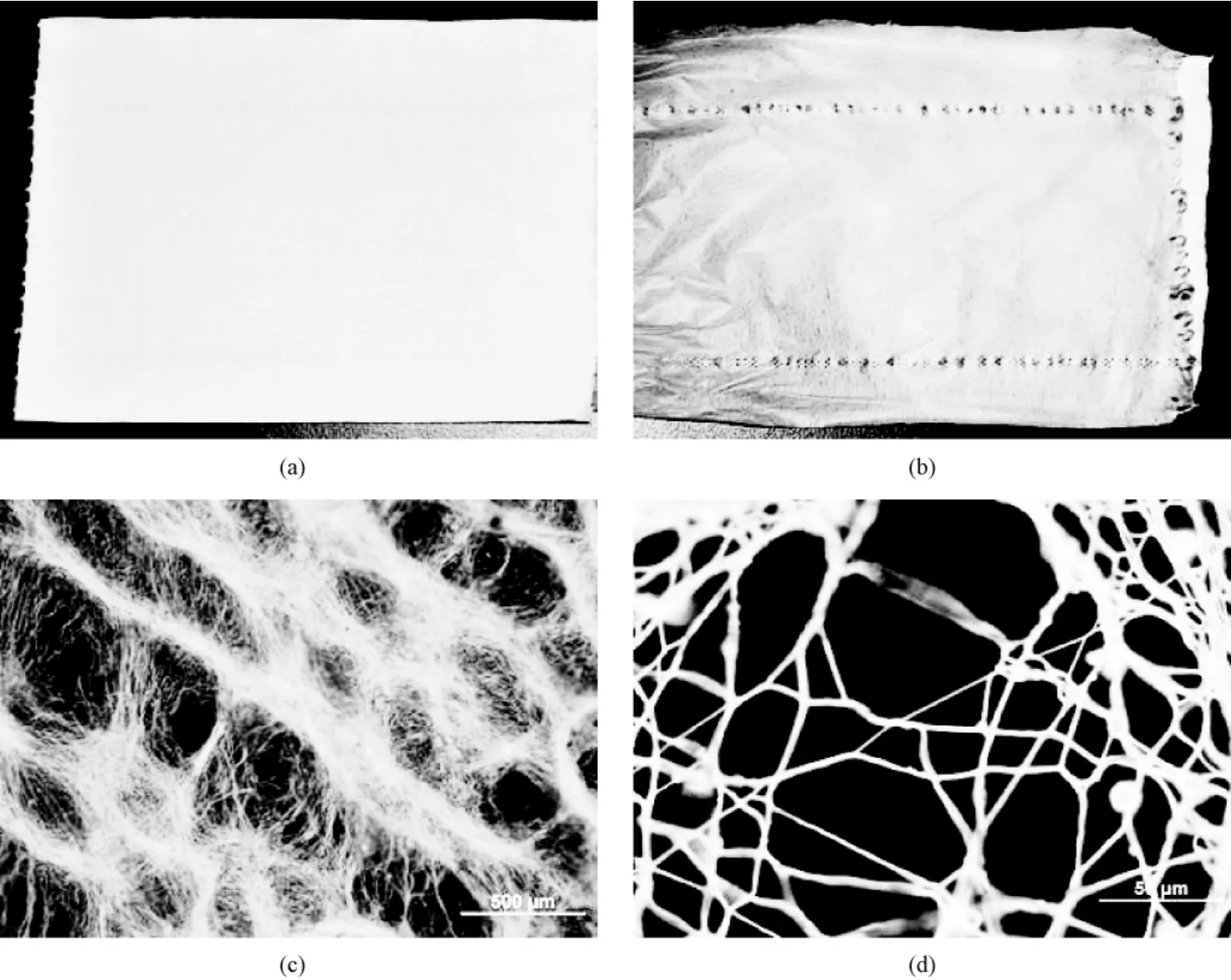
图7 拓扑形貌法扩大静电纺纤维支架的孔径。(a)日常生活中的卫生纸;(b)用卫生纸作为接收装置,静电纺得到纳米纤维膜(可以看出,纳米纤维膜和卫生纸的拓扑形貌非常相似);(c)用聚苯乙烯泡沫作为接收装置,得到大孔纳米纤维支架;(d)是(c)的局部放大Fig.7 Topology method(i.e.,patterning of electrospun fibers using non-conductive patterned collectors)used to enlarge pore size.(a)Lavatory paper;(b)The patterned electrospun scaffold collected using lavatory paper,indicating that the pattern of the lavatory paper was accurately copied by the electrospun fibres;(c)The patterned electrospun scaffold collected using polystyrene foam;(d)Higher magnified scaffolds in(c)
此外,有人把细胞液和纺丝液混在一起,把细胞纺到纤维中去[47],或把电纺纤维和接种细胞交替进行,形成细胞/纤维复合支架[48]。还有其他一些方法,如3 D打印法、冷冻干燥法等,用来制备纳米纤维大孔支架。例如,Moroni等利用静电纺和3 D打印技术制备三维纳米纤维状大孔支架,更利于细胞的黏附和铺展[49]。此外,这种新的支架还增加了ECM蛋白质产生的量,促进了细胞更好地分化,总体而言可有效地促进组织再生。
3 总结与展望
纳米纤维具有与天然ECM近似的微观构造,使制备的支架能够仿生天然ECM的结构特点;极高的比表面积和负载生物活性成分的能力,也为活性因子的有效释放提供了理想平台。因而,纳米纤维有望被制成理想的组织工程支架。文中综述了各种用来扩大静电纺纳米纤维支架孔径的方法。但这些方法都有各自的局限,如:支架机械性能差;支架的孔径小或孔不连通;在制备过程中,纤维出现肿胀或黏结;孔径过大,导致了很多细胞堆积在一个孔中,无法发挥纳米纤维的优势等。当前,纳米纤维基组织工程研究所面临的主要挑战之一,就是难以制备出具有纳米纤维形貌的3 D大孔支架。
目前,制备出的组织工程支架都不能构建出较厚、较复杂的组织。传统的大孔支架(不具有纳米形貌)或利用层压技术得到的较厚支架都需借助灌流、生物反应器,才能使细胞长入支架的内部,并保持活力。一旦把这些支架和细胞的复合物植入体内,如果没有充足的氧气和养分,移植支架内的细胞往往死亡。因此,利用3D大孔纳米纤维支架,结合生长因子,在支架的大孔处诱导血管再生,也许是组织工程支架以后的重点发展方向之一。最终,理想的组织工程支架应能充分模拟体内的微环境,诱导细胞迁移、生长和分化,使细胞在特定的位点、时间发挥特定的作用,再生出新的组织或器官。
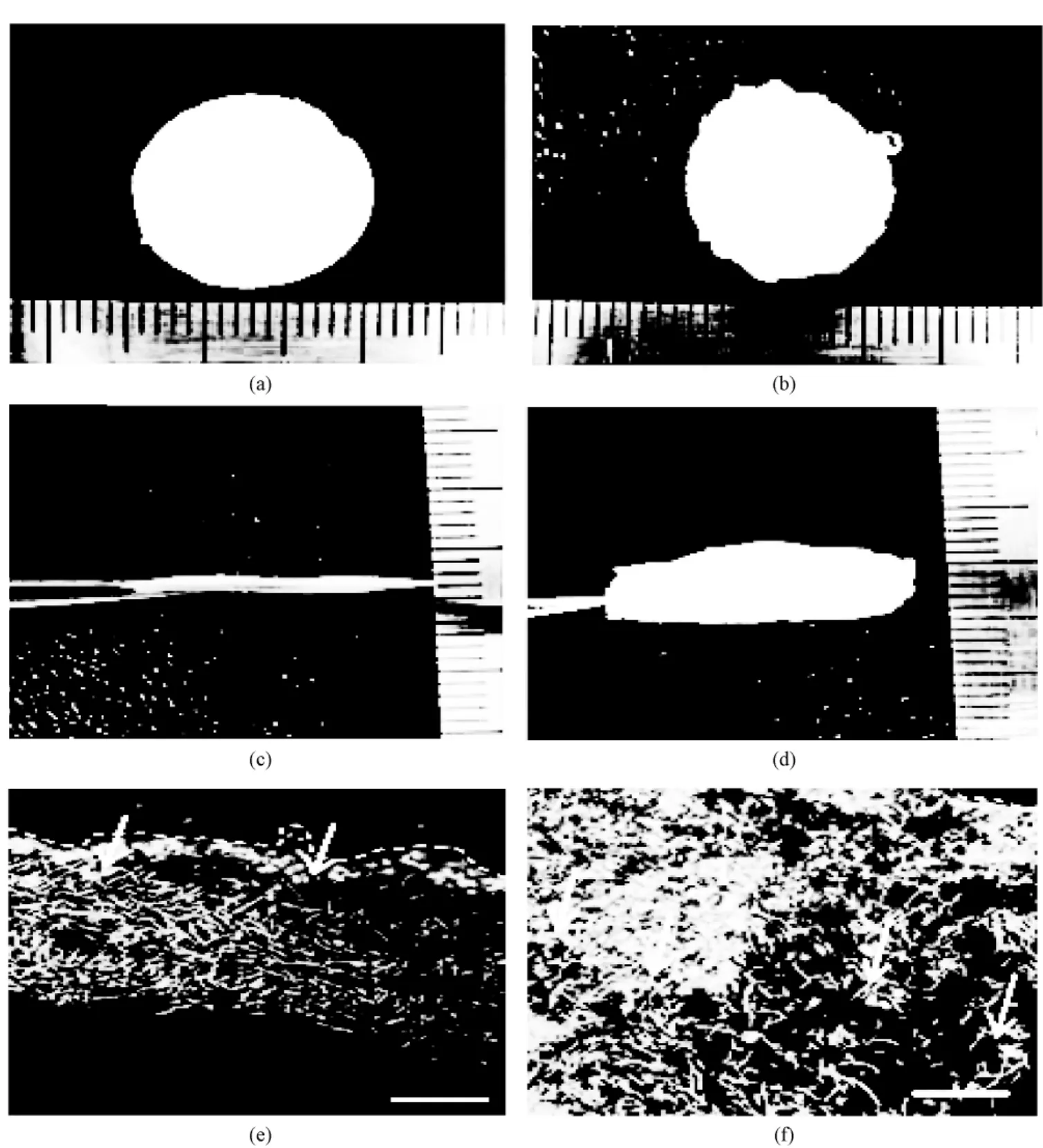
图8 超声法扩大静电纺纤维支架的孔径。常规静电纺PLLA纳米纤维支架顶部的平面(a)和横截面(c);经过超声处理10 min后静电纺PLLA纳米纤维支架顶部的平面(b)和横截面图(d)(图中标尺的单位是1 mm);细胞种植7 d后,常规PLLA支架的激光共聚焦图像(e)和经过超声处理的 PLLA支架的激光共聚焦图像(f)。使用 DAPI染色,标尺是100 mm[32]Fig.8 Highly porous electrospun nanofibrous scaffolds using ultrasonication.(a)and(c)Top surface and cross-sectional images of poly(l-lactic acid)(PLLA)nanofiber;(b)and(d)Ultrasonicated scaffolds after 10 min sonication(The unit on the ruler is 1 mm);Confocal lazer scanning microscope images of non-treated(e)and ultrasonicated POA nanofibrous scaffolds(f)at 7 days after staining with DAPI Scale bar=100 mm[32])
[1]Langer R,Vacanti JP.Tissue engineering[J].Science,1993,260(5110):920-926.
[2]Kim BS,Mooney DJ.Development of biocompatible synthetic extracellular matrices for tissue engineering[J].Trends in Biotechnology,1998,16(5):224-230.
[3]Dvir T,Timko BP,Kohane DS,et al.Nanotechnological strategies for engineering complex tissues[J]. Nature Nanotechnology,2011,6(1):13-22.
[4]何创龙,黄争鸣,张彦中,等.静电纺丝法制备组织工程纳微米纤维支架[J].自然科学进展,2005,15(10):1175-1182.
[5]Sell S,BarnesC,Smith M,etal. Extracellularmatrix regenerated:Tissue engineering via electrospun biomimetic nanofibers[J].Polymer International,2007,56(11):1349 -1360.
[6]Sill TJ,von Recum HA.Electro spinning:Applications in drug delivery and tissue engineering[J].Biomaterials,2008,29(13):1989-2006.
[7]Huang ZM,Zhang YZ,Kotaki M,et al.A review on polymer nanofibers by electrospinning and their applications in nanocomposites[J]. CompositesScience and Technology,2003,63(15):2223-2253.
[8]Pham QP,Sharma U,Mikos AG.Electrospinning of polymeric nanofibers for tissue engineering applications:A review[J].Tissue Engineering,2006,12(5):1197-1211.
[9]Barhate RS,RamakrishnaS. Nanofibrousfilteringmedia:Filtration problems and solutions from tiny materials[J].Journal of Membrane Science,2007,296(1-2):1-8.
[10]Li M,Mondrinos MJ,Chen X,et al.Co-electrospun poly(lactide-co-glycolide),gelatin,and elastin blends for tissue engineering scaffolds[J]. JournalofBiomedicalMaterials Research Part A,2006,79A(4):963-973.
[11]Shabani I,Haddadi-Asl V,Seyedjafari E,et al. Improved infiltration ofstem cells on electrospun nanofibers[J].Biochemical and Biophysical Research Communications,2009,382(1):129-133.
[12]Zhang YZ,Su B,Venugopal J,et al.Biomimetic and bioactive nanofibrous scaffolds from electrospun composite nanofibers[J].International Journal of Nanomedicine,2007,2(4):623 -638.
[13]Jelena RK.Increasing the pore size of electrospun scaffolds[J].Tissue Engineering Part B:Reviews,2011,17(5):365 -372.
[14]Lowery JL,Datta N,Rutledge GC.Effect of fiber diameter,pore size and seeding method on growth of human dermal fibroblasts in electrospun poly(epsilon-caprolactone)fibrous mats[J].Biomaterials,2010,31(3):491 - 504.
[15]van Tienen TG,Heijkants R,Buma P,et al.Tissue ingrowth polymers and degradation of two biodegradable porous with different porosities and pore sizes[J].Biomaterials,2002,23(8):1731-1738.
[16]Yang Y,Zhu X,Cui W,et al.Electrospun composite mats of poly(d,l-lactide)-co-glycolide and collagen with high porosity as potential scaffolds for skin tissue engineering[J].Macromolecular Materials and Engineering,2009,294(9):611-619.
[17]Zhu X,Cui W,Li X,et al.Electrospun fibrous mats with high porosity as potential scaffolds for skin tissue engineering[J].Biomacromolecules,2008,9(7):1795-1801.
[18]Khil MS,Cha DI,Kim HY,et al.Electrospun nanofibrous polyurethane membrane as wound dressing[J]. Journal of Biomedical Materials Research Part B-Applied Biomaterials,2003,67B(2):675-679.
[19]Sisson K,Zhang C,Farach-Carson MC,et al.Fiber diameters control osteoblastic cell migration and differentiation in electrospun gelatin[J]. Journal ofBiomedicalMaterials Research Part A,2010,94A(4):1312-1320.
[20]Pham QP,Sharma U,Mikos AG.Electrospun poly(epsiloncaprolactone)microfiber and multilayer nanofiber/microfiber scaffolds:Characterization ofscaffoldsand measurementof cellular infiltration[J].Biomacromolecules,2006,7(10):2796-2805.
[21]Nam J,HuangY,AgarwalS,etal. Improved cellular infiltration in electrospun fiber via engineered porosity[J].Tissue Engineering,2007,13:2249-2257.
[22]Santos MI,Tuzlakoglu K,Fuchs S,et al.Endothelial cell colonization and angiogenic potential of combined nano-and micro-fibrous scaffolds for bone tissue engineering [J].Biomaterials,2008,29(32):4306-4313.
[23]Oh SH,Park IK,Kim JM,et al. In vitro and in vivo characteristics of pcl scaffolds with pore size gradient fabricated by a centrifugation method[J].Biomaterials,2007,28(9):1664-1671.
[24]吴林波,丁建东.组织工程三维多孔支架的制备方法和技术进展[J].功能高分子学报,2003,16(1):91-96.
[25]Kim TG,Chung HJ,Park TG.Macroporous and nanofibrous hyaluronic acid/collagen hybrid scaffold fabricated by concurrent electrospinning and deposition/leaching of salt particles[J].Acta Biomaterialia,2008,4(6):1611-1619.
[26]Sundararaghavan HG,Metter RB,Burdick JA.Electrospun fibrous scaffolds with multiscale and photopatterned porosity[J].Macromolecular Bioscience,2010,10(3):265-270.
[27]Thorvaldsson A,Stenhamre H,Gatenholm P,et al.Electrospinning of highly porous scaffolds for cartilage regeneration[J].Biomacromolecules,2008,9(3):1044 -1049.
[28]Leong MF,Rasheed MZ,Lim TC,et al.In vitro cell infiltration and in vivo cell infiltration and vascularization in a fibrous,highly porous poly(d,l-lactide)scaffold fabricated by cryogenic electrospinning technique[J].Journal of Biomedical Materials Research Part A,2009,91A(1):231-240.
[29]Yokoyama Y,Hattori S,Yoshikawa C,et al. Novel wet electrospinning system for fabrication of spongiform nanofiber 3-dimensional fabric[J].Materials Letters,2009,63(9 - 10):754-756.
[30]Carnell LS,Siochi EJ,Holloway NM,et al.Aligned mats from electrospun single fibers[J].Macromolecules,2008,41(14):5345-5349.
[31]Vaquette C,Cooper-White JJ.Increasing electrospun scaffold pore size with tailored collectors for improved cell penetration[J].Acta Biomaterialia,2011,7(6):2544 -2557.
[32]Jung BL,Sung IJ,Min SB,et al.Highly porous electrospun nanofibers enhanced by ultrasonication for improved cellular infiltration[J].Tissue Engineering Part A,2011,17(21 -22):2695-2702.
[33]Lee YH,Lee JH,An IG,et al.Electrospun dual-porosity structure and biodegradation morphology ofmontmorillonite reinforced plla nanocomposite scaffolds[J].Biomaterials,2005,26(16):3165-3172.
[34]Kidoaki S,Kwon IK,Matsuda T.Mesoscopic spatial designs of nano- and microfiber meshes for tissue-engineering matrix and scaffold based on newly devised multilayering and mixing electrospinning techniques[J].Biomaterials,2005,26(1):37-46.
[35]Baker BM,Gee AO,Metter RB,et al.The potential to improve cell infiltration in composite fiber-aligned electrospun scaffolds by the selective removal of sacrificial fibers[J].Biomaterials,2008,29(15):2348-2358.
[36]Ekaputra AK,Prestwich GD,Cool SM,et al. Combining electrospun scaffolds with electrosprayed hydrogels leads to threedimensional cellularization of hybrid constructs[J].Biomacromolecules,2008,9(8):2097-2103.
[37]Lannutti J,Reneker D,Ma T,et al.Electrospinning for tissue engineering scaffolds[J].Materials Science & Engineering CBiomimetic and Supramolecular Systems,2007,27(3):504 -509.
[38]Yixiang D,Yong T,Liao S,et al.Degradation of electrospun nanofiber scaffold by short wave length ultraviolet radiation treatment and its potential applications in tissue engineering[J].Tissue Eng Part A,2008,14(8):1321-1329.
[39]Lootz D,Behrend D,Kramer S,et al.Laser cutting:Influence on morphological and physicochemical properties of polyhydroxybutyrate[J].Biomaterials,2001,22(18):2447 -2452.
[40]吕大娟,童杏林,李磊,等.激光加工组织工程生物材料研究进展[J].激光杂志,2009,30(4):7-9.
[41]McCann JT,Marquez M,Xia YN.Highly porous fibers by electrospinning into a cryogenic liquid[J]. Journal of the American Chemical Society,2006,128(5):1436-1437.
[42]SimonetM,SchneiderOD,NeuenschwanderP,etal.Ultraporous 3d polymer meshes by low-temperature electrospinning:Use of ice crystals as a removable void template[J].Polymer Engineering and Science,2007,47(12):2020-2026.
[43]迟冰,俞昊,朱美芳.干喷湿法静电纺丝研究进展[J].合成纤维工业,2010,33(3):45-48.
[44]Smit E,Buttner U,Sanderson RD.Continuous yarns from electrospun fibers[J].Polymer,2005,46(8):2419 - 2423.
[45]ZhangDM,ChangJ. Electrospinningofthree-dimensional nanofibrous tubes with controllable architectures[J]. Nano Letters,2008,8(10):3283-3287.
[46]Zhang D,Chang J. Patterning of electrospun fibers using electroconductive templates[J].Advanced Materials,2007,19(21):3664-3667.
[47]Stankus JJ,Guan JJ,Fujimoto K,et al. Microintegrating smooth muscle cells into a biodegradable,elastomeric fiber matrix[J].Biomaterials,2006,27(5):735 - 744.
[48]Yang XC,Shah JD,Wang HJ.Nanofiber enabled layer-by-layer approach toward three-dimensional tissue formation[J].Tissue Engineering Part A,2009,15(4):945-956.
[49]Moroni L,Schotel R,Hamann D,et al.3d fiber-deposited electrospun integrated scaffolds enhance cartilage tissue formation[J].Advanced Functional Materials,2008,18(1):53 -60.
