高压处理对大米蛋白溶解性及其分子特征的影响
2012-11-23王章存崔胜文田卫环赵学伟郑坚强李昌文袁道强
王章存 崔胜文 田卫环 赵学伟 郑坚强 李昌文 袁道强
高压处理对大米蛋白溶解性及其分子特征的影响
王章存 崔胜文 田卫环 赵学伟 郑坚强 李昌文 袁道强
(郑州轻工业学院食品与生物工程学院,郑州 450002)
研究了pH 8.0和pH 10.0条件下500 MPa高压处理对热变性大米蛋白溶解性的影响,并用Sephadex G-100色谱和SDS-PAGE分析了其分子特征的变化,用扫描电镜观察了大米蛋白的表观特征。结果显示,pH 8.0时500 MPa处理可使大米蛋白的溶解性由12.03%提高到19.15%,pH 10.0时高压处理则可由16.60%提高到24.87%。高压处理后的大米蛋白颗粒表面疏松,可使较大的蛋白质分子溶出,也产生了更小的蛋白质分子,且高压与非高压时溶出的蛋白质组分具有不同的紫外吸收特征。高压处理后的可溶性蛋白中均含有14、35 ku和少量22 ku亚基,非可溶性部分中除上述亚基外,还含有12、16、110 ku亚基。表明不同高压处理影响大米蛋白的溶解性能和分子特征,但对亚基的影响不明显。
大米蛋白 高压 溶解性 分子特征
以大米为原料的淀粉糖和发酵工业生产中有大量的副产品大米蛋白,因其加工过程经历了90℃以上的高温,蛋白质发生严重的热变性而难溶于水,很难在食品工业中应用。国内有很多关于提高这种热变性大米蛋白溶解性的研究报道,主要用强碱溶液或酶解技术,但其溶解性能一直未能很好解决[1-4]。强碱法溶解大米蛋白显然不适用于食品工业,而酶解过程中即使增加酶用量或延长酶解时间等也只能使约60%的蛋白质溶解,这与其他蛋白质的酶解有很大不同。目前文献中只有少量关于热变性米蛋白分子结构特征的报道[5-7],一个重要原因是该蛋白难以溶解,常规的技术手段和方法无法有效应用,所以大米蛋白不溶解甚至抵抗酶解的原因至今尚不清楚。
大量研究表明,高压处理可以改变蛋白质颗粒的聚集状态和高级结构,影响蛋白质中—S—S—的存在状态,从而影响蛋白质的功能性质和蛋白质的酶解模式例如,用200 MPa处理脱脂乳可导致β-乳球蛋白(β-Lg)形成以—S—S—连接的二聚体,800 MPa处理又使β-Lg亚基分离,而此时其他小分子乳清球蛋白却发生聚集[8]。β-Lg经过200 MPa高压处理后就可以被胃蛋白酶水解[9],经400 MPa处理后酶解10 min就不存在完整的 β -Lg分子[10],经600 MPa处理后酶解1 min即可被水解成1 500 u以下的小分子[11]。Kieffer等[12]发现200 MPa处理小麦面筋蛋白可降低其面筋强度,增加游离—SH的含量;若进一步增加压力可导致面筋蛋白质分子内部发生—S—S—的断裂和重排。可见,高压处理对蛋白质的影响效果与压力大小、保压时间、温度、蛋白质种类甚至溶剂条件等因素有关。
本试验研究不同pH条件下高压处理对大米蛋白溶解性及某些分子特征的影响,为进一步改善大米蛋白溶解性的技术方法提供依据。
1 材料与方法
1.1 材料与试剂
大米蛋白:以荆州汉科生物公司生产淀粉糖中的副产品为原料,按文献[13]方法经水洗脱糖后所得。凯式定氮法测定CP=75.02%。
Sephadex G-100:瑞典Pharmacia公司;N,N,N',N'-四甲基乙二胺(TEMED):FLUKA公司;考马斯亮兰R250:FLUKA公司;丙烯酰胺(Acr),N,N'-亚甲基双丙烯酰胺(Bis):Amresco公司;低分子质量标准蛋白(Mr.14 400~97 400):大连宝生物有限公司。
1.2 仪器与设备
UHP900×2-Z超高压处理装置:包头文天科技公司;UV-8100 B紫外可见分光光度计:北京Lab-Tech仪器公司;BSZ-100自动部份收集仪和HL-2恒流泵:上海沪西分析仪器厂;DYY-7C电泳仪和DYCZ-24DN电泳槽:北京六一仪器厂;JSM-6490LV扫描电子显微镜:日本电子公司。
1.3 试验方法
1.3.1 样品的超高压处理
准确称取大米蛋白5.0 g分别悬浮于100 mL的pH 8.0,pH 10.0水溶液中。将上述蛋白样品溶液于两层聚乙烯塑料袋(8 cm×10 cm)中真空密封(不留顶隙),置于压力容器内腔,浸没于加压介质中,于25℃下设定压力500 MPa,高压处理30 min。升压、降压均在1 min内完成。样品经高压处理后1 000 r/min离心10 min,分析可溶物和不溶物组分的相关指标。
1.3.2 蛋白质的溶解性
利用双缩脲法测定可溶性蛋白的含量。以可溶部分蛋白与原料蛋白含量比值表示。
1.3.3 SDS-PAGE分析
采用Laemmli电泳系统[14],分离胶质量分数为15%和浓缩胶质量分数为4%。可溶部分和不溶部分蛋白经还原性样品缓冲液(含巯基乙醇和SDS)处理。不溶部分利用0.01 mol/L NaOH预处理。电泳结束后,用考马斯亮蓝R-250染色。
1.3.4 Sephadex G-100色谱分析
将离心上清液用0.45μm微孔滤膜过滤上样。色谱柱1.2 cm×100 cm,进样量为2.5 mL。洗脱液为0.9%的生理盐水,流速为20 mL/h,以每管2.5 mL收集,用紫外检测器280 nm检测蛋白质含量,并绘制洗脱曲线。
1.3.5 扫描电镜分析(SEM)
将沉淀部分冷冻干燥。取适量干燥后样品,分散在贴有双面胶的SEM的样品台上,通过离子溅射在样品上喷金后,用扫描电子显微镜观察形态结构[15]。扫描电镜工作条件:高压10 kV,束流5×10-9mA,工作距离15 mm。
1.3.6 数据处理
试验数据均进行3次重复试验,利用SPSS17.0软件进行方差分析和Duckey分析(95%置信区间)。
2 结果与讨论
2.1 高压对蛋白溶解性的影响
研究了pH 8.0和pH 10.0两种pH条件下500 MPa高压处理对大米蛋白溶解性的影响,并以未高压处理为对照,测定结果(表1)显示,在相同压力条件下,大米蛋白在pH 10.0时的溶解性高于pH 8.0,而相同pH时,500 MPa高压处理使大米蛋白的溶解性增加更显著,这可能是高压改变了蛋白质的分子结构或者某些类型共价键(如-S-S-)的存在状态,从而改善蛋白质的溶解性。
进一步对-SH含量的测定发现,以单位质量的蛋白质为基数,不同处理样品的可溶性蛋白-SH含量差别不大,说明-SH状态可能是影响大米蛋白溶解性的必要条件。

表1 不同pH和压力下蛋白的溶解性/%
2.2 可溶性组分的凝胶色谱分析
利用Sephadex G-100凝胶色谱对pH 8.0时500 MPa高压和非高压(即0.1 MPa常压)处理样品的可溶性组分进行了分析(图1),可以看出,常压时可溶性组分出现2个峰(峰1和2),保留时间分别为80 min和215 min,而高压处理样品分离出3个峰(峰Ⅰ,Ⅱ,Ⅲ),保留时间分别为80、200和265 min。峰Ⅰ与峰1保留时间相同,峰Ⅱ的保留时间则小于峰2,这表明高压处理后有较大分子的蛋白质溶出,而峰Ⅲ比峰2的保留时间更长,说明高压使常压下可溶的部分蛋白质分子变得更小,也许这些蛋白分子发生了降解或二硫键的断裂。
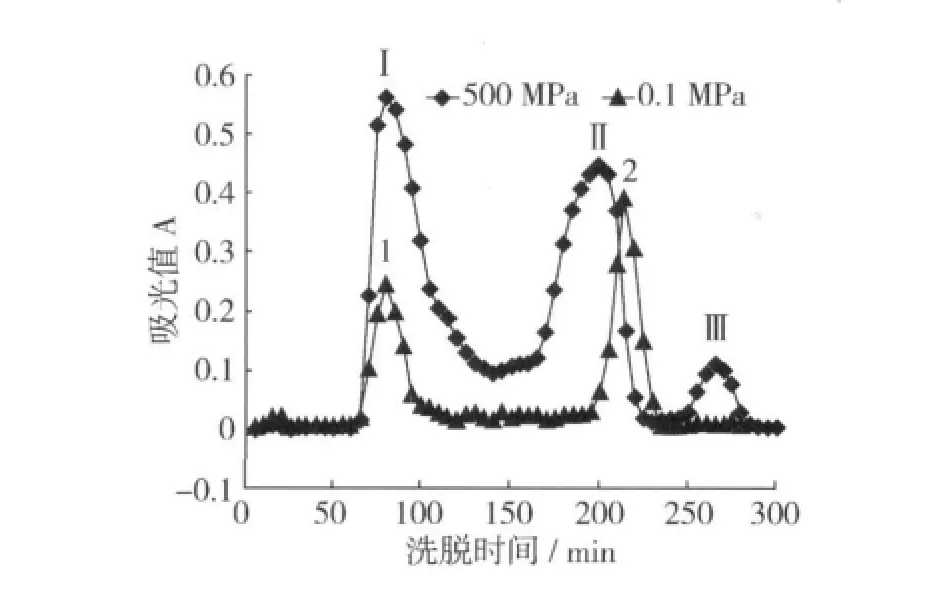
图1 pH 8.0下常压和500 MPa处理蛋白样品凝胶色谱
为了进一步探讨可溶性成分的分子特征,测定了上述不同洗脱峰组分的紫外扫描吸收曲线(图2)。结果表明,常压处理样品的峰1和峰2有明显的差别,前者只在204 nm处有较强的光吸收,后者在214 nm和270 nm处光吸收较强;而500 MPa处理样品的峰Ⅰ和峰Ⅱ均在240 nm处表现出强烈的光吸收性,且二者吸收曲线形状相近,但与常压处理的样品有显著差异。这意味着500 MPa处理所溶出的蛋白质组分与常压时的溶出组分具有不同的分子组成和结构特征。
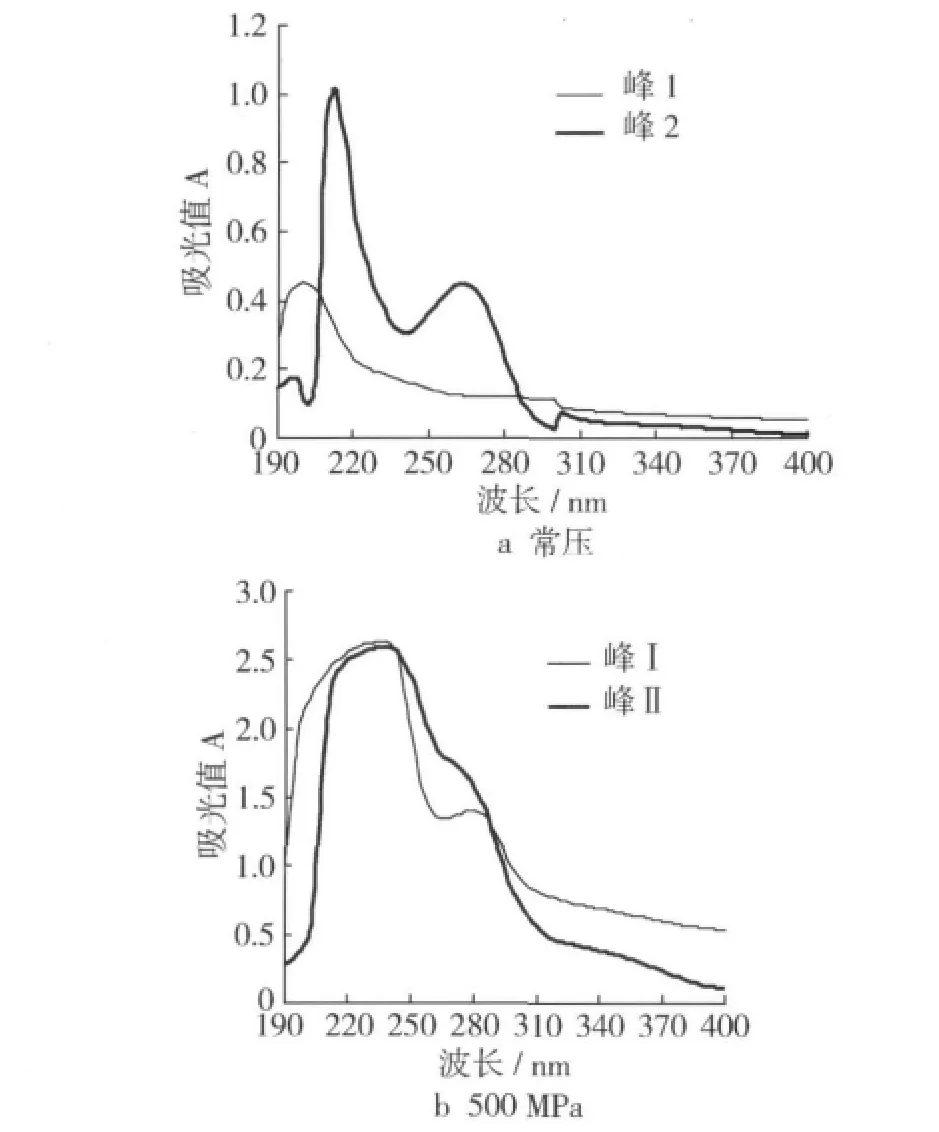
图2 不同处理样品洗脱组分的紫外吸收曲线
2.3 可溶性蛋白和不溶性蛋白结构的分析
为了进一步探讨高压处理对热变性大米蛋白亚基结构的影响,对不同高压处理后可溶性部分和不溶性部分样品进行了SDS-PAGE分析(图3)。
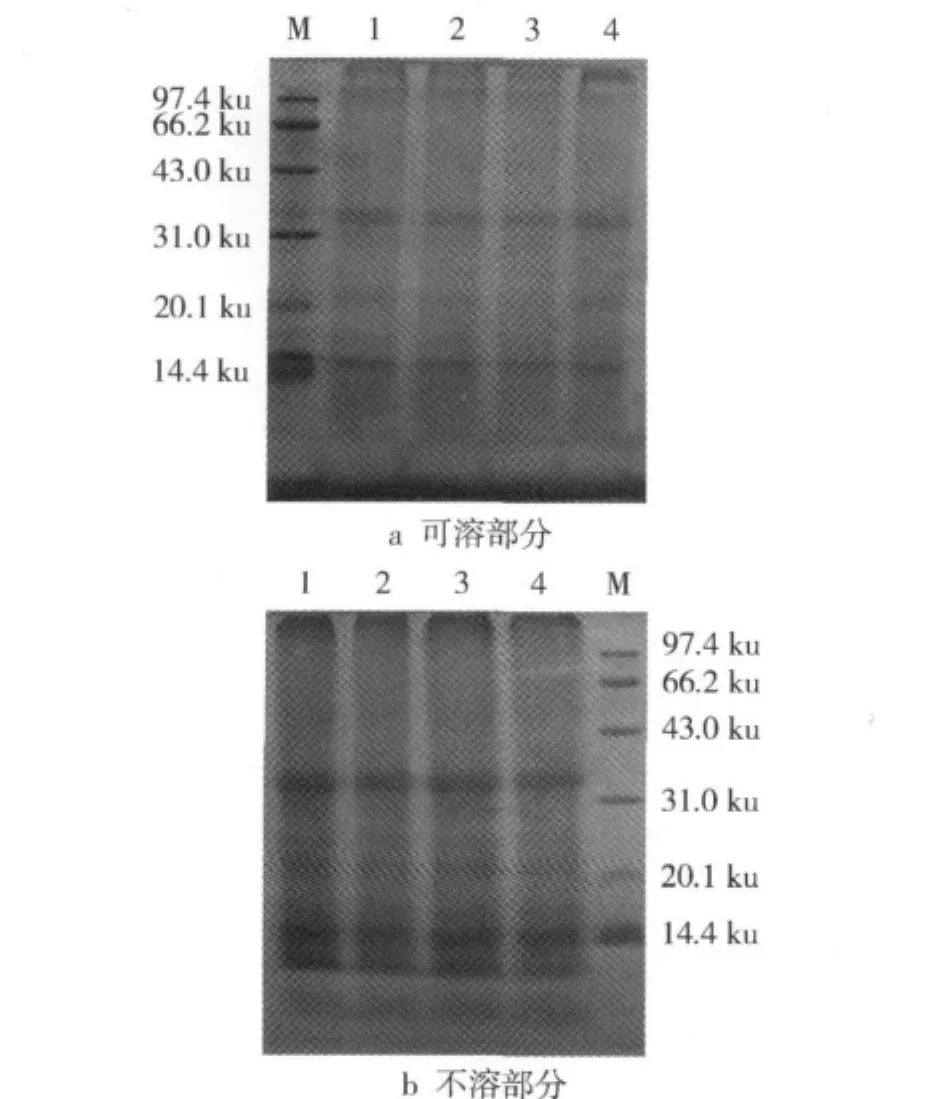
图3 不同高压处理样品SDS-PAGE图谱
可以看出,不同高压处理所得可溶部分具有相近的亚基,包括主要的14、35 ku和少量的22 ku组分;不溶部分样品也具有相近的亚基组分,包括12、14、35、110 ku主要亚基和少量的22、26 ku亚基,这与未经高温作用大米蛋白的亚基组成相近[16]。据文献报道,大米中主要有13 ku的醇溶蛋白、22、37~39、57 ku的谷蛋白和少量10~200 ku的清蛋白、球蛋白[15]。热变性米蛋白实际上是这几种蛋白质的混合体。上述现象表明,高压处理并没有破坏大米蛋白的亚基结构,蛋白质的溶解性与其分子质量大小没有直接的对应关系。这与图1凝胶色谱分析的结果有相似之处。需要说明的是,本试验曾对溶解性蛋白样品进行了多次PAGE分析,但均出现严重拖尾现象,其原因可能是PAGE中蛋白质分子大小和带电荷量均影响电泳速度,还可能与大米蛋白是糖蛋白有一定关系[6]。另外,水不溶性蛋白样品在电泳时用样品溶解液(含巯基乙醇、SDS等)也只能使部分蛋白质溶解。总之,对高压处理后可溶及仍不溶大米蛋白组分和结构特征有待于进一步深入研究。
2.4 扫描电镜图谱分析(SEM)
SEM可以观察了解蛋白质样品的表面结构,有助于对其结构进行分析。本试验对蛋白质样品的SEM观察结果(图4)显示:高压处理可以改变大米蛋白样品的表面结构。未经高压处理的样品表面较平滑,结构紧密,外观呈片层状,500 MPa高压处理后的蛋白样品表面膨松,呈蜂窝状。高压改善大米蛋白的溶解性能以及溶解的蛋白质分子表现出不同的结构特征(图2)可能与高压处理后蛋白质的这种结构变化有很大关系。

图4 常压和500 MPa处理大米蛋白扫描电镜图谱
3 结论
3.1 高压可以改善大米蛋白的溶解性能。不同pH条件下,高压处理均表现出明显的效果。高压处理对蛋白质分子结构或存在状态的改变是增加其溶解性能的重要基础。
3.2 与未高压处理者相比,大米蛋白经高压处理后可使较大的蛋白质分子溶出,也产生了更小的蛋白质分子,但SDS-PAGE分析显示,高压对大米蛋白的亚基结构没有产生明显影响,二者之间的确切关系有待于进一步研究。
[1]王亚林,陶兴无,钟方旭,等.碱酶两步法提取米渣中蛋白质的工艺研究[J].中国油脂,2002,27:53-54
[2]王章存,姚惠源.大米蛋白质的酶法水解及其性质研究[J].中国粮油学报,2003,18:5-7
[3]玄国东,何国庆,熊皓平.大米蛋白酶法改性及酶解物功能特性研究[J].中国粮油学报,2005,20(3):1-4
[4]黄军,熊华,李亮,等.米渣酶解工艺及其蛋白等电点测定[J].食品工业科技,2008,29:174-176
[5]王章存,董吉林,郑坚强,等.热变性大米蛋白的结构和性质研究-II米蛋白组分特征[J].中国粮油学报,2008,23(4):1-4
[6]王章存,董吉林,郑坚强,等.热变性大米蛋白的结构和性质研究-III米蛋白和糖的结合特性[J].中国粮油学报,2008,23(3):8-11
[7]赵殷勤,张晖,郭晓娜,等.米渣蛋白和大米蛋白的结构及性质比较[J].粮食与饲料工业,2010,(9):22-24
[8]Patel H,Singh H,Anema S,et al.Effects of heat and high hydrostatic pressure treatments on disulfide bonding interchanges among the proteins in skim milk[J].Agric.Food Chem.,2006,54:3409-3420
[9 Izquierdo F,Alli I,Gomez R.Effects of high pressure and microwave on pronase andα -chymotrypsin hydrolysis ofβlactoglobulin[J].Food Chemistry,2005,92:713-719
[10]Chicon R,Belloque J,Elena A,et al.Antibody binding and functional properties of whey protein hydrolysates obtained under high pressure[J].Food Hydrocolloids,2009,23:593 -599
[11]Zeece M,Huppertz T,Kelly A.Effect of high-pressure treatment on in-vitro digestibility ofβ -lactoglobulin[J].Innovative Food Science and Emerging Technologies,2008(9):62-69
[12]Kieffer R,Schurer F.Effect of hydrostatic pressure and temperature on the chemical and functional properties of wheat gluten[J].Cereal Sci.,2007,45:285-292
[13]许建秋.大米生产饴糖下脚料(糖渣)的综合利用[J].粮食与饲料工业,2001,3:47
[14]夏其昌编.蛋白质电泳技术指南[M].北京:化学工业出版社,2007
[15]李剑平.扫描电子显微镜对样品的要求及样品的制备[J],分析测试技术与仪器,2007,13(1):74-77
[16]王章存,申瑞玲,姚惠源.大米蛋白研究进展[J].中国粮油学报,2004,19(2):11-14.
Effect of High-Pressure on the Solubility and Molecular Character of Rice Protein
Wang Zhangcun Cui Shengwen Tian Weihuan Zhao Xuewei Zheng Jianqiang Li Changwen Yuan Daoqiang
(School of Food&Bioengineering,Zhengzhou University of Light Industry,Zhengzhou 450002)
The effect of High Hydrostatic Pressure(HHP)processing on the solubility and molecular character of thermo-denatured rice protein was studied by Sephadex G-100 chromatography,Sodium Dodecyl Sulfate Polyacylamide Gel Electrophoresis(SDS-PAGE)and Scanning Electron Microscope(SEM).The results showed that after treated by HHP,The ratio of soluble rice protein was increased from12.03%(at 0.1 MPa,pH 8.0)to 19.15%(after 500 MPa for 30 min,pH 8.0)and from 16.60%(at 0.1 MPa,pH 10.0)to 24.87%(after 500 MPa for 30 min,pH 10.0)receptivity;The surface of rice protein particles became loosen,the bigger molecule of the protein was dissolved in the solution and smaller molecular protein was produced,compared with that of not HHPtreated protein.The solubility rice protein produced by different pH and HHPprocessing contained 14,35 and 22 ku subunits,but the insolubility rice protein,in addition to these subunits,contained 12,16 and 110 ku subunits also.
rice protein,high pressure,solubility,molecular characterization
TS209
A
1003-0174(2012)06-0001-04
国家自然科学基金(31071517)
2011-08-19
王章存,男,1963年出生,博士,教授,粮油蛋白质深加工
