不同破除休眠处理对小麦新种子POD活性的影响
2012-11-23孔治有刘叶菊
覃 鹏 孔治有 刘叶菊 陈 佳 王 硕
不同破除休眠处理对小麦新种子POD活性的影响
覃 鹏1孔治有2刘叶菊3陈 佳1王 硕1
(云南农业大学农学与生物技术学院1,昆明 650201)
(保山学院资环学院2,保山 678000)
(云南农业大学研究生处3,昆明 650201)
为研究不同方法破除休眠处理对小麦种子POD活性的影响,将新收获小麦种子用低温(2、4、6、8℃分别处理3、6、9、12 d)、H2O2(质量分数为0%、0.31%、0.63%、0.95%,在18、20、22℃下分别处理8、16、24 h)、GA3(质量分数为0、0.025‰、0.050‰、0.075‰、0.1‰,在18、20、22℃下分别处理8、16、24 h)进行处理,并测定分析种子过氧化物酶(POD)活性。结果表明:低温处理小麦新种子时,处理时间对POD活性无显著影响;H2O2处理小麦新种子时,随处理浓度的升高和处理时间的延长,POD活性呈显著降低趋势;各GA3处理浓度对POD活性的影响无显著差异,但均显著低于对照,各试验材料之间无显著差异。
小麦 POD活性 新种子 休眠
小麦种子具休眠特性,未解除休眠态种子的最大特点就是在适宜的外界条件下(水分、温度、O2)发芽率低甚至不发芽[1-4]。大多数小麦种子在正常播种时休眠期已结束,因而不需另作处理,但随着现代小麦育种对夏繁加代、扩繁的日益重视,于是提前打破休眠、提高种子发芽率显得十分必要。过氧化物酶(POD)是植物抗氧化酶系统中重要的酶,它在活性氧自由基的清除、抑制膜脂过氧化等植物抗逆生理方面发挥重要的作用,能催化H2O2分解其他底物-消耗H2O2,与SOD相互协调有效地清除代谢过程中产生的活性氧,从而防止了活性氧引起的膜脂过氧化及其他伤害过程[5-6]。可有效消除酚类,从而避免酚类氧化成醌致使小麦处于休眠状态[7]。
对于解除化学抑制因素所导致的种子休眠,所采用的方法主要是以下几种:①植物激素处理:某些植物激素有促进种子发芽的作用。例如赤霉素可促进mRNA及在它控制下的特定酶的活性,从而有破除休眠、促进发芽的作用。用适当的植物激素处理种子可以使休眠种子中存在的化学因素钝化或失效。对于不同种子,浸泡的适宜浓度与时间应经过试验测定,因植物种类而异。除了赤霉素之外,也可用赤霉酸的钾盐或用激动素处理种子,方法与赤霉
目前的研究大多只注重发芽率等直观因素,对打破休眠的生理生化过程和种子的反应缺乏研究。本试验通过低温、H2O2和GA3不同处理对3个品系的小麦新种子分别进行处理,研究其对种子POD活性的影响,分析种子POD活性与种子活力大小的关系、以及破除休眠处理过程中导致POD活性变化的可能因素,从而对小麦种子的贮藏及加代扩繁提供参考。
1 材料与方法
1.1 材料
保山基地2010年夏新收获的3个弱冬性品系的小麦种子KQ11、KQ3和KQ27。
1.2 方法
3个品系小麦种子各10粒,在2、4、6和8℃分别进行3、6、9和12 d的低温处理;18、20、22℃ 下用0%、0.31%、0.63%、0.95%的H2 O2和0‰、0.025‰、0.05‰、0.075‰、0.100‰的GA3分别处理8、16和24 h。所有处理后的种子置于超低温冰箱保存备用。
以愈创木酚法[25]测定POD活性。所得数据用DPS软件进行分析处理,2次重复。
2 结果与分析
2.1 低温处理对小麦新种子POD活性的影响
从表1可见,处理温度和试验材料均对POD活性有极显著影响;处理温度与试验材料、处理时间与试验品系、以及3者之间共同作用对小麦新种子POD活性有极显著影响。
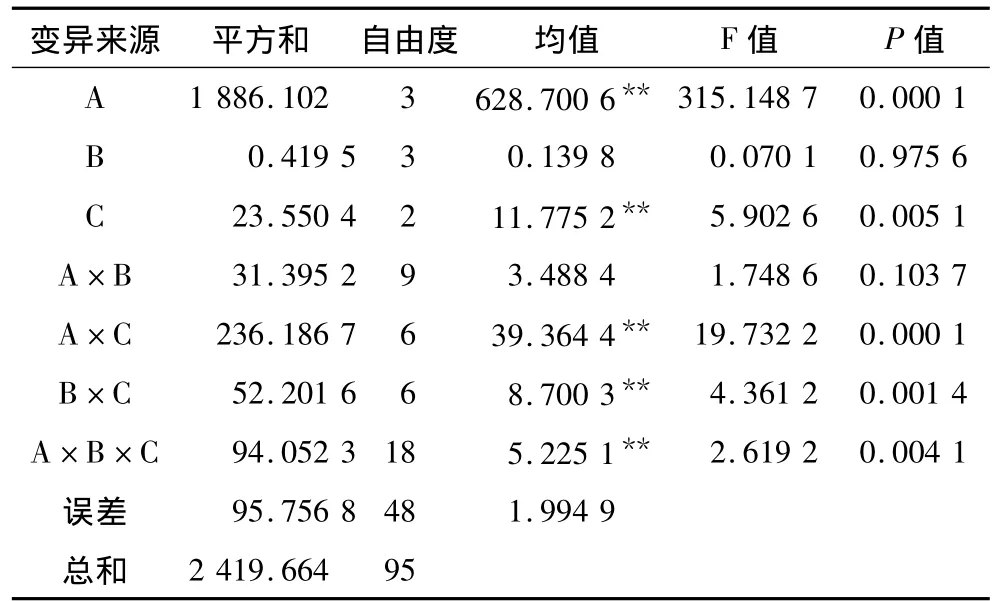
表1 不同处理因素作用下方差分析
温度对小麦新种子POD活性的影响中,4℃下最高(13.306 8μ·mg-1 Protein)、8℃处理次之(9.408 1μ·mg-1Protein)且均达极显著差异,而2℃和6℃处理之间无显著差异(分别为3.294 8 μ·mg-1Protein和2.598 0μ·mg-1Protein);低温处理时间对小麦新种子POD活性无显著影响;试验材料中KQ27的POD活性(7.824 2μ·mg-1Protein)最高、KQ11(6.645 5μ·mg-1Protein)最低且达极显著水平。
2.2 H2O2处理对小麦新种子POD活性的影响
表2表明,H2O2处理浓度、处理温度、处理时间和试验材料等单独作用下POD活性有极显著影响;处理浓度与处理时间、处理温度与处理时间、处理温度与试验材料、处理时间与试验材料协同作用对POD活性有极显著影响;此外,处理温度、处理时间与试验材料之间协同作用对POD活性也有极显著影响。
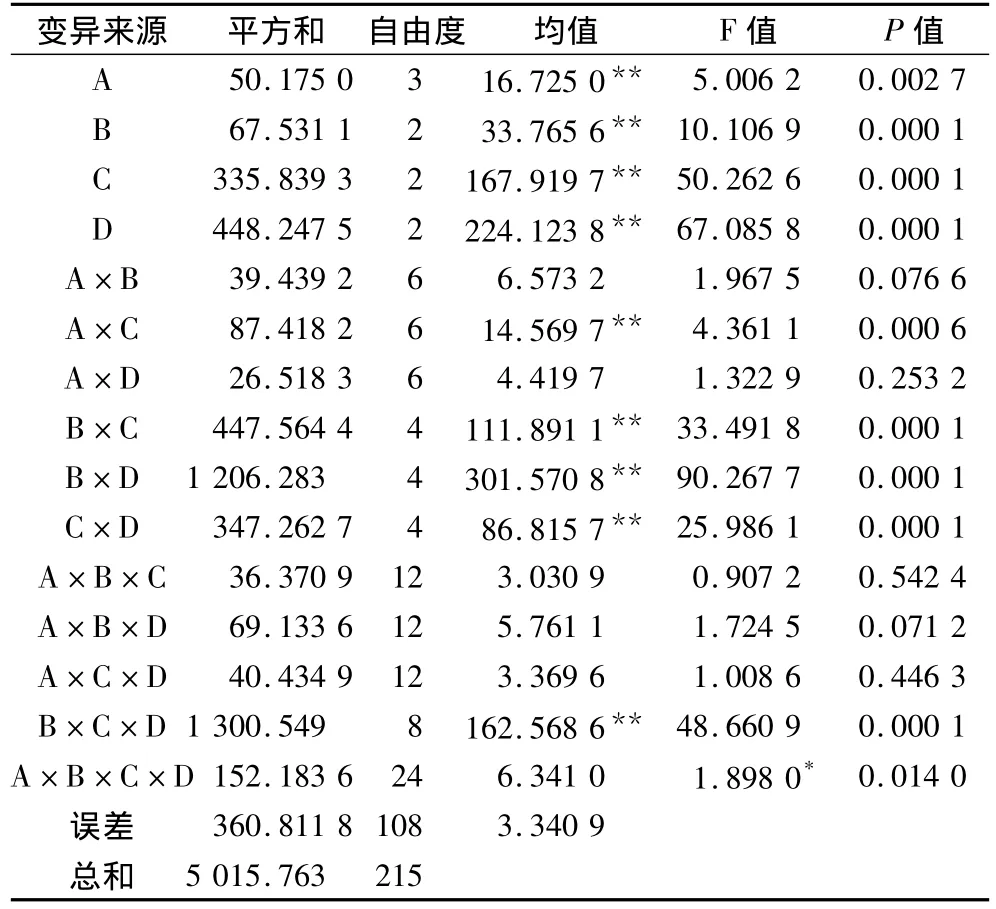
表2 不同处理因素作用下方差分析
H2O2处理中,对照(0%)和0.31%处理下的POD活性(分别为6.274 5μ·mg-1 Protein和6.076 5 μ·mg-1Protein,无显著差异)极显著高于0.63%(5.557 1μ·mg-1 Protein)和0.95%(5.035 1μ·mg-1Protein),随处理浓度的升高,小麦新种子POD活性呈显著降低趋势;处理温度18℃处理下的POD活性(6.487 7μ·mg-1 Protein)极显著高于20℃(5.571 8 μ·mg-1Protein)和22℃(5.147 8μ·mg-1Protein),而后2种处理温度间POD活性无显著差异;随处理时间的延长,POD活性呈极显著降低趋势(8、16和24 h分别为7.271 2、5.719 1和4.217μ·mg-1Protein);而试验材料中KQ27的POD活性(7.543 7μ·mg-1Protein)最高,KQ3活性(4.018 6μ·mg-1Protein)最低,差异极显著。
2.3 GA3处理对小麦新种子POD活性的影响
当以GA3处理小麦新种子时,处理浓度、处理温度、处理时间和试验材料4个因素以及4因素之间协同作用,除试验材料对POD活性无显著影响外,其余所有因素或因素定的协同作用均有极显著影响(表3)。
各GA3处理浓度对POD活性的影响无显著差异,但均显著低于对照(6.274 5μ·mg-1Protein);处理温度中22℃和18℃处理下POD活性无显著差异(分别为6.091 8μ·mg-1 Protein和6.070 9μ·mg-1Protein),但均极显著高于20℃处理(3.537 8 μ·mg-1Protein);处理时间中处理8 h和24 h下POD活性无显著差异(分别为3.896 4μ·mg-1Protein和3.789 4μ·mg-1 Protein),但均极显著低于处理16 h(8.014 7μ·mg-1 Protein);此外试验材料之间POD活性无显著差异。

表3 不同因子作用下方差分析
3 讨论
植物体内存在着活性氧的产生和消除2个过程,在低温条件下,细胞内产生较多的活性氧,使膜系统遭到破坏。植物体内为防止自由基的伤害,产生了一些活性物质以维持正常的生理功能,POD就是一种保护酶。POD以过氧化氢为电子受体催化底物氧化的酶[26],主要是将H2O2水解,从而对细胞起保护作用。
本试验中,以一定梯度的低温对小麦新种子进行处理,POD活性受处理温度和试验材料影响较大,而未受处理时间影响,其中尤以4℃下POD活性最高,可能是该温度处理更能促进POD对H2O2的清除,从而保护细胞免受低温伤害。
当以H2O2处理时,随处理浓度的升高和处理时间的延长,POD活性呈显著降低趋势,说明即使是低浓度的随处理浓度的升高和处理时间的延长,POD活性呈显著降低趋势也会对小麦种子产生伤害,且处理浓度越高、处理时间越长对种子的伤害也越大,因此在以H2O2破除小麦种子休眠时,必须在较低浓度和较短时间内进行,从而保证在尽可能少伤害种子的情况下达到最好的破除休眠效果。
GA3处理浓度对POD活性的影响无显著差异,但均显著低于对照,且各试验材料之间无显著差异,说明以GA3进行处理时,尽管对种子会造成一定影响,但一定范围内的浓度大小对种子的影响不大;此外GA3处理下各试验材料没有显著差异,因此针对试验材料具有广泛性,将来可考虑在一定浓度范围内对各种小麦材料进行破除休眠处理。
4 结论
低温处理小麦新种子时,处理温度和处理材料对POD活性影响极显著。
H2O2处理小麦新种子时,处理浓度、处理温度、处理时间和试验材料均对POD活性有极显著影响,随处理浓度的升高和处理时间的延长,POD活性呈显著降低趋势。
GA3处理小麦新种子时,处理浓度、处理温度和处理时间对POD活性影响极显著,各GA3处理浓度下POD活性均显著低于对照。
[1]江苏农学院.植物生理学[M].北京:农业出版社,1986
[2]李扬汉.植物学[M].上海:上海科学技术出版社,1982
[3]AlanMounford.English in Agriculture[M].Oxford:Oxford U-niversity Press,1988
[4]南京农业大学,江苏农学院,湖北农学院,等.作物栽培学[M].北京:农业出版社,1991
[5]周光宇.有关同工酶分析的几个问题[J].植物生理学通讯,1983(1):14-15
[6]胡能书.同工酶技术及其应用[M].长沙:湖南科学技术出版社,1985
[7]莫开菊.过氧化物酶在园艺植物研究中的应用[J].四川果树,1993,2:87-88
[8]张宗宸.H2O2浸种变温处理打破小麦休眠期的研究[J].山西小麦通讯,1994(2):33-34
[9]孙艳,崔鸿文,李文平.几种化学物质浸种对辣椒种子发芽力的影响[J].种子,1999(5):17-19
[10]Adkins S W,J D Ross.Studies in wild oat seed dormancy:I.The role of ethylene in dormancy breakage and germination of wild oat seeds(Avena fatua L.)[J].Plant Physiol,1981,67(2):358-362
[11]Adkins S W,J D Ross.Studies in wild oat seed dormancy:II.Activities of pentose phosphate pathway dehydrogenases[J].Plant Physiol,1981,68(1):15-17
[12]Alboresi A,C Gestin.Nitrate,a signal relieving seed dormancy in Arabidopsis[J].Plant Cell Environ,2005,28(4):500-512
[13]Alonso-Blanco C,L Bentsink.Analysis of natural allelic variation at seed dormancy loci of Arabidopsis thaliana[J].Genetics,2003,164(2):711-729
[14]Ballard L A,A E Lipp.Seed dormancy:breaking by uncouplers and inhibitios of oxidative phosphorylation[J].Science,1967,156(773):398-399
[15]Bentsink L,J Jowett.Cloning of DOG1,a quantitative trait locus controlling seed dormancy in Arabidopsis[J].Proc Natl Acad Sci USA,2006,103(45):17042-17047
[16]Berrie A M,M R Hendriel.Induction of Light Sensitive Dormancy in Seed of Lactuca sativa L.(Lettuce)by Patulin[J].Plant Physiol,1967,42(6):889-890
[17]Bethke PC,I GLibourel.The Arabidopsis aleurone layer responds to nitric oxide,gibberellin,and abscisic acid and is sufficient and necessary for seed dormancy[J].Plant Physiol,2007,143(3):1173-1188
[18]Bethke P C,I GLibourel.Nitric oxide reduces seed dormancy in Arabidopsis[J].J Exp Bot,2006,57(3):517-526
[19]Bewley JD.Seed germination and dormancy[J].Plant Cell,1997,9(7):1055-1066
[20]Bouteau H,M C Job.ROSSignaling in seed dormancy alleviation[J].Plant Signal Behav,2007,2(5):362-364
[21]Briggs C L,E C Morris.Seed-coat dormancy in Grevillea linearifolia:little change in permeability to an apoplastic tracer after treatment with smoke and heat[J].Ann Bot,2008,101(5):623-632
[22]Briggs CL,E CMorris.Investigations into seed dormancy in Grevillea linearifolia,G.buxifolia and G.sericea:anatomy and histochemistry of the seed coat[J].Ann Bot,2005,96(6):965-980
[23]Chibani K,S Ali-Rached.Proteomic analysis of seed dormancy in Arabidopsis[J].Plant Physiol,2006,142(4):1493-1510
[24]王永健,差盎巍,曹宛虹,等.低温对不同品种黄瓜种子萌发过氧化物酶及同工酶的影响[J].华北农学报,1995,10(2):72-76
[25]李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000
[26]邵世光,阎斌伦,许云华,等.Cd2+对条斑紫菜的胁迫作用[J].河南师范大学学报:自然科学版,2006,34(2):113-116.
Effect of Different Methods for Breaking Dormancy on POD Activity of just Harvest Wheat Seeds
Qin Peng1Kong Zhiyou2Liu Yeju3Chen Jia1Wang Shuo1
(College of Agronomy and Biotechnology,Yunnan Agricultural University1,Kunming 650201)
(College of Resources and Environment,Baoshan University2,Baoshan 678000)
(Postgraduate Administration Offices,Yunnan Agricultural University3,Kunming 650201)
In order to research the different methods on POD activity of dormancy wheat seeds,new harvest wheat seeds were treated with low temperature(2,4,6,8℃for 3,6,9,12 d,respectively),H2O2(0%,0.31%,0.63%0.95%under 18,20 and 22℃for 8℃,16 and 24 h),GA3(0%,0.025‰,0.050‰,0.075‰,0.1‰,under 18,20,22℃for 8,16,24 h),the result showed that the POD activities were unaffected by treatment time under low temperature;the POD activities were trend to decrease with the increasing H2O2concentration and treatment time;though the POD activities were unaffected by GA3concentration,which of them were lower than the control,there were no difference of POD activities among materials.
wheat,POD activity,just harvest seed,dormancy
S512.1;S311
A
1003-0174(2012)06-0005-04
国家自然科学基金(31000712)素处理类似。②其他化学药剂化理:如某些棉籽由于种子内含酚量高,对种子发芽有抑制作用,采用0.8%~1%FeSO4浸泡20~24 h,或0.7%FeCl3浸泡20 h,冲洗后晒干,处理后的种子发芽率明显提高。③低温沙藏:低温沙藏对于打破种子休眠有综合性效果,它可以使休眠的胚后熟,促使化学抑制因素破除,使种子中促进生长的激素水平提高,也使种皮透性改善,容易渗透空气和水分。对于发芽需要经历一个低温时期的种子,采用此法更是必要的[8-24]。
2011-08-25
覃鹏,男,1977年出生,博士,讲师,小麦遗传育种与品质改良
