黄曲霉菌株的分离、鉴定及产毒能力分析
2012-11-23杨生瑞屈凌波孙长坡伍松陵
杨生瑞 屈凌波 孙长坡 沈 晗 沈 瑾 伍松陵
黄曲霉菌株的分离、鉴定及产毒能力分析
杨生瑞1,2屈凌波1孙长坡2沈 晗2沈 瑾3伍松陵2
(河南工业大学生物工程学院1,郑州 450001)
(国家粮食局科学研究院2,北京 100037)
(农业部规划设计研究院农副产品加工研究所3,北京 100126)
对几株从发霉粮食中分离出的黄曲霉菌菌株进行形态学和分子生物学鉴定,并进行发酵培养和产毒能力的HPLC测定。结果表明:试验分离菌株均为黄曲霉菌株且含有黄曲霉毒素产生的关键基因aflR;黄曲霉菌株之间产毒能力差异巨大:黄曲霉菌株3.4408产毒量最高,黄曲霉菌株HDWS产毒量最低,黄曲霉菌株3.2572甚至不产生黄曲霉毒素;产生黄曲霉毒素菌株中部分黄曲霉菌株产生4种黄曲霉毒素AFB1、AFB2、AFG1、AFG2,黄曲霉菌株HDWH只产生黄曲霉毒素AFB1、AFB2。
黄曲霉菌 黄曲霉毒素 aflR基因 高效液相色谱
黄曲霉毒素(Aflatoxin,AF)是所有真菌毒素中对环境污染最严重,对人畜危害最大且毒性最强的真菌次级代谢产物。黄曲霉毒素既有很强的急性毒性,导致肝脏坏死出血,使免疫系统受损,引起蛋白质营养不良症并导致儿童发育受阻,也有明显的慢性毒性引起肝癌,并具有致癌、致畸、致突变作用,对人、家畜和家禽的健康威胁极大,因此受到世界范围的广泛关注。研究表明有7种曲霉属真菌可产黄曲霉毒素,分别为:Aspergillus flavus,A.parasitieus,A.nomius,A.Pseudot-amarii,A.bombycis,A.ochraceorosens及一种分离自西非的未定名分类元,最主要是由黄曲霉(Aspergillus flavus,A.flavus)和寄生曲霉(Aspergillus parasiticus,A.paras-iticus)以玉米、花生和坚果等农作物及其制品为主产生的一类剧毒且致癌的代谢产物[1-3],主要包括:黄曲霉毒素B1(Aflatoxin B1,AFB1)、黄曲霉毒素B2(Aflatoxin B2,AFB2)、黄曲霉毒素G1(Aflatoxin G1,AFG1)和黄曲霉毒素G2(Aflatoxin G2,AFG2),其中AFB1是毒性最强的致肝癌毒素。黄曲霉毒素不仅对人类健康危害极大,而且通过污染农作物给国民经济造成巨大损失。鉴于其危害性很大,因此各国都制定了黄曲霉毒素的最高限量标准以保障消费者的健康。中国规定了除玉米、花生及其制品外,绝大多数食品中的黄曲霉毒素AFB1的含量均不超过5μg/kg;欧盟规定农产品中(AFB1+AFB2+AFG1+AFG2)的最高限量为4μg/kg;美国规定农产品(AFB1+AFB2+AFG1+AFG2)的最高限量为15μg/kg。
黄曲霉毒素生物合成过程非常复杂,共涉及21步酶促反应[4]。参与黄曲霉毒素合成的绝大多数基因聚集于一个特定的基因簇中,由基因簇中各个基因转录和翻译而成[5]。基因簇现象在次生代谢产物合成中比较常见[6]。基因成簇存在也是黄曲霉毒素合成途径等次生代谢途径的重要调控机制之一[7]。黄曲霉毒素生物合成途径的调节基因aflR在黄曲霉毒素产生过程中具有十分重要的作用,aflR基因的表达产物AflR蛋白是一个锌簇转录因子,能够开关黄曲霉毒素途径的其他基因转录,是黄曲霉毒素合成的关键蛋白[8],aflR基因的转录中断可能抑制其他黄曲霉毒素合成相关基因的表达[9]。由于AflR蛋白是黄曲霉毒素生物合成途径中的主要正转录因子[8],大多数黄曲霉毒素合成相关基因受AflR蛋白的调节[10],除了estA基因外,黄曲霉毒素的生物合成途径中相关酶基因的表达都受到AflR蛋白的正调节[11]。
目前,针对黄曲霉毒素的检测方法主要有高效薄层色谱法(TLC)、高效液相色谱(HPLC)法、荧光计和酶联免疫(ELISA)法、样品前处理方法中也多采用免疫亲合柱(IAC)或多功能固相萃取柱进行纯化处理。试验研究用IAC纯化、在线光化学衍生化、HPLC法配荧光检测器测定筛选获得的黄曲霉菌株是否产生黄曲霉毒素[12],以期为解析黄曲霉菌污染的特点和开发黄曲霉毒素防控技术提供帮助。
1 材料和方法
1.1 材料
所用菌株为Aspergillus flavus 3.4408和3.2572,购自中国微生物菌种保藏中心;Asperg-illus flavus HDWS、HDWH和ASAG3三株黄曲霉菌为本试验筛选获得;大肠杆菌JM109,由中国农业科学院植保所惠赠。
1.2 仪器和试剂
DNA聚合酶(KOD-Plus):TOYOBO公司;DNA Marker DL2000,TaKaRa公司;DNA连接酶(PMD 19-T Vector):TaKaRa公司;快速定性滤纸;免疫亲合柱;64R型冷冻离心机:BECKMAN公司;N.Y.10018,U.S.A光化学衍生器:AURA公司;1100型高效液相色谱仪配荧光检测器:Agilent公司;ABI PCR扩增仪:美国Applied Biosystems公司:高速震荡器;氮气吹干仪;六位泵流操作架。
所用水为双蒸水和超纯水;甲醇、乙腈:色谱纯,迪马公司;甲醇、二氯甲烷、正己烷、氯化钠:分析纯,北京化工厂;黄曲霉毒素B1、B1、G1、G2标准溶液:纯度>99%,Sigma公司。
1.3 方法
1.3.1 菌株分离方法
称取黄曲霉毒素超标的发霉玉米和小麦各10 g,用100 mL无菌水搅匀作为原液,然后吸取1 mL依次稀释为10-1至10-88个浓度梯度。分别取各浓度的稀释液200μL涂布于察氏培养基平板上,28℃培养6 d。划线分离得到单菌落,以黄曲霉菌标准菌株3.4408对照,在荧光显微镜下观察进行孢子的形态学鉴定。
1.3.2 产毒关键基因aflR的PCR鉴定
提取曲霉菌基因组DNA,根据aflR基因序列设计特异扩增引物。上游引物为aflR-5'-AACCGCATCCACAATCTCAT-3',下游引物为aflR-5'-AGTGCAGTTCGCTCA GAACA-3'[13]。
以菌株基因组DNA为模版,采用40μLPCR体系,依次加入:4μL 10×Buffer(不含Mg2+),2μL(25 mmol/L)MgSO4,4μL(2 mmol/L)dNTPs混合物,上、下游引物各1μL,1μL的DNA模板和1μL KOD-plus-聚合酶,最后加入26μL无菌去离子水。PCR扩增条件如下:94℃预变性5 min,进入循环程序:94℃变性1 min,52℃退火1 min,68℃延伸1 min,32个循环,再68℃延伸10 min。PCR产物经纯化后插入PMD 19-T载体转化大肠杆菌JM109,送上海英俊生物技术有限公司测序鉴定。测序结果在Gene Bank中做Blast比对分析。
1.3.3 黄曲霉菌的株固体发酵培养
将黄曲霉菌株接种于察氏培养基平板上,28℃恒温培养5 d[14]。取平板上的单菌落接种于察氏斜面培养基上,28℃恒温培养5~6 d。待斜面上布满黄绿色菌丝,并菌丝上略生孢子时,用无菌水制成孢子悬液,接种于装有灭菌大豆培养基的1 000 mL的三角瓶中,再加入无菌蒸馏水混匀,固液比为3:1,置28℃恒温培养21 d。
1.3.4 黄曲霉毒素的萃取[15-16]
取发酵产物20 g,加入5 g氯化钠、100 mL甲醇 -水(55+45)的溶液,于振荡器上振荡30 min,用快速定性滤纸过滤,收集滤液。取50 mL滤液,于250 mL分液漏斗中,向分液漏斗中加入50 mL的正己烷,手动提取约1 min,静置分层,如有乳化,滴加少许甲醇促使分层,甲醇-水层转移至另一分液漏斗,在分液漏斗中加入50 mL的二氯甲烷,萃取分离。将二氯甲烷层收集到150 mL茄形瓶中,再重复萃取2次,收集到同一茄形瓶中,氮气吹干至大约3 mL液体。将3 mL液体用多功能净化柱净化待测。
1.3.5 黄曲霉毒素检测的色谱条件
黄曲霉毒分析柱使用Venusil XBP反相C18柱,粒径:5μm规格:4.6×250 mm;进样量:10μL;柱温:25℃;流动相:甲醇/水(50∶50,体积比);流速:1 mL/mim;荧光检测器:Ex=360 nm,Em=440 nm;采用AURA光化学衍生池柱后衍生。
1.3.6 标准曲线制作
将1μg/mL的AFG1、AFB1和0.3μg/mL的AFG2、AFB2的黄曲霉毒素标准储备液稀释,配成AFG1、AFB1浓度为2、5、10、15、20μg/L;AFG2、AFB2浓度为0.6、1.5、3、4.5、6μg/L的黄曲霉毒素工作溶液。在1.2.5的色谱条件下进样检测,得到标准曲线。
2 结果与讨论
2.1 黄曲霉菌株形态学鉴定
挑取黄曲霉菌株A.Flavus3.4408、A.Flavus HD-WS、A.Flavus HDWH、A.Flavus ASAG3孢子制片,在40倍荧光显微镜下观察黄曲霉菌株孢子形态,结果如图1所示。

图1 荧光显微镜形态学鉴定图
如图1所示,在40倍荧光显微镜下观察筛选菌株孢子形态,同时与黄曲霉标准菌株3.4408对照,初步鉴定本试验筛选获得菌株为黄曲霉菌株。
2.2 曲霉菌株aflR基因PCR扩增结果
利用aflR基因的特异扩增引物通过PCR扩增,核酸电泳如图2所示,分析发现分离菌株得到的aflR基因扩增片段与标准菌株PCR扩增获得的aflR基因片段大小一致,测序结果在Gene Bank中做Blast比对分析表明aflR基因相似度达到99%以上,因此可确定所筛菌株含有黄曲霉毒素产生的关键基因aflR。
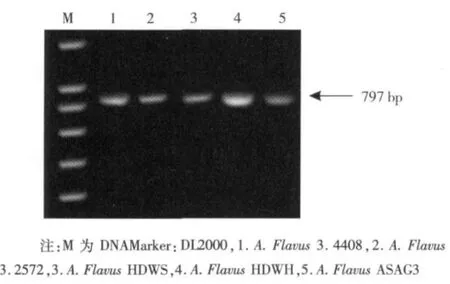
图2 曲霉菌株aflR基因PCR扩增结果
2.3 标准曲线
在所选用色谱条件下,黄曲霉毒素得到良好的基线分离,4种毒素在15 min内出峰,先后顺序为AFG2、AFG1、AFB2、AFB1,图3为黄曲霉毒素标准品色谱图。
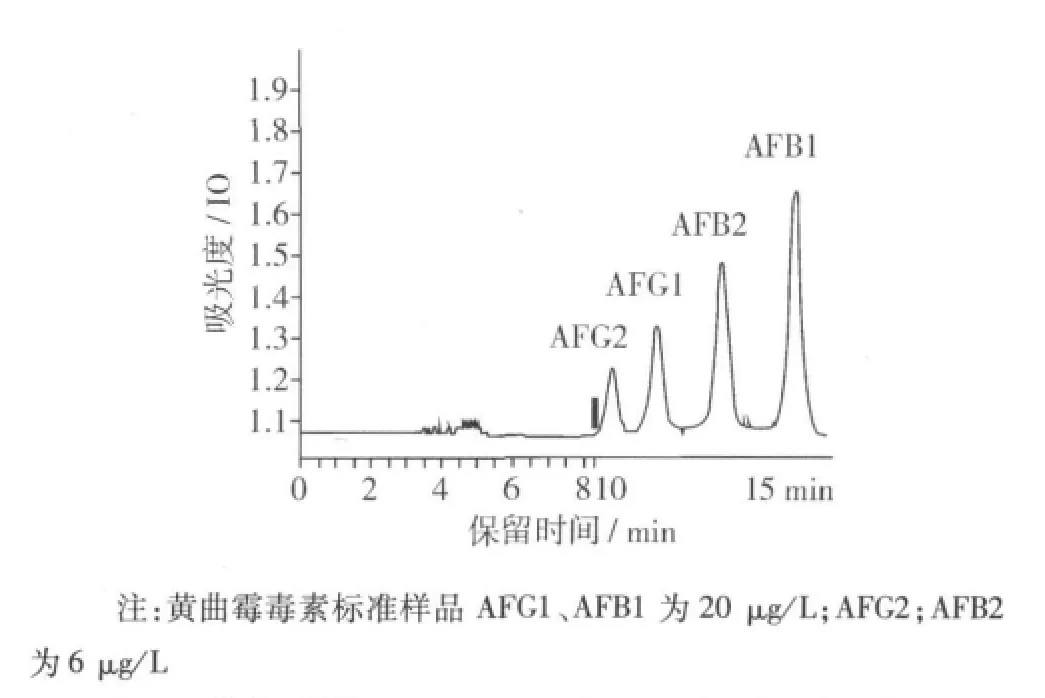
图3 黄曲霉毒素AFG2、AFG1、AFB2、AFB1标准色谱图
分别量取已梯度稀释好的黄曲霉毒素混合标准溶液1 mL,其中AFG1、AFB1质量浓度为2、5、10、15、20μg/L;AFG2、AFB2浓度为6、4.5、3、1.5、0.6 μg/L的黄曲霉毒素工作溶液,在上述条件下进样检测,以黄曲霉毒素的色谱峰面积(Y)为纵坐标,质量浓度(X,μg/L)为横坐标,绘制AFG2、AFG1、AFB2、AFB1标准曲线,所得线性回归方程如表1所示。由表1可知黄曲霉毒素在2~20μg/L和0.6~6μg/L的浓度范围内线性良好。
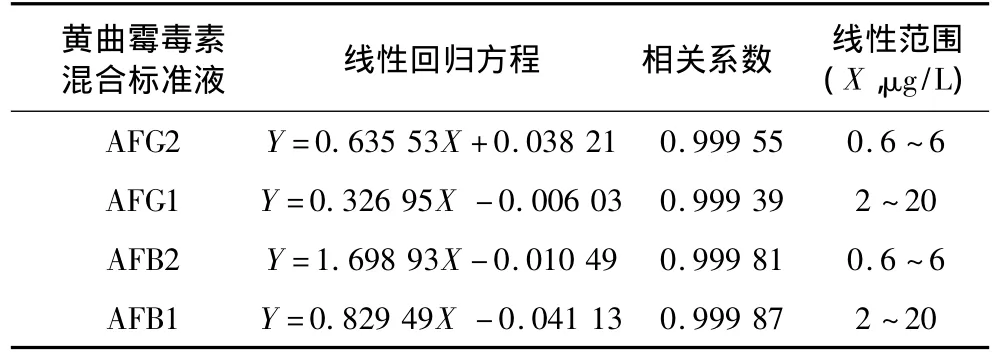
表1 黄曲霉毒素混合标准溶液的线性回归方程
2.4 黄曲霉菌株产毒量测定
在本试验条件下,黄曲霉毒素混标出峰顺序为AFG2、AFG1、AFB2、AFB1,黄曲霉毒素各组分均可有效分离,各黄曲霉菌株产生黄曲霉毒素液相色谱图见图4。
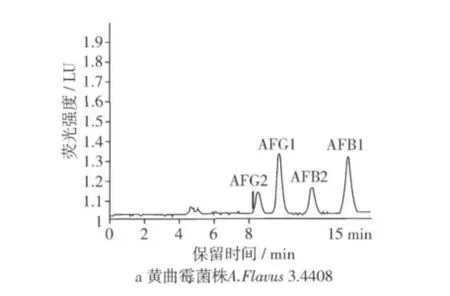
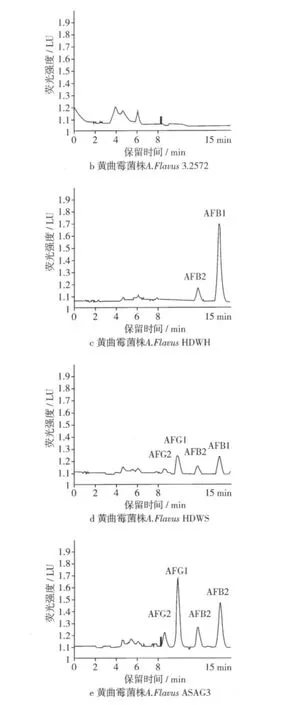
图4 黄曲霉菌各菌株液相测定色谱图
从图4中可以看出,黄曲霉毒素各组分均可有效分离,4种毒素在15 min内出峰。在检测过程中黄曲霉标准菌株3.4408的毒素提取液由于产毒量太大做了500倍稀释,其他菌株提取液均做50倍稀释。本试验中黄曲霉标准菌株A.Flavus3.4408和筛选的黄曲霉菌A.Flavus ASAG3和A.Flavus HDWS都有AFG2、AFG1、AFB2、AFB1检出,黄 曲 霉 菌A.Flavus HDWH检出只产AFB2、AFB1,而A.Flavus 3.2572没有黄曲霉毒素检出。通过HPLC检测结果,计算黄曲霉菌株产毒情况如表2。
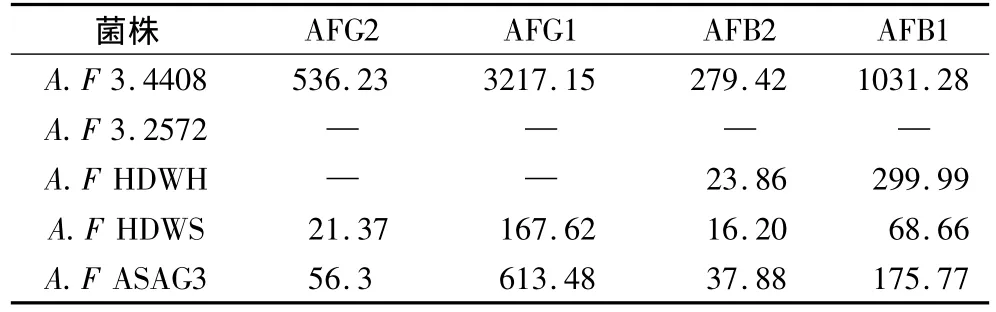
表2 黄曲霉菌株产生黄曲霉毒素含量/μg/kg
黄曲霉菌株在每克大豆培养基上产生黄曲霉毒素的含量差异很大,由表2可知,黄曲霉标准菌A.Flavus3.4408产毒量最高AFG2为536.23μg/kg、AFG1为3 217.5μg/kg、AFB2为279.42μg/kg、AFB1为1 031.28μg/kg,平均达到每千克培养基产毒量能达到毫克以上;分离得到的黄曲霉菌株A.Flavus ASAG3产生黄曲霉毒素AFG2为56.3μg/kg、AFG1为613.48μg/kg、AFB2为37.88μg/kg、AFB1为175.77μg/kg;黄曲霉菌株A.Flavus HDWS产生黄曲霉毒素含量较低AFG2为21.37μg/kg、AFG1为167.62μg/kg、AFB2为16.2μg/kg、AFB1为68.66 μg/kg;而黄曲霉菌菌株A.Flavus3.2572则没有黄曲霉毒素产生。
3 讨论与结论
研究对发霉粮食中分离得到的三株菌株和中国微生物菌种保藏中心购买得到的两株黄曲霉菌(3.4408、3.2572)通过形态学鉴定,初步确定分离菌株为黄曲霉菌。由于PCR技术具有灵敏、特异、快速等特点,本研究采用PCR技术对分离菌株做进一步鉴定。aflR基因在黄曲霉毒素产生过程中具有十分重要的作用,aflR基因的转录中断可能抑制其他黄曲霉毒素合成相关基因的表达[9]。本试验所用引物与Somashekar等[13]相同,通过设计特异性引物PCR扩增检测,发现所分离菌株和标准菌株中均含有黄曲霉毒素产生关键基因aflR。将测序结果在Gene Bank中进行Blast比对分析表明:试验分离菌株和菌株与FN3981 57.1黄曲霉ITEM 8094和AY510455.1黄曲霉菌株AF36的aflR基因相似度达到99%以上,通过形态学和分子生物学鉴定最终确定所分离菌株为黄曲霉菌株。
HPLC检测不同黄曲霉菌株的产生黄曲霉毒素毒能力差异时,由于在线光化学衍生装置不需要在流动相中加任何试剂,待测样品在流经光化学衍生器中被紫外灯管照射的网状通路时,解决了AFB1和AFG1在检测中荧光强度较低的问题,AFB1和AFG1的荧光强度被大大提高,所以本实验HPLC检测采用柱后衍生光化学衍生器。
本研究下一步将继续探索影响黄曲霉菌株产生黄曲霉毒素的原因和机理。寻求快速鉴别曲霉菌株是否产毒的方法,为粮油食品中潜在产生黄曲霉毒素的菌株鉴别和食品发酵工业菌株的选育和安全应用提供实用快速的鉴别技术。
[1]Eaton D L,Gallagher E P.Mechanisms of Alfatoxin carchinogenesie[J].Annu Rev Pharmacol Toxicol,1994,34:135-172
[2]Chang P K,Yu J,Bhantagar D,et al.The Carboxy -Terminal Portion of the Aflatoxin Pathway Regulatory Protein AFLR of Aspergillus parasiticus Activates GAL1::lacZ Gene Expression in Saccharomyces cerevisiae[J].Applied and Eevironmental Microbiology,1999,65(6):2508-2512
[3]Abbas H K,Weaver MA,Zablotowicz RM,et al.Relationships between aflatoxin production and sclerotia formation among isolates of Aspergillus section Flavi from the Mississippi Delta[J].European Journalof Plant Patholilogy,2005,112:283 -287
[4]Bhatnagar D,Ehrlich K C,Cleveland TE,et al.Molecular genetic analysis and regulation of aflatoxin biosynthesis[J].Appl Microbiol Biotechonl,2003,61:83-93
[5]Yu J,Chang P K,Bhatnagar D,et al.Genes encoding cytochrome P450 and monooxygenase enzymes define one end of the aflatoxin pathway gene cluster in Aspergillus parasiticus[J].Appl Microbiol Biotechnol,2000,53(5):583-590
[6]Keller NP,Hohn TM.Metabolic pathway gene clusters in filamentous fungi[J].Fungal Genetics and Biology,1997,21:17-29
[7]Georgianna D R,Payne G A.Genetic regulation of aflatoxin biosynthesis:From gene to genome[J].Fungal Genetics and Biology,2009,46:113-115
[8]Ehrlich K C,Montalbano BG,Bhatnagar D,et al.Alteration of different domains in AflR affects aflatoxin pathway metabolism in Aspergillus parasiticus transformants[J].Fungal Genetics and Biology,1998,23:279-287
[9]Cary J W,Ehrlich K C,Wright M,et al.Generation of aflR disruption mutants of Aspergillus parasiticus[J].Appl Microbiol Biotechnol,2000,53:680-684
[10]Ehrlich K C,Montalbano B G,Cotty P.J.Sequence comparison of aflR from different Aspergillus spe cies provides evidence for variability in regulation of aflatoxin production[J].Fungal Genetics and Biology,2003,38:63-74
[11]Yu J,Chang P K,Cleveland D B E.Cloning and functional expression of an esterase gene in Aspergillus Parasiticus[J].Mycopathologia,2002,156:227-234
[12]张春艳,周孝治,陈菊芳,等.光化学衍生-高效液相色谱法测定黄曲霉毒素含量[J].湖南农业大学学报:自然科学版,2011,36(5):570-571
[13]Somashekar D,Rati E R,Chandrashekar A.PCR-restriction fragment length analysis of aflR gene for differentiation and detection of Aspergillus flavus and Aspergillus parasiticus inmaize[J].International Journal of Food Microbiology,2004,93(1):101-107
[14]Brackett R E.Strategies for dealing with aflatoxins in peanuts[M].Yam T C,Tan C.Trends in Food Product Development.Singapore:Singapore Institute of Food Science and Technology,1989:83-91
[15]程树峰,唐芳,伍松陵.碘柱前衍生-高效液相色谱法快速测定粮食中黄曲霉毒素[J].粮油食品科技,2008,16(6):40-55
[16]高秀芬,计融,李燕俊,等.高效液相色谱法测定玉米中的黄曲霉毒素[J].中国食品卫生杂志,2007,19(2):105-108.
Isolation and Identification of Aspergillus Flavus Strains and Analysis of Toxin-Producing Ability
Yang Shengrui1,2Qu Lingbo1Sun Changpo2Shen Han2Shen Jin3Wu Songling2
(College of Bioengineering,Henan University of Technology1,Zhengzhou 450001)
(Academy of State Administration of Grain2,Beijing 100037)
(Institute of Agricultural By - p roducts Processing,Chinese Academy of Agricultural Engineering3,Beijing 100026)
Several Aspergillus flavus strains were isolated from moldy grain,then were identified by spore morphological and Molecular Biological Identification.The toxin-producing ability of strains were detected and analyzed by HPLC after fermentation.The results showed that experimental isolated strain were Aspergillus flavus and contains toxigenic key gene of afl;the toxin-producing ability was very different between these Aspergillus flavus strains.Aspergillus flavus 3.4408 produce the hightest aflatoxin while Aspergillus flavus HDWS only produces a little.Even more,Aspergillus flavus 3.2572 could not produce aflatoxin under the same condition;Among aflatoxin-producing strains,some of the strains produce aflatoxin AFB1,AFB2,AFG1,AFG2,Aspergillus flavus HDWH only produces aflatoxin AFB1,AFB2.
Aspergillus flavus,aflatoxin,aflR gene,HPLC
Q93-31
A
1003-0174(2012)06-0110-06
时间:2012-04-27 08:44
网络出版地址:http://www.cnki.net/kcms/detail/11.2864.TS.20120427.0844.001.html
国家科技支撑计划(2009BADA0B05),公益性行业(农业)科研专项(201003077)
2011-12-26
杨生瑞,男,1987年出生,硕士,微生物学
伍松陵,女,1967年出生,副研究员,生化工程
