骨髓间充质干细胞性状稳定性与生物安全性研究
2012-11-22河北省秦皇岛市第一医院神经外科二病区秦皇岛066000
河北省秦皇岛市第一医院神经外科二病区 (秦皇岛066000)
吴 磊 赵建华 冯 继
骨髓间充质干细胞(Bone marrow-derived mesenchymal stem cells,BMSCs)具有向神经细胞、肌细胞、骨和软骨细胞等多种组织分化的潜能[1],被多个学科争先进行研究,但到目前为止,仍有很多领域存在尚未解决的问题,严重限制了其广泛的临床应用。作为干细胞,其自我更新和不断增殖潜能使其有可能存在类似于肿瘤细胞的增殖特征,特别是长期体外培养的干细胞可能发生异质性问题,这一问题已被少数研究机构报道[2,3],但结论不一而足。本研究以此为着眼点予以研究。
材料和方法
1 材 料 实验使用的DMEM培养基和胰蛋白酶均由美国Gibco公司生产,而胎牛血清为中科院血研所生产,FITC标记CD29、CD34抗体购自英国Serotec公司,CD31、CD45、CD71、CD90抗体购自美国Santa Cr uz公司,低熔点琼脂糖、台盼兰购自北京鼎国公司;鼠源性C6恶性胶质瘤细胞系由天津市神经病学研究所神经肿瘤实验室提供;清洁级Sprague-Dawley大鼠购自中国军事医学科学院动物中心。
2 大鼠源性BMSCs的分离及常规培养 用贴壁培养法分离BMSCs.即将Sprague-Dawley大鼠通过拉颈手法将其处死,然后使用75%酒精浸泡充分消毒;将Sprague-Dawley大鼠的双侧股骨和胫骨仔细分离,并剪开其长骨两端的骨皮质,将含10%FBS的DMEM培养基抽取到注射器中,通过注射器将培养基反复冲洗该鼠的骨髓腔,收取实验所需的细胞悬液,将其接种到塑料培养皿或者培养瓶中,在37℃、5%CO2饱和湿度条件下使用细胞培养箱对其进行培养。等到部分细胞贴壁后对其进行半量换液,第3d实行全量换液,第2代起每3~5d胰酶消化传代,获取长期传代培养细胞。
3 流式细胞仪检测不同传代次数BMSCs表面标志蛋白表达 取第4、20和40代BMSCs单细胞悬液,通过FITC标记的CD29、CD31、CD34、CD45、CD71、CD90抗体在室温下避光染色30 min,使用FACSCalibur流式细胞仪和CELLQuest软件(Bect on Dickinson,USA)进行采样分析。
4 流式细胞仪检测长期体外培养BMSCs细胞周期及DNA倍性变化 取第4、20和40代BMSCs,使用PBS进行离心漂洗,共进行3次,然后使用无水乙醇进行固定,RNase A消化和PI染色30 min,最好上流式细胞仪进行分析检测。
5 血清依赖实验 取生长状态良好的第4、20、40代BMSCs和C6胶质瘤细胞分别接种于96孔板,24h后将条件培养液换为含0.1%FBS的DMEM条件培养液继续培养;每日取96孔板培养皿中的8个孔细胞进行苔盼兰染色,使用显微镜对活细胞进行计数取平均值,计算活细胞占所有细胞的百分率;用C6胶质瘤的细胞作为阳性对照研究。
6 细胞克隆形成能力比较 在培养皿孔底预铺置0.7%琼脂,在常规培养箱中过夜凝固;用终浓度为0.35%低熔点琼脂糖工作液与第40代BMSCs和C6胶质瘤细胞悬液混匀,加入培养皿孔板中,置于细胞培养箱;第二日向每孔中各加入200μL的全培养基,等培养3个星期后,在倒置显微镜下随机抽取培养基的10个视野进行计数,计数细胞数大于40的克隆团数需要计算平均值。
7 大鼠颅内致瘤试验 取第40代BMSCs进行胰酶消化,调节细胞终浓度为1×106个细胞/25μl备用;大鼠颅内立体定向注射BMSCs:在对大鼠腹腔进行麻醉注射时,需要根据其体重采取有针对性的用量,按3.5 ml/kg的标准使用10%水和氯醛注射;待对大鼠头部皮毛进行常规消毒后,使用手术刀切开其头皮,使其颅骨充分暴露出来,通过立体定向注射仪对其进行准确定位,定位点控制在其前囟右旁开3.5 mm,同时向前1 mm,使用牙科钻对其进行钻孔后缓慢进针,将进入深度控制为5 mm,注射持续时间为5~10 min,最后停针3 min后缓慢退针。MRI监测颅内成瘤情况,仔细观察该老鼠的生存状态,等到大鼠存活到第28d将其处死,然后取下其脑切片进行HE染色。本实验以鼠源性C6胶质瘤细胞系为阳性对照。
8 统计学方法 选用方差分析、χ2检验。
结 果
1 大鼠BMSCs传代培养特征 原代贴壁细胞成分复杂,随着传代次数增加,异种细胞逐渐被淘汰,于第4、5代可获得形态均一、增长旺盛的纯化BMSCs;这些BMSCs可稳定培养至20代左右,以后逐渐表现出传代间隔缩短,细胞增殖速度增快现象,形态学观察细胞排列稍有紊乱,折光性有所增强(图1)。

图1 第4、20及40代BMSCs形态学观察,可见第40代细胞排列稍有紊乱,折光性有所增强(×200)
2 不同传代次数BMSCs表面标志蛋白表达 流式细胞仪检测结果显示第4、20和40代BMSCs的多个表面标志蛋白(阳性标志蛋白:CD29、CD71、CD90,阴性标志蛋白:CD31、CD34、CD45)的表达不随传代次数增加而发生改变,不同传代次数BMSCs的同一检测指标相互比较无统计学差异(P>0.05)(图2)。
3 不同代数的BMSCs细胞周期的改变 见图3。处于合成期(S期)的细胞比例在体外培养时BMSCs会随着传代次数增加而逐渐增加。不同传代次数的BMSCs间DNA倍性无明显改变。较周围脑组织稍有深染。与BMSCs接种动物相比较,C6胶质瘤细胞接种动物经MRI检测在第14d可见接种脑半球巨大肿瘤形成,肿瘤几乎占据整个半球。以上结果显示移植于脑内的BMSCs在体内可存活较长时间,但尚无恶性转化表现(图6)。

图2 第4、20及40代BMSCs表面标志蛋白表达情况比较,可见3个阳性标志蛋白cd29、cd71、cd90表达率均大于98%,而3个阴性标志蛋白cd31、cd34、cd45表达率均小于5%,而不同传代次数BMSCs的同一标志蛋白表达相互间无统计学差异(P>0.05)
讨 论
BMSCs在动物骨髓中广泛存在,是一种具备可以自我更新和多分化潜能的前体细胞,即便在机体组织细胞受到损伤后,其修复过程也可以发挥重要作用[4]。因其在体外容易获得和扩增,相较于胚胎干细胞、脐血干细胞或神经干细胞,伦理学限制较少,易于实验室工作的大范围展开。近年来围绕BMSCs的组织损伤反应性及其多胚层分化潜能,多学科的相关性研究相继展开,

图3 第4、20及40代BMSCs细胞周期变化,可见体外培养BMSCs处于S期的细胞比例随着传代次数增加而增加(P<0.05),而G2/G0+G1值比较无统计学差异(P>0.05),提示不同传代次数的BMSCs间尚无明显倍体改变
4 低营养条件下细胞生长情况比较 图4显示为在低血清培养条件下所有代次的BMSCs均在4d内死亡,表明BMSCs的生长对血清有高度依赖性;但在同样低血清培养条件下,C6胶质瘤细胞一直存活到第11d,表现出更强的低营养耐受能力。
5 细胞克隆形成能力比较结果 该实验结果显示,接种的C6胶质瘤细胞系在第21d时出现了大量的克隆,二者相比较可以看出,所有BMSCs实验组几乎均未形成克隆(图5)。

图4 通过血清依赖实验可以看出,在低血清的培养条件下,所有传代次数的BMSCs在4d内全部死亡,但是C6胶质瘤细胞却不同,在同样条件下,该细胞可以一直存活11d,体现出了更强的生长活性,具有更好的低营养抵抗能力
6 体内致瘤性的结果比较 BMSCs接种的大鼠生存状况均非常良好,MRI及脑组织标本中未见肿瘤形成。图6 A显示为BMSCs移植部位脑组织结构HE染色,6B为非BMSCs移植区域脑组织HE染色,在鼠脑切片的BMSCs移植层面可见较多BMSCs不均一地分散于正常脑组织结构中,细胞排列无序,胞浆如心肌梗死组织的替代、骨或肌腱组织的再生、神经退行性疾病的功能恢复等[5]。由于这些领域几乎均需要体外扩增出足够的细胞数量以用于BMSCs移植或基因修饰,因此一个不可回避的问题是这些长期体外扩增培养的BMSCs的性状稳定性与应用安全性问题。
目前已有研究报道,BMSCs经过长期体外的扩增培养后,可以失去其原始的生物学特征,如特异表面标志蛋白的改变,诱导迁移相关蛋白的表达下降或丢失等,这些蛋白表达的改变将影响其特有的损伤反应性和定向迁移能力,进而影响组织再生和修复效率。Abdallah等用端粒酶逆转录酶(h TERT)转染BMSCs,经过3年体外培养,观察到所有体外培养细胞株不仅都具有良好的自我复制,还具有多胚层分化潜能。Burns等研究表明,BMSCs经过继续的体外培养后可以发生明显的基因改变且是自发的,还可以引起其免疫缺陷肿瘤的形成。在110个BMSCs单细胞克隆中,仅有6株出现了INK4a/ARF基因位点的缺失和DBCCR1抑癌基因启动子的高甲基化,使得其基因表现沉默,只会出现在人类肿瘤和骨肉瘤源性细胞株中。
研究还发现,实验对长期体外培养的大鼠源性BMSCs性状稳定性与应用安全性予以研究。首先虽然在细胞形态上BMSCs经长期培养后出现了不同程度的排列紊乱,折光性明显增强,生长周期明显缩短,但DNA倍性并未出现明显改变,所检测的6个表面标志蛋白表达也没有明显差别,提示体外传代培养40代的BMSCs尚具备良好的生物学性状稳定性。血清依赖实验主要在于恶性程度较高的细胞系,它不仅可以分泌生长因子,在低营养条件下具有比较低恶度的细胞系或正常细胞系更强的耐受能力,体现出来了更强的增殖活性,还可以作为评价细胞系恶性程度的重要指标。本次研究选用的恶性程度较高的C6胶质瘤细胞系作为了对照,C6胶质瘤细胞系表现出了更强的低营养耐受能力,在低营养条件下,BMSCs无论是早期还是长期培养都较早地出现了生长停滞现象,直到细胞死亡。软琼脂细胞克隆形成实验是一种常用实验方法,在模拟活体内,细胞外基质的半固体生长环境下,进行体外检测评估,分析细胞纯系化集落生长潜力。集落主要指在体外培养基中从一个细胞逐渐增殖而形成的细胞团。肿瘤细胞和类肿瘤细胞的无限繁殖,使得成熟分化细胞不能及时形成集落。本次实验表明BMSCs在长期体外培养下阻力介质中仍然不具备形成克隆的能力,存在极低的恶性度和致瘤潜能。而本实验体内研究结果也表明长期体外培养(至少40代)的BMSCs体内移植后尚不存在致瘤性,具备良好的应用安全性。总之,长期体外培养的BMSCs具有相对稳定的生物学性状和应用安全性,适宜于大数量BMSCs移植或体外基因修饰为基础的研究展开。
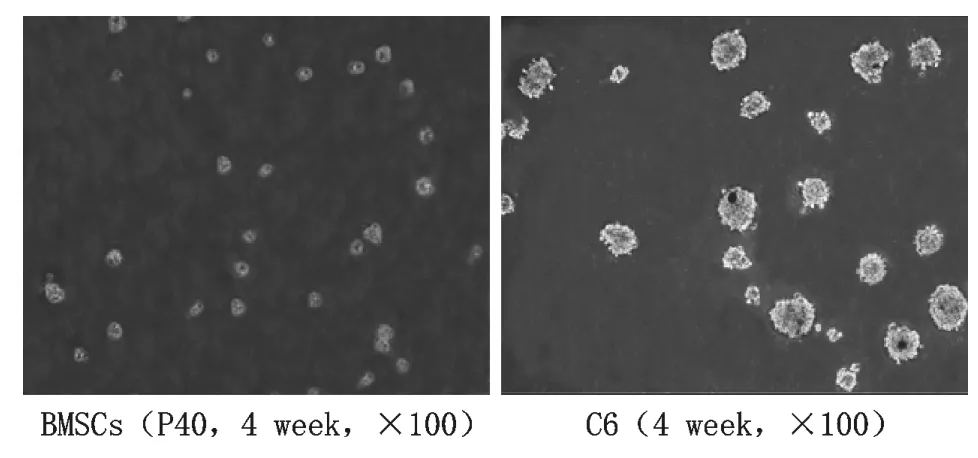
图5 长期体外培养的第40代BMSCs和C6胶质瘤细胞在软琼脂中克隆形成能力比较

图6 A为BMSCs移植部位脑组织结构HE染色,B为非BMSCs移植区域脑组织HE染色,在A可见较多BMSCs不均一地分散于正常脑组织结构中,细胞排列无序,胞浆较周围脑组织稍有深染(A、B,×200)
[1]Baksh D,Song L,Tuan RS.Adult mesenchy mal stem cells:characterization,differentiation,and application in cell and gene therapy.J Cell Mol Med,2004,8(3):301-316.
[2]Tuan RS,Boland G,Tuli R,etal.Adult mesenchy mal ste m cells and cell-based tissue engineering.Arthritis Res Ther,2003,28(5):32-45.
[3]Colter DC,Class R,Di-Girola mo CM,etal.Rapid expansion of recycling ste m cells in cultures of plastic-adherent cells fro m hu man bone marrow.Proc Natl Acad Sci USA,2000,97(7):3213-3218.
[4]赖平平,韩春茂,岑航辉,等.骨髓间充质干细胞的分离培养和生物学性状[J].浙江医学,2004,26(5),328-329.
[5]杜振宗,任 华,张超纪.成人骨髓间充质干细胞的分离、鉴定和生物学特性[J].中国组织工程研究与临床康复,2008,38(43):8495-8499.
