竹叶青蛇毒L-氨基酸氧化酶的表达载体的构建及重组蛋白抗肿瘤的研究
2012-11-22何光志
何光志
(贵阳中医学院,中国 贵阳 550002)
长期以来,肿瘤一直是医药界最大的研究课题之一.蛇毒L-氨基酸氧化酶(LAAO)是一种有潜力的抗肿瘤制剂,具有广阔的临床应用前景.但目前提取竹叶青蛇毒L-氨基酸氧化酶的工业化生产还不现实.与此相比,基因工程技术的发展使得大规模制备竹叶青蛇毒L-氨基酸氧化酶成为可能.
本研究通过构建竹叶青蛇毒L-氨基酸氧化酶Pet28a(+)-LAAO表达载体转化表达菌株BL21(DE3),进行诱导表达,纯化蛋白接种荷瘤小鼠,计算重组蛋白的抑瘤率和延长载瘤小鼠的存活时间,拟在为开发利用竹叶青蛇毒提供依据,为进一步研制新型的抗肿瘤药物打基础.
1 试剂与材料
1.1 试剂
IPTG,Sigma公司产品;裂解液,去污剂(Triton X-100),尿素和Taq酶,捷瑞生物公司产品;BamHⅠ和HindⅢ,MBI公司产品;SDS, TaKaRa公司产品;DNA Marker DL2000, TaqPCR MasterMix, BL21(DE3),大连宝生物公司产品;DNA回收试剂盒,QIAGEN公司产品产品; PCR引物, 由上海生工合成; pMD18-T-ALAg,由本实验室制备保持;Pet28a(+),Invitrogen产品,其他试剂均为分析纯.
1.2 材料
竹叶青蛇毒,采自贵州省思南县;健康小鼠(4~6周龄、体重18~20 g的雄性清洁级昆系小白鼠)和健康白兔(体重1 500~2 000 g),购自贵阳医学院实验动物中心;鼻咽癌CNE-2Z、人宫颈癌LYA01021和卵巢癌A2780 MSC株,购于中科院细胞所.
2 方法
2.1 兔抗竹叶青蛇毒LAAO阳性血清的制备
按张明芳等人方法[1]进行纯化竹叶青蛇毒LAAO, 保存备用;取一部分竹叶青蛇毒用甲醛脱毒后,加油佐剂(质量浓度为0.2 g/L),免疫分为基础免疫和超免疫,在兔子的背部两侧肌肉注射(0.1 μg)进行基础免疫,每次间隔3周,在皮下和肌肉、穴位交替进行加强免疫,每只兔子1 mg,每次免疫间隔2周.免疫后采用琼脂扩散试验测免疫血清效价,达到28时进行采血分离血清.
2.2 质粒DNA的小量提取
从冰箱取出含pMD18-T-LAAO的DH5α的EP管于冰浴溶解,1 000 r/min离心5 min,加入10 μL 的LB液体培养基,37 ℃200 r/min振荡培养1 h,涂布于含有氨苄青霉素(Amp,100 mg/L)的LB琼脂平板上,37 ℃培养12~16 h,挑取菌落加入100 μL 的LB液体培养基培养,离心取沉淀进行质粒DNA提取.
2.3 Pet28a(+)-LAAO构建和酶切鉴定
pMD18-T-LAAO和Pet28a(+)质粒经BamHⅠ和HindⅢ分别进行双酶切,回收目的片段进行连接并转化DH5α,并将其铺于含有Amp的LB培养基平板中,挑取单个菌落加入LB液体培养基中在37℃培养过夜,PCR检测为阳性菌落,进行抽提质粒DNA.采用BamHⅠ和HindⅢ进行双酶切鉴定,将双酶切鉴定正确的菌株送往大连宝生物公司测序.
2.4 重组蛋白诱导表达及SDS-PAGE
将测序正确的菌株抽提Pet28a(+)-LAAO质粒转化BL21(DE3),加入100 μL 的LB液体培养基,37 ℃200 r/min培养1 h,涂布于含有Amp的LB琼脂平板上37 ℃培养12~16 h,挑取单个菌落进行PCR,PCR阳性菌株加入5 mL培养物经IPTG诱导表达3 h,同时设未经IPTG诱导表达的菌株作为对照.取诱导和未诱导的细菌培养物离心后,分别取沉淀和上清液按1∶1的体积比加入2×上样缓冲液煮沸5 min,瞬间离心.在样品孔内分别加入待检样品(10 μL/孔)进行电泳,同时设标准蛋白Marker,采用考马斯亮蓝R-250进行染色.
2.5 重组蛋白的纯化
含有Pet 28a(+)-LAAO的质粒转化BL21(DE3)菌液按体积比1∶100加入LB液体培养基混匀,将混合物的BL21(DE3)接种到新的LB液体培养基中,37 ℃培养至OD550=1.0.IPTG诱导3 h进行大量表达,收集诱导表达菌.纯化重组蛋白参照舒雨雁等方法进行[2].
2.6 Western-blot 分析
将分离的竹叶青蛇毒LAAO和纯化蛋白进行SDS-PAGE,电泳结束后进行转膜和Western-blot分析.用0.01 mol/L PBS洗膜3次,5 min/次(以下同);加入包被液室温孵育2 h;弃包被液,洗膜;加入兔抗竹叶青蛇毒阳性血清(按1∶500的体积比稀释),4 ℃孵育12 h以上;弃一抗,洗膜3次;加入羊抗兔辣根过氧化物酶偶联的二抗(1∶8 000体积比稀释),室温孵育2 h;弃二抗,用 PBS洗膜4次;加入显色液(TMB)避光显色.
2.7 重组蛋白对荷瘤小鼠抑瘤率和生命延长率的影响
2.7.1 建立小鼠鼻咽癌、人宫颈癌和卵巢癌实体瘤模型 分别取出冻存鼻咽癌CNE-2Z、人宫颈癌LYA01021和卵巢癌A2780 MSC细胞株复苏后进行培养.用0.2%台盼蓝染色计数活细胞率.当活细胞率≥95%时,调整细胞数为1×106个/mL,分别于小鼠右腋下注射接种0.2 mL/只,以建立小鼠鼻咽癌、人宫颈癌和卵巢癌实体瘤模型.同时用空白对照组用生理盐水、CTX阳性对照组和竹叶青蛇毒分离LAAO阳性对照组.
2.7.2 重组蛋白对荷瘤小鼠抑瘤率和生命延长率的影响 动物随机分6组,每组20只.其中3个组为鼻咽癌CNE-2Z、人宫颈癌LYA01021和卵巢癌A2780 MSC细胞组,接种癌细胞24 h后,每组又分为重组蛋白高、中、低剂量3个小组(100、50和20 μg/g);另外3个组分别为PBS阴性、蛇毒中分离LAAO和CTX阳性对照组腹腔注射(0.01 mL/g体重).所有动物每天给药1次,连续10 d;停药第2天每组取10只小鼠脱颈处死,剖取瘤块进行称重,采用肿瘤抑制率(%)=(对照组平均瘤重-给药组平均瘤重)/对照组平均瘤重×100公式计算抑瘤率.每组余下的未处死10只小鼠停药后观察小鼠存活天数,计算小鼠生命延长率.生命延长率(%)=(给药组平均存活天数-对照组平均存活天数)/对照组平均存活天数×100.

M: 2 000 bp Marker; 1: Pet28a(+)-LAAO双酶切产物.图1 重组Pet28a(+)-LAAO质粒酶切鉴定
2.8 数据统计
用SPSS软件进行分析,统计结果用“x±s”来表示.
3 结果
3.1 Pet28a(+)ALAg质粒的酶切鉴定
将Pet28a(+)-LAAO质粒转化大肠杆菌DH5α,挑取单个菌落提取质粒,用BamHⅠ和HindⅢ进行双酶切鉴定,可得到大于2 000 bp的pET32a(+)载体骨架片段和1 700 bp左右的目的基因片段,目的基因片段与预期1 707 bp大小相符(图1),表明目的基因片段已连接到Pet28a(+)载体中.
3.2 SDS-PAGE和Western-blot分析
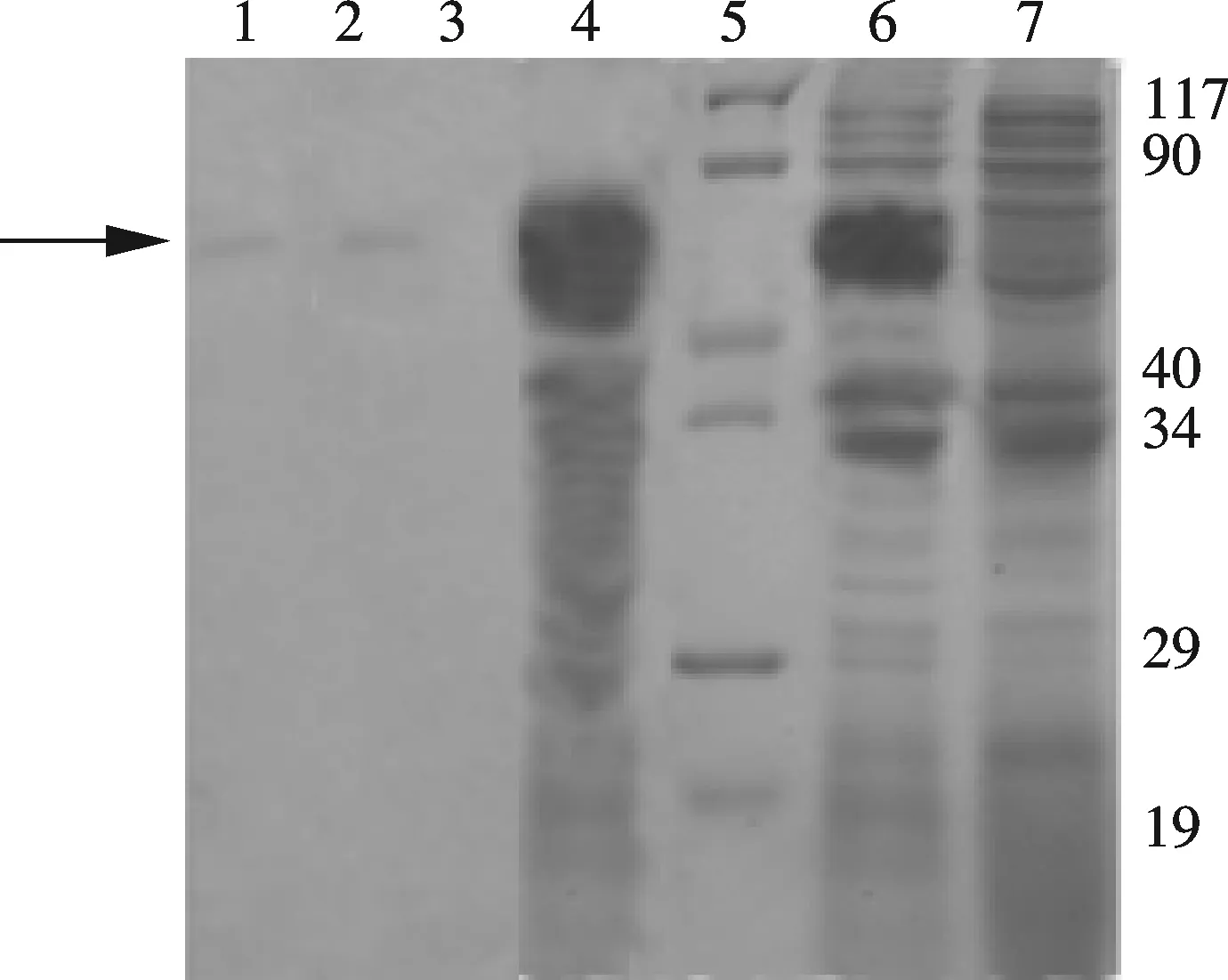
1: 分离竹叶青蛇毒LAAO与兔抗竹叶青蛇毒LAAO阳性血清反应; 2:含 Pet28a(+)-LAAO菌落诱导表达产物与兔抗竹叶青蛇毒LAAO阳性血清反应;3: 含空载体菌株进行诱导表达产物与兔抗竹叶青蛇毒LAAO阳性血清没有发生反应;4: 人工分离竹叶青蛇毒LAAO经 SDS-PAGE;5: 蛋白质 marker;6: 含 Pet28a(+)-LAAO菌落进行诱导表达;7: 含空载体菌株进行诱导表达.图2 SDS-PAGE和Western-blotting
将构建的Pet28a(+)-LAAO转化E.coliDH5α,挑取阳性克隆进行测序,将正确的克隆菌的质粒转化到E.coliBL21中进行诱导表达,取菌液离心取上清,沉淀经超声波破碎后离心,分别经SDS-PAGE分析发现表达蛋白主要以包涵体表达.取诱导表达3 h的菌液进行SDS-PAGE,表达产物相对分子质量约为58 000,而含空载体的细菌经诱导后无58 000条带.将纯化后的蛋白进行Western-blot分析,结果发现含空载体菌表达产物不能和兔抗竹叶青蛇毒LAAO阳性血清发生反应,而含重组载体菌表达产物能与兔抗阳性血清发生反应,结果如图2.
3.3 重组蛋白对荷瘤小鼠生命延长率的影响
重组蛋白低、中、高3个剂量组和CTX阳性对照组均能明显延长瘤小鼠的存活时间.统计分析显示,重组蛋白低、中、高剂量组荷瘤小鼠生命延长率与阴性对照组相比较均表现为差异极显著(P<0.01);相同剂量(20 μg/g体重)的重组蛋白组与蛇毒分离LAAO在抑瘤率没有显著差异外,其余重组蛋白(50、100 μg/g体重)组与人工蛇毒分离LAAO组(20 μg/g体重)均存在显著差异(P<0.01);各重组蛋白组与CTX阳性对照组比较虽然表现为差异极显著(P<0.01),但本研究结果均能揭示重组蛋白可提高荷瘤小鼠生命延长率(表1~3).
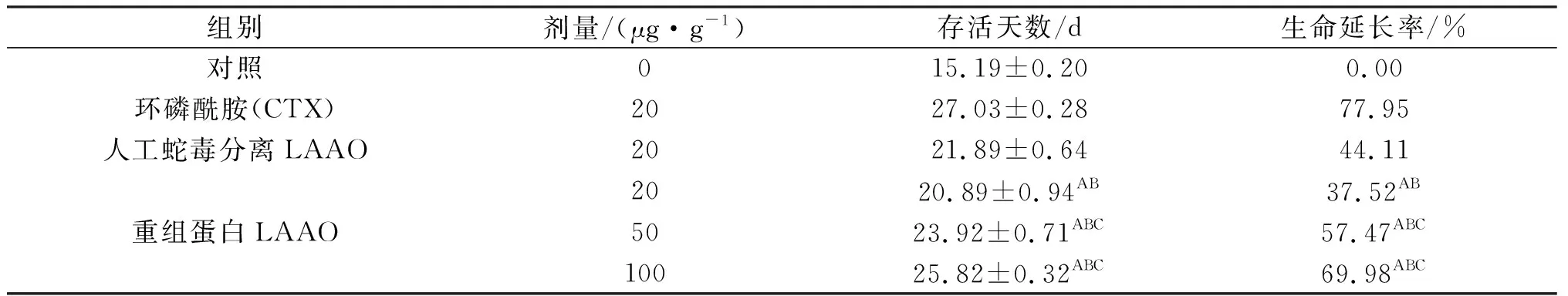
表1 重组蛋白对人鼻咽癌细胞荷瘤小鼠生命延长率的影响(x±s,n=10)
注:与阴性对照组比较,AP<0.001;与CTX阳性对照比较,BP<0.01;与蛇毒分离LAAO比较,CP<0.01.

表2 重组蛋白对人宫颈癌细胞荷瘤小鼠生命延长率的影响(x±s,n=10)
注:与阴性对照组比较,AP<0.001;与CTX阳性对照比较,BP<0.01;与蛇毒分离LAAO比较,CP<0.01.
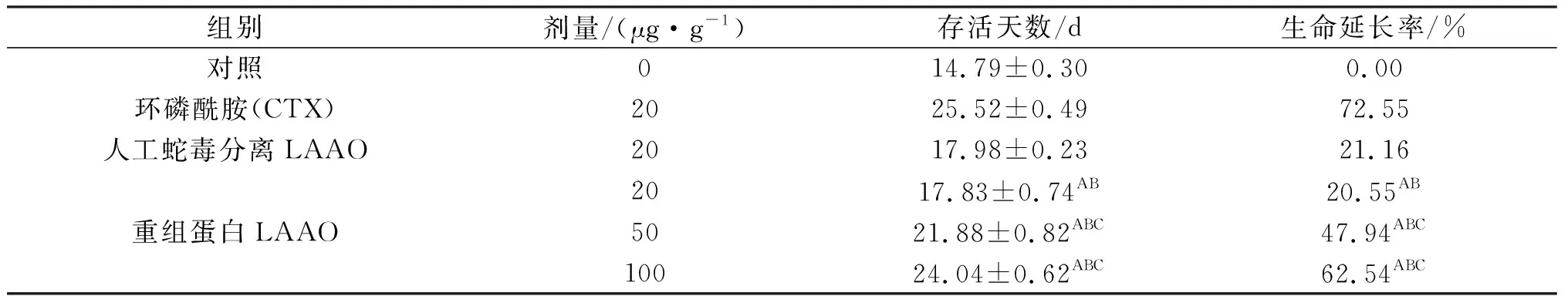
表3 重组蛋白对人卵巢癌细胞荷瘤小鼠生命延长率的影响(x±s,n=10)
注:与阴性对照组比较,AP<0.001, 与CTX阳性对照比较,BP<0.01; 与蛇毒分离LAAO比较,CP<0.01.
3.4 重组蛋白对荷瘤小鼠抑瘤率的影响
纯化蛋白对荷瘤小鼠抑瘤率实验结果表明,小鼠灌服重组蛋白后,低、中、高3个剂量组(20、50、100 μg/g体重,此剂量换算成药物剂量)对小鼠实体瘤均有明显的抑制作用.结果分析显示:低、中、高剂量组与阴性对照组比较,差异均极显著(P<0.01);相同剂量的重组蛋白组与人工蛇毒分离LAAO(20 μg/g体重)在抑瘤率没有显著差异外,其余重组蛋白(50 、100 μg/g体重)组与人工蛇毒分离LAAO组(20 μg/g体重)均存在显著差异;各重组蛋白组与CTX对照组相比较虽然表现为差异极显著(P<0.01),但本研究结果均能揭示重组蛋白可显著地抑制小鼠实体瘤的生长(表4~6).
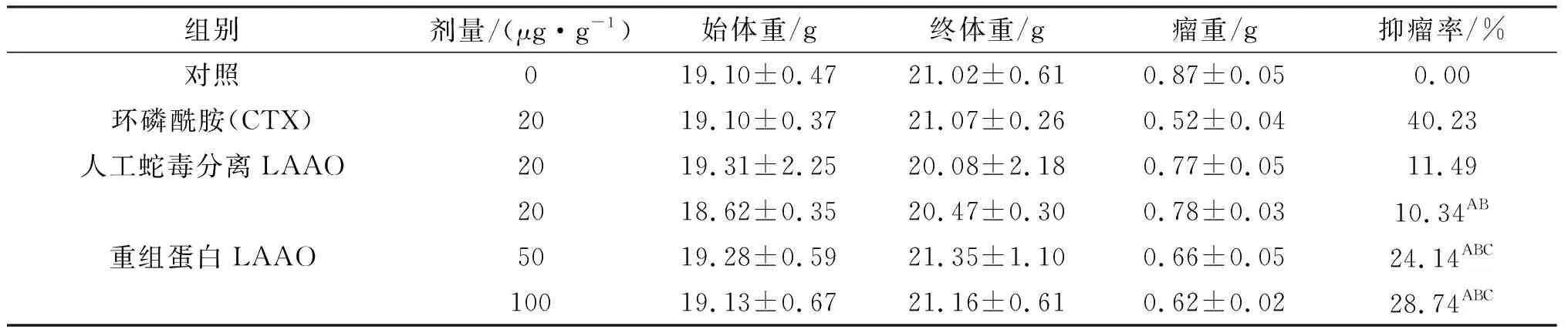
表4 重组蛋白对人鼻咽癌细胞荷瘤小鼠抑瘤率的影响(x±s,n=10)
注:与阴性对照组比较,AP<0.01;与CTX阳性对照比较,BP<0.01;与蛇毒分离LAAO比较,CP<0.01.
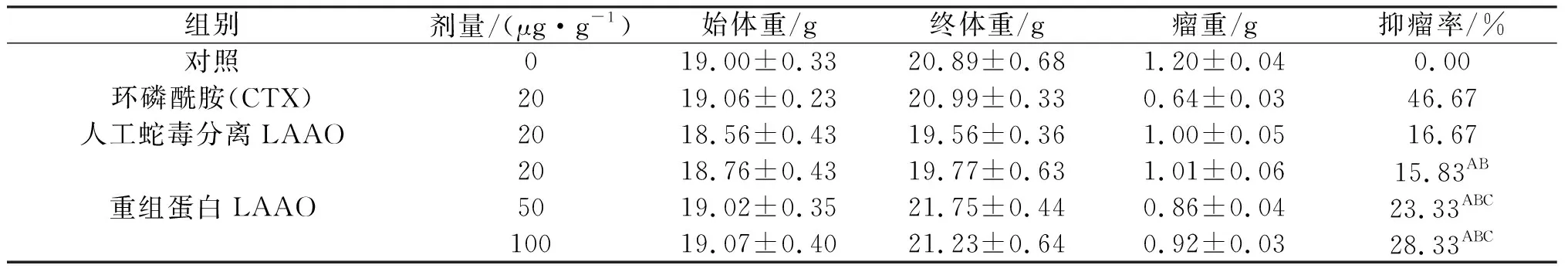
表5 重组蛋白对人宫颈癌细胞荷瘤小鼠抑瘤率的影响(x±s,n=10)
注:与阴性对照组比较,AP<0.01;与CTX阳性对照比较,BP<0.01;与蛇毒分离LAAO比较,CP<0.01.
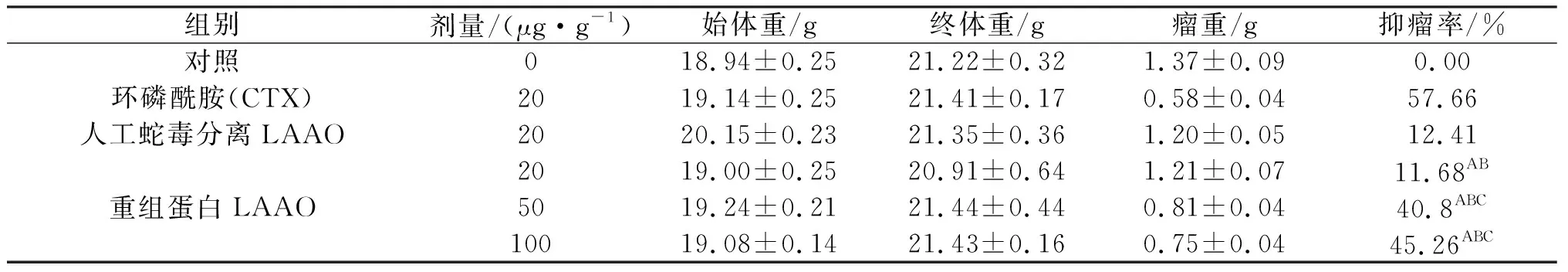
表6 重组蛋白对卵巢癌细胞荷瘤小鼠抑瘤率的影响(x±s,n=10)
注:与阴性对照组比较,AP<0.001;与CTX阳性对照比较,BP<0.01;与蛇毒分离LAAO比较,CP<0.01.
在本次试验中,笔者观察和解剖荷瘤小鼠,并通过肉眼观察重组LAAO组和蛇毒分离LAAO组小鼠,可见小鼠心肌水肿、并有少许的红细胞渗出,肝脏坏死、肺出血、充血,肺泡间隔毛细血管充血、脾脏和肾脏充血坏死等症状.阴性对照组的小鼠心、肝、脾、肺和肾重要脏器并无明显异常.
4 讨论
(1)蛇毒L-氨基酸氧化酶广泛分布于毒蛇的毒液中,其含量高、酶活性强.Suhr等从蛇毒中分离提取出的L-氨基酸氧化酶,能够诱导鼠淋巴性白血病细胞L1210 产生凋亡[3].Torii 等从西部菱背响尾蛇蛇毒中提取出具有LAAO 活性的Apoxin I 蛋白可诱导人早幼粒细胞白血病细胞HL260、人脐静脉内皮细胞和人卵巢癌细胞A2780 及鼠内皮细胞KN23发生凋亡[4].Dulce等从蝮蛇蛇毒中提取的LAAO具有诱导HL260 细胞凋亡的活性[5].Liu等从江浙蝮蛇蛇毒中分离得到的LAAO,能够诱导人肺癌上皮细胞A549 细胞DNA 发生片段化[6].Abe和Ahn等人报道了蛇毒可以诱导细胞凋亡或坏死[7-8].黄红坤等从眼镜王蛇蛇毒中分离的LAAO能够诱导人腭部小涎腺腺样囊性癌细胞系NACC 细胞凋亡[9].
(2)长期以来,肿瘤一直是医药界最大的研究课题之一.蛇毒L-氨基酸氧化酶(LAAO)是一种有潜力的抗肿瘤制剂,具有广阔的临床应用前景.但目前提取竹叶青蛇毒L-氨基酸氧化酶的工业化生产还不现实.与此相比,基因工程技术的快速发展使得大规模制备竹叶青毒L-氨基酸氧化酶成为可能.黄金路等报道LAAO的细菌异源表达系统[10].Zha等将海兔子来源的LAAO在大肠杆菌中进行了第一次异源表达,且表达量较低[11].这些不太成功的LAAO异源表达,可能原因有LAAO消耗表达体系内的L-氨基酸而产生的氨和 H2O2对细胞有毒性;LAAO存在两种形式, 一种有活性,另一种无活性,这取决于温度、底物的存在和pH等;蛋白质表达时缺少一些修饰,这可能导致产生不溶性的蛋白质.本研究通过构建竹叶青蛇毒L-氨基酸氧化酶Pet28a(+)-LAAO表达载体,转化表达菌株BL21(DE3)进行诱导表达,经SDS-PAGE分析发现表达蛋白主要以包涵体表达,提示在大肠杆菌中表达多为无活性的包涵体形式,须经洗涤、溶解、复性处理后才能得到具有生物活性的重组蛋白[12].
(3)本次实验建立鼻咽癌、人宫颈癌和卵巢癌荷瘤模型,纯化重组蛋白腹腔注射荷瘤小鼠进行治疗,计算重组蛋白的抑瘤率和延长载瘤小鼠的存活时间,重组蛋白低、中、高剂量组荷瘤小鼠生命延长率与阴性对照组(PBS)相比较均表现为差异极显著(P<0.01),低、中和高剂量组与阴性对照组比较,差异均极显著(P<0.01),研究结果均能揭示重组蛋白可显著抑制小鼠实体瘤的生长和提高荷瘤小鼠生命延长率.但笔者观察重组LAAO组和蛇毒分离LAAO组小鼠,可见小鼠心肌水肿、并有少许的红细胞渗出,肝细胞坏死,肺出血、充血,肺泡间隔毛细血管充血,脾脏和肾脏充血等症状,这说明重组蛋白对小鼠具有一定的毒性,用于临床还需进一步研究.
参考文献:
[1] 张明芳,齐元麟. 眼镜蛇毒L-氨基酸氧化酶的纯化、性质鉴定及细胞毒性测定[J]. 海峡药学, 2009,21(12):217-220.
[2] 舒雨雁,林文珍,庄茂辛,等.广西眼镜王蛇毒酸性磷脂酶A21的表达[J].现代临床医学生物工程学杂志, 2003,9(1):1-5.
[3] SUHR S M, KIM D S. Identification of the snake venom substance that induces apoptosis[J]. Biochem Biophys, Res Commun, 1996,224:134-139.
[4] TORII S, NAITO M, TSURUO T,etal. A novel apopotosis-inducing factor withL-amino acid oxidase activity purified from Western diamondback rattlesnake venom[J]. J Biol Chem, 1997,272:9539-9542.
[5] DULCE H, SOUZA F, EUGENIO L M,etal. Isolation and structural Characterization of a cytotoxicL-amino acid oxidase from Agkistrodon contortrix laticinctus snake venom: preliminary crystallographic data[J]. Arch Biochem Biophys, 1999,368(2):285-290.
[6] LIU J W, CHAI M Q, DU XY,etal. Purification and characterization ofL-amino acid oxidase from Agkistrodon halyspallas venom[J]. Acta Bioch Bioph Sin, 2002,34(3):305-310.
[7] ABE Y, SHIMOYAMA Y, MUNAKATA H,etal. Characterization of an apoptosis-inducing factor in Habu snake venom as a glycyrrhizin(GL)-binding protein potently inhibited by GL in vitro[J]. Biol Pharm Bull, 1998,21:924-927.
[8] AHN M Y, LEE B M, KIM YS. Characterization and cytotoxicity ofL-amino acid oxidase from theking cobra(Ophiophagus hannah)[J]. Int J Biochem Cell Biol, 1997,29:911-919.
[9] 黄红坤,黎肇炎,李佳荃,等. 眼镜王蛇毒L-氨基酸氧化酶诱导NACC 细胞凋亡的研究[J]. 广西医科大学学报, 2006,23(2):22-25.
[10] 黄金路,李招发,戴红梅,等.蛇毒金属蛋白酶Alffimeprase 在大肠杆菌中的表达、纯化及活性检测[J].生物技术通报, 2007,18(3):409-411.
[11] ZHA X D, RED B, LIU J. cDNA cloning and high-level expression of a thrombin-like enzyme from Agkistrodon acutus actus venom[J].Methods Find EXP Clin Pharmacol, 2003,25(4):253-257.
[12] 鲁建鑫,雷孝锋,李 帆,等.果蝇血液标记基因srp原核表达质粒构建及多克隆抗体制备[J].湖南师范大学自然科学学报, 2011,34(4):74-77.
