膜联蛋白A2在糖基化终末产物诱导的内皮细胞骨架重构及迁移中的作用△
2012-11-13董晓光
毕 超 杨 侠 董晓光
糖尿病视网膜病变(diabetic retinopathy,DR)是糖尿病微血管病变在眼底的独特表现,是糖尿病患者低视力和致盲的主要原因[1]。目前研究已证实糖基化终末产物(advanced glycation end-products,AGE)在糖尿病微血管并发症中发挥着重要作用[2-3]。近期研究发现,AGE-牛血清白蛋白(AGE-bovine serum albumin,AGE-BSA)可诱导血管内皮细胞发生间质转型,细胞的迁移活性及成管能力增强[4]。已知新生血管形成早期的关键步骤是内皮细胞的迁移,而细胞迁移的中心环节是细胞骨架的重构[5]。目前未见AGE影响血管内皮细胞迁移过程中骨架重构的相关报道。膜联蛋白A2(annexin A2,ANXA2)作为组织纤溶酶原激活剂(tissue plasminogen activator,tPA)及纤溶酶原的共受体,其促纤溶作用可促进角膜及视网膜新生血管的形成[6-7]。近期研究表明,作为膜-肌动蛋白细胞骨架间的连接,ANXA2可促使小肠上皮细胞骨架重构而发生迁移并涉及细胞的上皮-间质转型及成管活动[8-9]。由此设想,AGE在DR病程进展中通过诱导细胞骨架重构而促进迁移,而ANXA2则在其中发挥着中介作用。为证实上述假设,我们以AGE-BSA培养人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVEC)为模型,检测ANXA2的表达变化,并通过干扰ANXA2的表达观察细胞微丝骨架及迁移能力的变化,探讨ANXA2在DR发病进展中的作用,以期为视网膜新生血管性疾病的治疗寻找有效的作用靶点提供理论依据。
1 材料与方法
1.1 材料 HUVEC来自北卡罗来纳大学Cora-Jean S.Edgell惠赠。糖基化牛血清白蛋白(AGE-BSA)、牛血清白蛋白(BSA:美国Bio Vision公司),人源性膜联蛋白A2阳性干扰RNA、阴性干扰RNA(ANXA2 siRNA、control siRNA:德国 Qiagen公司),LipofectamineTM2000转染试剂(美国Invitrogen公司),兔抗人ANXA2多克隆抗体、Protein A/G琼脂糖珠(美国Santa Cruz公司),酪氨酸磷酸化抗体(美国Cell Signaling公司),FITC-鬼笔环肽(中国联科生物技术有限公司),山羊抗兔、抗小鼠IgG抗体(北京中杉金桥生物技术有限公司),GAPDH抗体(上海康成生物工程有限公司)。
1.2 方法
1.2.1 细胞培养 HUVEC常规高糖型DMEM培养液(葡萄糖浓度为25 mmol·L-1,含体积分数10%FBS、100 ×103U·L-1青霉素,0.1 g·L-1链霉素)于37℃、含体积分数5%CO2培养箱内培养,分组培养前需降低FBS浓度至2%。
1.2.2 免疫沉淀及Western blot检测ANXA2蛋白的表达 将细胞种入6孔板,待细胞生长至80%融合时,随机分为3组:空白对照组、AGE-BSA(0.2 g·L-1)组和 BSA(0.2 g·L-1)组。处理24 h 后,加入裂解液适量,收集细胞,4℃摇床孵育30 min后,4℃ 12 000 r·min-1离心10 min,取上清(另留取样品作免疫印迹对照)。加入10 μL ANXA2一抗,4℃摇床孵育2 h,再加入20 μL Protein A/G琼脂糖珠,4℃摇床孵育过夜后,4℃ 2500 r·min-1离心5 min,弃上清后充分洗涤。加入40 μL 1×电泳上样缓冲液,95℃加热5 min,所得样品可暂于-20℃保存。将细胞种入6孔板,待细胞生长至60%融合时,随机分为3组:空白对照组、control siRNA组及ANXA2 siRNA组。转染24 h后,加入1.5×电泳上样缓冲液,10 min后刮取样品,于-20℃保存,用前需进行超声处理。
样品SDS-PAGE电泳结束后转至PVDF膜,以酪氨酸磷酸化抗体 P-Tyr-100(1∶1000)/兔抗人ANXA2多克隆抗体(1∶500)和山羊抗小鼠(1∶1500)/兔(1∶3000)IgG抗体孵育,免疫反应结束后使用Western blot荧光剂发光、显影。利用Image J软件对显影结果进行分析。
1.2.3 FITC-鬼笔环肽染色观察 ANXA2对 HUVEC骨架重塑的影响 将HUVEC接种入24孔板,转染24 h后,随机分为5组:空白对照组、AGE-BSA(0.2 g·L-1)组、BSA(0.2 g·L-1)组、control siRNA组及ANXA2 siRNA组。分组处理24 h后,PBS洗涤3次,每次5 min。40 g·L-1多聚甲醛室温固定10 min,PBS洗涤3次,每次5 min。50 g·L-1BSA 室温封闭20 min后FITC-鬼笔环肽室温避光染色30 min,PBS洗涤3次,每次5 min。甘油封片后,荧光显微镜下观察并拍照。
1.2.4 划痕法观察ANXA2对HUVEC迁移能力的影响 将HUVEC种入6孔板,转染24 h后,随机分为5 组:空白对照组、AGE-BSA(0.2 g·L-1)组、BSA(0.2 g·L-1)组、control siRNA组及ANXA2 siRNA组。用100 μL微量移液枪头对各组细胞进行十字划痕,PBS冲洗细胞2次后分别加入各组培养液,于37℃、含体积分数5%CO2培养箱内培养。在0 h、24 h时对各组细胞划痕进行拍照,随机选取3个视野计算迁移到划痕内的细胞数。用划痕后24 h细胞长入划痕内修复划痕的速度来衡量细胞的迁移活性。
1.3 统计学方法 采用SPSS 17.0统计学软件进行单因素方差统计分析(LSD法),数据资料来自3次独立重复实验,均以±s表示。P<0.05为差异有统计学意义。
2 结果
2.1 ANXA2 siRNA抑制ANXA2蛋白的表达ANXA2 siRNA和control siRNA与内皮细胞共孵育48 h后,Western Blot检测ANXA2蛋白表达水平的变化见图1,结果显示转染ANXA2 siRNA可显著下调ANXA2的表达,而control siRNA则无此作用(表1)。
2.2 抑制ANXA2的表达对内皮细胞骨架及迁移能力的影响
2.2.1 ANXA2 siRNA 抑制 AGE-BSA 诱导的 F-actin形态的改变 0.2 g·L-1BSA刺激24 h同正常培养的HUVEC相比,细胞微丝骨架未见明显变化,二者均平行排布,可及细胞周边应力纤维较稀疏;0.2 g·L-1AGE-BSA 刺激24 h后,细胞内应力纤维排布杂乱,似向中央聚集,应力纤维亦变密集;预转染control siRNA的内皮细胞,继以0.2 g·L-1AGE-BSA刺激24 h后,微丝骨架同仅接受AGE-BSA刺激的细胞相比未见明显变化;而预转染ANXA2 siRNA的内皮细胞,则可抑制AGE-BSA所诱导的F-actin重构,由此证明ANXA2蛋白参与了AGE所诱导的细胞微丝骨架重构(图2)。
2.2.2 ANXA2 siRNA抑制AGE-BSA诱导的内皮细胞迁移能力的改变 划痕实验检测细胞迁移能力变化的结果显示,0.2 g·L-1AGE-BSA 刺激24 h可显著增强内皮细胞的迁移能力,而BSA则无此作用。预转染ANXA2 siRNA可显著降低AGE-BSA所诱导的迁移能力,预转染control siRNA则无此作用(图3,见表2)。
表1 ANXA2 siRNA转染内皮细胞后ANXA2蛋白表达的变化Table 1 ANXA2 protein expression in HUVEC after ANXA2 siRNA transfection(±s)
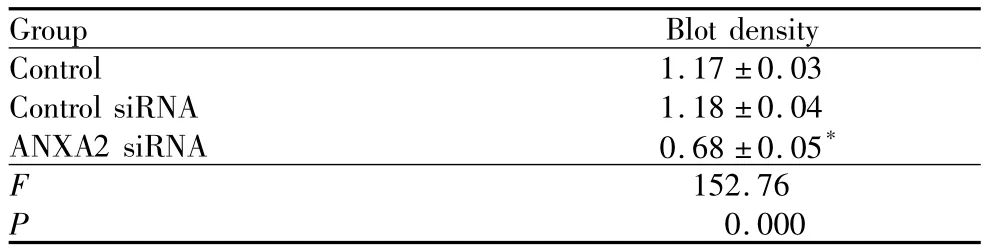
表1 ANXA2 siRNA转染内皮细胞后ANXA2蛋白表达的变化Table 1 ANXA2 protein expression in HUVEC after ANXA2 siRNA transfection(±s)
Note:Compared with control group,*P <0.05
Group Blot density Control 1.17 ±0.03 Control siRNA 1.18 ±0.04 ANXA2 siRNA 0.68 ±0.05*F 152.76 P 0.000

Figure 1 ANXA2 expression in HUVEC decreased after ANXA2 siRNA transfection.A:Untreated group;B:Control siRNA group;C:ANXA2 siRNA group ANXA2 siRNA转染内皮细胞后ANXA2蛋白表达减少。A:对照组;B:阴性干扰组;C:阳性干扰组

Figure 2 Morphous changes of AGE-BSA induced F-actin inhibited by ANXA2 siRNA(×400).A:Control group;B:BSA group;C:AGE-BSA group;D:Control siRNA group;E:ANXA2 siRNA group ANXA2 siRNA抑制AGE-BSA诱导的F-actin形态的改变(×400)。A:空白对照组;B:BSA组;C:AGE-BSA组;D:阴性干扰组;E:阳性干扰组
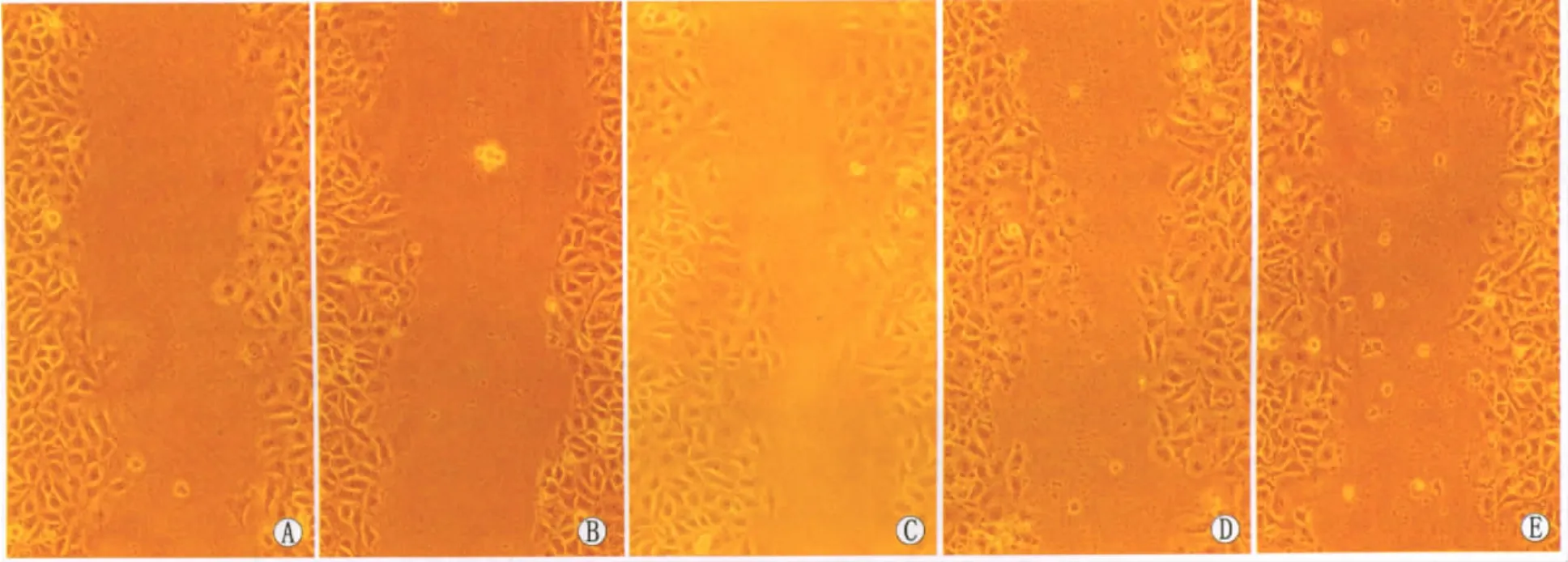
Figure 3 Enhancement of AGE-BSA induced HUVEC migration inhibited by ANXA2 siRNA(×100).A:Control group;B:BSA group;C:AGE-BSA group;D:Control siRNA group;E:ANXA2 siRNA group ANXA2 siRNA抑制AGE-BSA诱导的内皮细胞迁移能力增强(×100)。A:空白对照组;B:BSA组;C:AGE-BSA组;D:阴性干扰组;E:阳性干扰组
表2 ANXA2 siRNA抑制AGE-BSA诱导的内皮细胞迁移能力的变化Table 2 Changes of AGE-BSA induced HUVEC migration inhibited by ANXA2 siRNA(±s)

表2 ANXA2 siRNA抑制AGE-BSA诱导的内皮细胞迁移能力的变化Table 2 Changes of AGE-BSA induced HUVEC migration inhibited by ANXA2 siRNA(±s)
Note:Compared with control group,*P <0.05;Compared with AGE-BSA group,#P <0.05
Group Number of cells Control 153±12 BSA 143±16 AGE-BSA 192±8*Control siRNA 176±6 ANXA2 siRNA 142±14#F 10.231 P 0.001
2.3 AGE-BSA引起ANXA2蛋白酪氨酸磷酸化0.2 g·L-1AGE-BSA 刺激 HUVEC 24 h 后,细胞总ANXA2及酪氨酸磷酸化ANXA2表达的结果显示,总ANXA2表达水平无明显改变,而酪氨酸磷酸化ANXA2表达增加。0.2 g·L-1BSA 刺激HUVEC 24 h后,总ANXA2及酪氨酸磷酸化ANXA2表达水平均无明显改变,提示AGE-BSA可使ANXA2酪氨酸磷酸化,而BSA无此作用(图4,见表3)。
表3 AGE-BSA引起ANXA2蛋白酪氨酸磷酸化Table 3 Tyrosine phosphorylation of ANXA2 protein induced by AGE-BSA(±s)
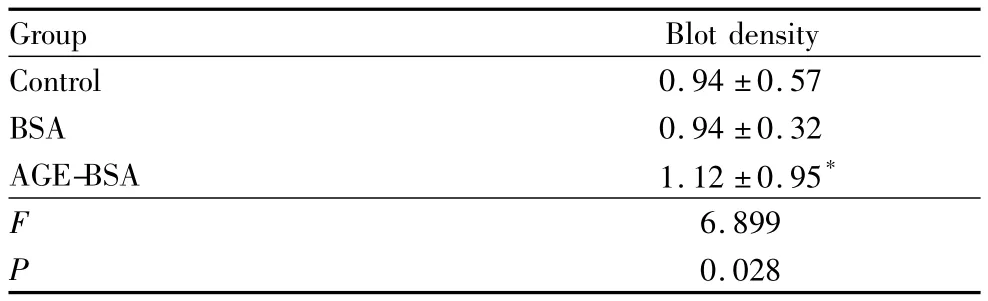
表3 AGE-BSA引起ANXA2蛋白酪氨酸磷酸化Table 3 Tyrosine phosphorylation of ANXA2 protein induced by AGE-BSA(±s)
Note:Compared with control group,*P <0.05
Group Blot density Control 0.94 ±0.57 BSA 0.94 ±0.32 AGE-BSA 1.12 ±0.95*F 6.899 P 0.028

Figure 4 Tyrosine phosphorylation of ANXA2 protein induced by AGE-BSA.A:Control group;B:BSA group;C:AGE-BSA group
3 讨论
AGE是指在非酶促条件下,蛋白质、氨基酸、脂类或核酸的游离氨基与葡萄糖或其他还原糖的醛基通过Maillard反应生成的稳定产物[10]。高糖环境下,AGE可诱导VEGF过度表达而促进新生血管形成[11-12],AGE还可下调VE-钙黏蛋白的表达破坏血-视网膜屏障[13]。
新生血管的形成涉及内皮细胞活化、基底膜降解、细胞外基质降解、内皮细胞迁移、增殖、紧密连接的形成以及周细胞的聚集等,而内皮细胞的迁移则是其中的关键环节[5]。内皮细胞迁移过程中,肌动蛋白细胞骨架持续重塑,丝状伪足、板状伪足及应力纤维的形成协同完成细胞前端突出、突出与底质的黏着、细胞体前移及牵引尾部往前的重复循环。由于研究方法的局限性,研究者无法实时观察细胞应激下肌动蛋白骨架的变化,虽然可以人为将细胞运动分步化,但是细胞运动的瞬时性及连续性不能忽视。诸多研究表明,当细胞的移动性增强时,应力纤维聚集增多;而当细胞的移动性减弱时,应力纤维解体减少,而丝状伪足、板状伪足的特征并不明显[14-18]。本实验中,AGE-BSA组同空白对照组及BSA组相比,细胞微丝骨架应力纤维明显,排布杂乱,数量增多,同时丝状伪足也较后两者明显;而BSA组骨架排布与空白对照组相比未见明显变化,胞内应力纤维同样分布均匀,且同样稀疏。应激反应中应力纤维的形成是骨架重构的表征,实验中微丝骨架重排后应力纤维似向某一方向聚集,符合细胞迁移运动中应力纤维对胞体的牵引作用。同时在迁移实验中,AGE-BSA组与空白对照组及BSA组相比,相同观察时间内迁移入划痕的细胞数明显多于后两者,细胞的迁移能力增强,而BSA组同空白对照组相比,相同观察时间内迁移入划痕的细胞数无明显差异。由此可知AGE可影响内皮细胞骨架重构,进而促进内皮细胞的迁移。但是AGE不可能直接作用于细胞骨架。有研究表明[19],AGE-HSA可通过膜突蛋白磷酸化诱导应力纤维生成,细胞收缩而促使细胞通透性增加。由此我们推想,AGE也极可能通过某种中介蛋白重构细胞骨架,促使细胞迁移能力增加。
ANXA2是钙磷脂结合蛋白Annexin超家族成员之一,与S100A10结合后形成的异源四聚体(A2/S100A10)2位于内皮细胞、肿瘤细胞膜表面,可以促使tPA与纤溶酶原结合,水解细胞外基质,进而促进新生血管形成及肿瘤细胞转移[6,20-21]。针对ANXA2基因敲除鼠的研究表明,敲除鼠不仅内皮细胞的迁移能力降低,而且角膜及视网膜的新生血管明显减少[7]。除了在细胞膜表面发挥促纤溶作用,ANXA2还可见于膜-肌动蛋白细胞骨架连接处,提供(调节)某些膜结构域与肌动蛋白细胞骨架间的连接,进而可影响膜相关肌动蛋白的状态[22-24]。Babbin 等[8]研究发现,ANXA2通过靶向Rho至细胞膜,并协助激活Rho相关信号转导,可促使小肠上皮细胞骨架重构而发生迁移。
进一步研究发现,ANXA2酪氨酸磷酸化是幼仑鼠肾细胞在胰岛素刺激下启动Rho/ROCK依赖性肌动蛋白介导的细胞黏附降低而脱离基质的关键[25]。de Graauw 等[9]及 Hayes等[26]研究亦证实了 ANXA2酪氨酸磷酸化在诱导骨架重构,促使细胞转化及成管中的作用。重要的是,上述研究中在缺乏上游信号刺激时,模拟磷酸化ANXA2的突变体同样可促使细胞骨架重构,细胞表型发生改变。由此可见,ANXA2作为膜-肌动蛋白细胞骨架间的连接,参与信号转导,在细胞转型、黏附、运动等生命活动中发挥着重要作用,并且ANXA2发挥生物学功能的重要环节是酪氨酸磷酸化。干扰实验中,ANXA2阴性干扰组同AGE-BSA组相比,微丝骨架应力纤维分布同样较杂乱,似向胞体中央聚集,而ANXA2阳性干扰组则同空白对照组及BSA组类似,应力纤维较稀疏,且排列较均一。同样在划痕实验中,ANXA2阴性干扰组与AGE-BSA组细胞长入修复划痕的速度相仿,明显快于ANXA2阳性干扰组,而ANXA2阳性干扰组与空白对照组及BSA组相比无明显差异。由此可见,AGE-BSA可促使内皮细胞应力纤维重排,迁移能力增加,而干扰ANXA2的表达可反转AGE-BSA对内皮细胞的上述影响,ANXA2在AGE诱导内皮细胞骨架重构,进而促进内皮细胞迁移的过程中发挥着作用。AGE对ANXA2有何影响呢?本实验表明,AGE-BSA组同空白对照组及 BSA组相比,总ANXA2的表达无明显差异,而酪氨酸磷酸化ANXA2的表达则明显增多,但BSA组与空白对照组相比,二者之间酪氨酸磷酸化ANXA2的表达无明显差异。由此可知,AGE可促使ANXA2发生酪氨酸磷酸化。由于已证实模拟酪氨酸磷酸化ANXA2的突变体可独立重构细胞骨架,增加细胞的能动性。
我们的研究表明,AGE可诱导血管内皮细胞骨架重构而促使内皮细胞迁移,而ANXA2则参与其中,并且极可能通过其活化体即酪氨酸磷酸化的ANXA2发挥中介作用。这既进一步阐明了AGE促进内皮细胞迁移的机制,又同时为ANXA2除了通过促纤溶作用促进细胞迁移外,作为膜-骨架连接蛋白也可通过促进细胞骨架重构进而影响细胞迁移提供了依据。虽然已有研究提示ANXA2作为抑制肿瘤转移/新生血管生长的治疗靶点的可能[27],但其明确的作用机制仍需进一步探讨。
1 林淑玲,陈祥彪.2型糖尿病患者视网膜病变长期随访观察[J].中华眼底病杂志,2006,22(1):49-50.
2 Gillery P.Advanced glycation end products(AGEs),free radicals and diabetes[J].J Soc Biol,2001,195(4):387-390.
3 Vlassara H,Bucala R,Striker L.Pathogenic effects of advanced glycosylation:biochemical,biologic,and clinical implications for diabetes and aging[J].Lab Invest,1994,70(2):138-151.
4 Ma J,Liu T,Dong X.Advanced glycation end products of bovine serum albumin-induced endothelial-to-mesenchymal transition in cultured human and monkey endothelial cells via protein kinase B signaling cascades[J].Mol Vis,2010,(16):2669-2679.
5 Lamalice L,Le Boeuf F,Huot J.Endothelial cell migration during angiogenesis[J].Circ Res,2007,100(6):782-794.
6 Sharma M,Ownbey RT,Sharma MC.Breast cancer cell surface annexin II induces cell migration and neoangiogenesis via tPA dependent plasmin generation[J].Exp Mol Pathol,2010,88(2):278-286.
7 Ling Q,Jacovina AT,Deora A,Febbraio M,Simantov R,Silverstein RL,et al.Annexin II regulates fibrin homeostasis and neoangiogenesis in vivo[J].J Clin Invest,2004,113(1):38-48.
8 Babbin BA,Parkos CA,Mandell KJ,Winfree LM,Laur O,Ivanov AI,et al.Annexin 2 regulates intestinal epithelial cell spreading and wound closure through Rho-related signaling[J].Am J Pathol,2007,170(3):951-966.
9 de Graauw M,Tijdens I,Smeets MB,Hensbergen PJ,Deelder AM,van de Water B,et al.Annexin A2 phosphorylation mediates cell scattering and branching morphogenesis via cofilin activation[J].Mol Cell Biol,2008,28(3):1029-1040.
10 Huebschmann AG,Regensteiner JG,Vlassara H,Reusch JE.Diabetes and advanced glycoxidation end products[J].Diabetes Care,2006,29(6):1420-1432.
11 Bucala R,Tracey KJ,Cerami A.Advanced glycosylation products quench nitric oxide and mediate defective endothelium-dependent vasodilatation in experimental diabetes[J].J Clin Invest,1991,87(2):432-438.
12 Yokoi M,Yamagishi SI,Takeuchi M,Ohgami K,Okamoto T,Saito W,et al.Elevations of AGE and vascular endothelial growth factor with decreased total antioxidant status in the vitreous fluid of diabetic patients with retinopathy[J].Br J Ophthalmol,2005,89(6):673-675.
13 Navaratna D,Mc Guire PG,Menicucci G,Das A.Proteolytic degradation of VE-cadherin alters the blood-retinal barrier in diabetes[J].Diabetes,2007,56(9):2380-2387.
14 Eibl KH,Kook D,Priglinger S,Haritoglou C,Yu A,Kampik A,et al.Inhibition of human retinal pigment epithelial cell attachment,spreading,and migration by alkylphosphocholines[J].Invest Ophthalmol Vis Sci,2006,47(1):364-370.
15 He F,Song ZH.Molecular and cellular changes induced by the activation of CB2 cannabinoid receptors in trabecular meshwork cells[J].Mol Vis,2007,(13):1348-1356.
16 Li R,Maminishkis A,Zahn G,Vossmeyer D,Miller SS.Integrin alpha5beta1 mediates attachment,migration,and proliferation in human retinal pigment epithelium:relevance for proliferative retinal disease[J].Invest Ophthalmol Vis Sci,2009,50(12):5988-5996.
17 Kimura K,Kawamoto K,Teranishi S,Nishida T.Role of Rac1 in fibronectin-induced adhesion and motility of human corneal epithelial cells[J].Invest Ophthalmol Vis Sci,2006,47(10):4323-4329.
18 Lyu J,Lee KS,Joo CK.Transactivation of EGFR mediates insulin-stimulated ERK1/2 activation and enhanced cell migration in human corneal epithelial cells[J].Mol Vis,2006,(12):1403-1410.
19 Guo X,Wang L,Chen B,Li Q,Wang J,Zhao M,et al.ERM protein moesin is phosphorylated by advanced glycation end products and modulates endothelial permeability[J].Am J Physiol Heart Circ Physiol,2009,297(1):238-246.
20 He KL,Deora AB,Xiong H,Ling Q,Weksler BB,Niesvizky R,et al.Endothelial cell annexin A2 regulates polyubiquitination and degradation of its binding partner S100A10/p11[J].J Biol Chem,2008,283(28):19192-19200.
21 Sharma MC,Sharma M.The role of annexin II in angiogenesis and tumor progression:a potential therapeutic target[J].Curr Pharm Des,2007,13(35):3568-3575.
22 Gerke V,Creutz CE,Moss SE.Annexins:linking Ca2+signalling to membrane dynamics[J].Nat Rev Mol Cell Biol,2005,6(6):449-461.
23 Hayes MJ,Shao D,Bailly M,Moss SE.Regulation of actin dynamics by annexin 2[J].Embo J,2006,25(9):1816-1826.
24 Hayes MJ,Merrifield CJ,Shao D,Ayala-Sanmartin J,Schorey CD,Levine TP,et al.Annexin 2 binding to phosphatidylinositol 4,5-bisphosphate on endocytic vesicles is regulated by the stress response pathway[J].J Biol Chem,2004,279(14):14157-14164.
25 Rescher U,Ludwig C,Konietzko V,Kharitonenkov A,Gerke V.Tyrosine phosphorylation of annexin A2 regulates Rho-mediated actin rearrangement and cell adhesion[J].J Cell Sci,2008,121(Pt 13):2177-2185.
26 Hayes MJ,Moss SE.Annexin 2 has a dual role as regulator and effector of v-Src in cell transformation[J].J Biol Chem,2009,284(15):10202-10210.
27 Lima e Silva R,Shen J,Gong YY,Seidel CP,Hackett SF,Kesavan K,et al.Agents that bind annexin A2 suppress ocular neovascularization[J].J Cell Physiol,2010,225(3):855-864.
