siRNA沉默Ikaros基因对K562细胞中γ珠蛋白表达的影响*
2012-11-12吴新忠
马 艳 李 冉 吴新忠,# 胡 珺 曾 玉
地中海贫血,即β珠蛋白合成障碍性贫血,简称地贫,是一种单基因缺陷的遗传性疾病,它是由于β珠蛋白多肽链合成减少或缺失,α链与非α链(β、γ、δ)之间不平衡所导致的以红细胞无效生成为特征的血红蛋白病。重型β-地贫常常有严重的临床症状,多采取规则的输血及祛铁治疗,但大多数病人最终还是死于铁过载相关的心脏疾病,平均寿命不满20岁[1]。有研究表明,合并遗传性胎儿血红蛋白(HbF,α2γ2)持续存在综合症(HPFH)的β-地贫患者,由于γ珠蛋白和α珠蛋白基因的较平衡表达,比单纯β-地贫患者临床症状明显减轻,只有轻微贫血,且不需要输血治疗[2]。因而增加γ珠蛋白肽链的合成,使γ珠蛋白链结合过剩的α珠蛋白链,纠正α与非α链的不平衡,减轻重型β-地贫患者临床症状,已被认为是治疗重型β-地贫的一种有效方法[3]。然而,γ珠蛋白基因具有发育阶段特异性,仅在胎儿期高表达,正常成人的表达量不到其1%,其原因之一是转录因子Ikaros抑制了γ珠蛋白基因表达。因此,本文通过设计siRNA序列及优化干扰条件,特异性沉默Ikaros基因,诱导γ珠蛋白表达增加,从而为重型β-地贫的基因治疗提供新的方法。
1 材料与方法
1.1 主要试剂和仪器
1.1.1 主要试剂:K562细胞由广东省中医院周华友博士惠赠;胎牛血清、RPMI 1640培养基、阳离子脂质体Lipofectamine 2000、Trizol试剂购自美国Invitrogen公司;丁酸钠购自美国Sigma公司;γ珠蛋白一抗购自美国Santa Cruz公司,二抗购自美国Abcam公司;RT-PCR试剂盒购自日本TaKaRa公司,Real-time定量PCR试剂盒购自美国BioRad公司;NC膜购自美国 Whatman公司,羧基荧光素(FAM)标记的阴性siRNA和siRNA-Ikaros由上海吉玛公司合成;Ikaros、γ珠蛋白、GAPDH、β-actin引物均由Invitrogen公司广州分公司合成。
1.1.2 主要仪器:Cytomics FC500流式细胞仪(美国),BioRad凝胶成像仪(美国),Prism 7500ABI Real-time定量PCR仪(美国),Prism 9700ABI半定量 RT-PCR仪(美国)。
1.2 siRNA序列及实验条件的优选
1.2.1 siRNA寡核苷酸序列的设计:检索NCBI GenBank,查找Ikaros基因序列(NM_006060.3),参照siRNA设计原则,利用Invitrogen公司在线软件,设计3条特异性siRNA寡核苷酸序列,分别为siRNA1、siRNA2和siRNA3。siRNA1正义链5′-GUU AAA GUA GAG ACU CAG ATT-3′,反义链5′-UCU GAG UCU CUA CUU UAA CTT-3′;siRNA2 正 义 链 5′-GGA GGC AUU CGA CUU CCU ATT-3′,反 义 链 5′-UAG GAA GUC GAA UGC CUC CTT-3′;siRNA3正义链5′-GAC GCA CUC CGU UGG UAA ATT-3′,反义链 5′-UUU ACC AAC GGA GUG CGU CTT-3′。同时选取一对与Ikaros完全无同源性的siRNA寡核苷酸序列siRNA mock作为阴性对照,其正义链5′-UUC UCC GAA CGU GUC ACG UTT-3′,反 义链 5′-ACG UGA CAC GUU CGG AGA ATT-3′。
1.2.2 siRNA 转染:(1)K562细胞的传代培养:K562细胞株用含10%胎牛血清的RPMI 1640培养液,在37℃、5%CO2条件下培养,2~3天传代一次,共传代6次,传代时用0.25%的胰蛋白酶(含0.1%EDTA)进行消化。1 000r/min,离心5min,弃上清,将细胞打散,用1×PBS洗两遍,加入适量上述培养液重悬细胞,轻轻吹打均匀,计数后用上述培养液调整其终浓度为3.0×106个/ml左右。(2)siRNA转染:将含FAM荧光基团的阴性siRNA与Lipofectamine 2000按不同体积比(3.75∶1、3.75∶2、2∶2、1∶2、0.5∶2)混合后分别转染入稳定对数生长期的K562细胞,总体积为500μl,用流式细胞仪检测转染效率。
1.2.3 RT-PCR检测siRNA1~3的干扰效率:(1)siRNA1~3对Ikaros mRNA表达的抑制作用:取处于稳定对数生长期细胞,分别用siRNA1、siRNA2、siRNA3转染,同时以未经任何处理的K562细胞作为空白组,每组均设3个复孔。72h后分别收集K562细胞,用冷PBS清洗后采用Trizol试剂盒提取细胞总RNA,以T重复寡核苷酸(Oligo-DT)为引物将其逆转录为cDNA。Ikaros基因的扩增引物:正义链5′-CGG CTT TGT CGG GAG TT-3′,反义链5′-GCA CAG GTC TTC TGC CAT TT-3′,扩增产物为458bp;内参选取GAPDH,其引物正义链5′-GGG GCC ATC CAC AGT CTT C-3′,反义链5′-CAC CAT CTT CCA GGA GCG AG-3′,扩增产物352bp。扩增条件:94℃30s,53℃40s,72℃30s,35个循环。扩增产物经1.2%琼脂糖凝胶电泳,紫外透射灯下观察,凝胶成像仪拍照后用Quantity One软件进行灰度分析。表达抑制率=(1-转染组Ikaros mRNA灰度比值/空白组Ikaros mRNA灰度比值)×100%。选择抑制率最高的siRNA序列进行后续实验。(2)siRNA的最佳干扰时间:选择干扰效率最高的siRNA序列转染至K562细胞后24h、48h、72h、96h、120h、144h分别收集细胞,采用RT-PCR方法检测Ikaros的 mRNA水平,GAPDH为内参,以Ikaros最低表达的时间点确定为最佳干扰时间。
1.3 沉默实验分组及处理
实验共设置siRNA组、丁酸钠组、丁酸钠+siRNA组、阴性对照组和siRNA空白组。以最佳siRNA序列作为siRNA组;丁酸钠组是其单独作用于K562细胞后γ珠蛋白表达增强的阳性对照组,根据文献[3]选择0.5mmol/L浓度进行实验;丁酸钠+siRNA组即将最佳siRNA+0.5mmol/L丁酸钠进行双重干预;阴性对照组为不具有沉默功能的siR-NA mock转染组;空白组为不行任何干预的K562细胞。取稳定对数生长期K562细胞,经离心、计数、铺板后,按上述分组进行处理,于已确定的最佳干扰时间收集各组细胞,每组均设3复孔进行实验。
1.4 Real-time定量PCR检测Ikaros和γ珠蛋白mRNA的表达
按Trizol试剂盒说明书分别提取五组细胞的总RNA,采用Real-time定量PCR检测Ikaros和γ珠蛋白mRNA的表达水平。Ikaros的引物和扩增条件见1.2.3,γ珠蛋白PCR的引物序列和扩增条件为:正义链5′-GTC CTC TGC CTC TGC CAT CA-3′,反义链5′-ATA CAG GGC ACT GGC CAC TC-3′,扩增条件为94℃预变性4min,然后94℃1min,50℃30s,72℃40s,共28个循环,循环结束后72℃延伸10min,扩增产物283bp。内参选取β-actin,引物序列正义链5′-TGG CAC CCA GCA CAA TGA A-3′,反 义 链 5′-CTA AGT CAT AGT CCG CCT AGA AGC A-3,扩增产物186bp。以β-actin作为内对照进行归一化处理,以空白组细胞的mRNA水平作为基准,分别对各组K562细胞的Ikaros和γ珠蛋白mRNA水平进行相对表达量分析。
1.5 Western blotting检测γ珠蛋白表达水平
各组K562细胞加入蛋白抽提裂解液抽提细胞总蛋白,冰浴15min,离心收集细胞总蛋白。蛋白提取物经定量后,取25μg上样至12%SDS-PAGE,电泳,常规转至NC膜。经5%脱脂奶粉封闭后加入一抗(稀释度1∶1 000),4℃平缓摇动过夜。次日洗膜3次后,加入二抗(稀释度1∶5 000),孵育,经ECL显色,显影、定影成像后对胶片进行灰度扫描。选取GAPDH作为内参,以空白组灰度水平作为基准,对各组K562细胞的γ珠蛋白水平进行灰度比值分析。
1.6 联苯胺染色检测Hb水平
K562细胞内Hb浓度用联苯胺染色法进行检测。分别收集各组培养24h、48h、72h、96h、120h、144h的K562细胞,制备成悬液。按文献[4]方法进行染色,胞浆呈浅绿色的K562细胞为联苯胺染色阴性,蓝色为染色阳性。计数200个细胞中的阳性细胞数,计算阳性细胞率。
1.7 统计学处理
用SPSS 13.3统计学软件对实验数据进行统计学分析。用均数±标准差(s)表示所有实验数据,用F检验对各组进行方差齐性检验,用单因素方差分析进行组间比较,用LSD法进行多组间两两比较;百分率(%)比较采用χ2分析。P<0.05表示差异有统计学意义。
2 结 果
2.1 siRNA筛选结果
2.1.1 siRNA转染效率及条件:含FAM荧光基团的阴性siRNA转染K562细胞后,24h、48h、72h分别收集细胞,用流式细胞仪检测转染效率。结果显示,转染48h效率最高,达到58.7%,如图1所示。转染条件为:K562细胞用不含抗生素的培养液培养24~72h后,用纯RPMI 1640培养基重悬浮进行转染,siRNA与Lipofectamine 2000的比例为3.75∶2(μl),细胞悬液终体积为500μl。
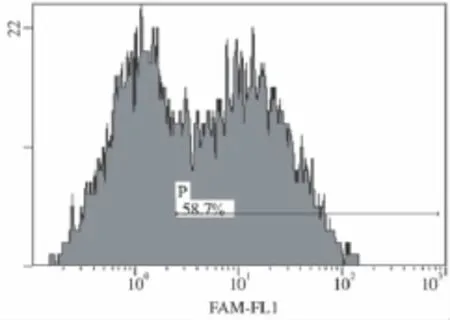
图1 含FAM荧光基团的阴性siRNA转染K562的流式细胞图
2.1.2 不同序列siRNA对Ikaros mRNA表达的抑制作用比较:3条siRNA基因序列干扰K562细胞后Ikaros基因mRNA的表达情况如图2所示,siRNA1、siRNA2和siRNA3三组与空白组之间的灰度比值有统计学差异(P<0.05),siRNA1、siRNA2、siRNA3之间的灰度比值虽无统计学差异(P>0.05),但siRNA3较siRNA1和siRNA2更低一些,其对Ikaros mRNA的表达抑制率最高,达到86.7%。因而后续实验选用siRNA3为最佳干扰序列。
2.1.3 siRNA 的最佳干扰时间:结果显示:siRNA3转染K562细胞后24h,其Ikaros mRNA的表达量开始减少,72h表达量最低,与空白组和阴性对照组之间有显著差异(P<0.05),96h~144h逐渐增加(图3)。由此确定siRNA3的最佳干扰时间为转染后72h。
2.2 siRNA3沉默Ikaros对K562细胞Ikaros mRNA的影响

图2 3条siRNA基因序列干扰Ikaros mRNA表达的RT-PCR结果

图3 siRNA3转染K562细胞后Ikaros mRNA表达水平
siRNA3转染K562细胞后72h,收集五组细胞,进行 Real-time PCR。结果显示,siRNA3、siRNA3+丁酸钠两组Ikaros mRNA的相对表达量比丁酸钠、阴性对照和空白组明显减低,差异有统计学意义(P<0.05),而siRNA3组和siRNA3+丁酸钠两组之间,丁酸钠、阴性对照和空白三组之间的差异无统计学意义(P>0.05)。见图4。

图4 siRNA3沉默Ikaros基因对K562细胞Ikaros mRNA的影响
2.3 siRNA3沉默Ikaros对K562细胞γ珠蛋白mRNA的影响
Real-time PCR 结果 显示,siRNA3、丁酸 钠和siRNA3+丁酸钠三组γ珠蛋白mRNA相对表达量明显高于阴性对照和空白组,差异有统计学意义(P<0.05);siRNA3、丁酸钠和siRNA3+丁酸钠三组之间,以及阴性对照和空白组之间差异无统计学意义(P>0.05)。见图5。

图5 siRNA3沉默Ikaros基因对K562细胞γ珠蛋白mRNA的影响
2.4 siRNA3沉默Ikaros对K562细胞γ珠蛋白蛋白水平的影响
Western blotting检测结果显示,siRNA3、丁酸钠和siRNA3+丁酸钠三组,γ珠蛋白表达量(以灰度比值表示)明显高于阴性对照和空白组,差异有统计学意义(P<0.05);siRNA3、丁酸钠和siRNA3+丁酸钠三组之间,以及空白与阴性对照组之间无明显差异(P>0.05)。见图6。

图6 siRNA3沉默Ikaros基因对K562细胞γ珠蛋白蛋白水平的影响
2.5 siRNA3沉默Ikaros对K562细胞Hb水平的影响

图7 siRNA3沉默Ikaros后K562细胞联苯胺阳性细胞率的变化
K562细胞胞浆呈蓝色为联苯胺染色阳性,阳性率越高,表示其Hb含量越高。siRNA3等沉默Ikaros后K562细胞联苯胺阳性细胞率的变化趋势见图7。阴性对照和空白组的联苯胺染色阳性细胞率每天比较接近,平均4.77~5.44%;而siRNA3、丁酸钠、siRNA3+丁酸钠三组的培养72h细胞联苯胺染色阳性率均较高,分别为32.5%、31.3%和33.1%,与前两组相比,差异有统计学意义(P<0.05)。三个处理组培养96h阳性率与72h接近,之后逐渐降低。
3 讨 论
嘧啶(PYR)复合物(因其DNA结合位点富含嘧啶碱基而得名)含有三个不同的组分:转录因子Ikaros(DNA结合亚单位)、SWI/SNF(染色质重塑组分)和NURD(核小体重塑和组蛋白脱乙酰转移酶亚单位)。Chakalova等[2]发现PYR复合物可以介导γ→β珠蛋白的开关转换,缺失该复合物的病人,其血液中 HbF明显升高;O’Neill等[5]发现Ikaros在成人红系造血细胞中高度表达,对造血细胞的分化有重要调控作用;Ferrante等[6]发现丁酸盐等短链脂肪酸具有组蛋白脱乙酰基酶抑制物活性,可通过作用于NURD,增强γ珠蛋白基因的表达。因此,通过siRNA沉默Ikaros基因,逆转或延迟γ→β珠蛋白的开关转换,或能增强γ珠蛋白的表达。
本文结果显示,通过Lipofectamine 2000转染针对Ikaros的3种siRNA至K562细胞,均能有效沉默Ikaros基因,以siRNA3的抑制率最高。在mRNA水平上,siRNA3干扰Ikaros的效率在转染72h后达高峰,随后逐渐下降;γ珠蛋白mRNA和蛋白表达在Ikaros被沉默后72h有明显增加;随后通过联苯胺染色法,从细胞水平上也证实在72~96hK562细胞内γ珠蛋白的表达量明显增加。表明siRNA3可有效抑制转录因子Ikaros活性,从而上调γ珠蛋白的表达,但随着siRNA在干扰作用中的消耗和降解,其作用会逐渐减弱。
运用siRNA3干扰Ikaros或者0.5mmol/L的丁酸钠作用于K562细胞均可增加γ珠蛋白的表达量,说明Ikaros和NURD在γ珠蛋白的表达过程中均起到负调控作用,它们在γ→β开关转换中的作用机制可能同属于PYR复合物这一通路。然而siRNA3+丁酸钠联合干扰与单独siRNA3或丁酸钠组相比,γ珠蛋白表达量并没有明显增加,二者之间没有协同作用,其原因有待进一步实验和探讨。
针对γ→β珠蛋白开关转换研究已有三十余年,虽然对其认识不断深入,但具体机制仍不清楚。近年来对γ珠蛋白基因的一些顺式或反式调控因子进行干预,上调γ珠蛋白表达的研究报道越来越多[7,8],体 外 研 究 结 论 也 提 示 通 过 siRNA 沉 默Ikaros基因可以增加γ珠蛋白的表达,这可能为重型地中海贫血等血红蛋白病患者提供新的治疗策略。但Ikaros是正常淋巴细胞发育的重要转录因子,在其分化和发育过程中起调节作用[9],干扰Ikaros基因是否对淋巴细胞增殖和发育造成影响及其影响程度尚需进一步研究。
1 Modell B,Darlison M.Global epidemiology of haemoglobin disorders and derived service indicators[J].Bull World Health Organ,2008,86(6):480~487.
2 Chakalova L,Osborne CS,Dai YF,et al.The Corfuδβthalassemia deletion disruptsγ-globin gene silencing and reveals posttranscriptional regulation of HbF expression[J].Blood,2005,105(5):2 154~2 160.
3 Weinberg RS,J I X,Sution M,et al.Butyratic increases the efficiency of transiation of gamma-globin mRNA[J].Blood,2005,105(4):1 807~1 809.
4 Tabilio A,Pelicci PG,Vinci G,et al.Myeloid and megakaryocytic properties of K-562cell lines[J].Cancer Res,1983,43(6):4 569~4 574.
5 O’Neill D,Schoetz S,Lopez R,et al.An Ikaros-containing chromatin-remodeling complex in adult-type erythroid cells[J].Mol Cell Biol,2000(20):7 572~7 582.
6 Ferrante RJ,Kubilus JK,Lee J,et al.Histone deacetylase inhibition by sodium butyrate chemotherapy ameliorates the neurodegenerative phenotype in Huntington's disease mice[J].Neurosci,2003,23(28):9 418~9 427.
7 Vakoc CR,Letting DL,Gheldof N,et al.Proximity among distant regulatory elements at theβ-globin locus requires GATA-1 and FOG-1[J].Mol Cell,2005,17(3):453~462.
8 Xiaoxin S Xu,Xin Hong,Gan Wang.Induction of endogenousγglobin gene expression with decoy oligonucleotide targeting Oct-1 transcription factor consensus sequence[J].Hematology & Oncology,2009,2(15):1~11.
9 Georgopoulos K,Moore DD,Derfler B.Ikaros,an early lymphoid-specific transcription factor and a putative mediator for T cell commitment[J].Science,1992,258(5083):808~812.
