转谷氨酰胺酶酶原在大肠杆菌中的重组优化表达
2012-11-02杨慧林
王 坤,杨慧林,王 斌,潘 力
(华南理工大学生物科学与工程学院,广东广州510006)
转谷氨酰胺酶酶原在大肠杆菌中的重组优化表达
王 坤,杨慧林,王 斌*,潘 力
(华南理工大学生物科学与工程学院,广东广州510006)
茂原链霉菌(Streptomyces mobaraensis)转谷氨酰胺酶酶原(pro-transglutaminase,pro-TG)在重组大肠杆菌中的表达量低,限制了其在食品、化妆品、纺织行业中的应用。通过对转谷氨酰胺酶酶原的基因序列进行密码子优化,降低其GC含量,提高了它在大肠杆菌中的表达水平,结果表明经优化后转谷氨酰胺酶原的表达量达到了优化前的4.4倍。为提高转谷氨酰胺酶的比活力,通过基于融合PCR的定点突变技术将转谷氨酰胺酶第二位的丝氨酸突变为脯氨酸,突变后转谷氨酰胺酶的比活力达到了突变前的1.26倍。上述研究结果表明,密码子优化及定点突变技术可以应用于优化转谷氨酰胺酶酶原在大肠杆菌中的表达。
转谷氨酰胺酶酶原,密码子优化,定点突变,大肠杆菌,表达
1 材料与方法
1.1 材料与仪器
茂原链霉菌(Streptomyces mobaraensis)、E.coli Mach1T1、E.coli BL21(DE3)、表达载体pET22b(+) 本实验室保藏;密码子优化后的pro-MTG基因 由上海旭冠生物科技有限公司合成,连接在PEs载体上(PEs-proTG),密码子优化的依据主要是降低基因的GC含量,降低自由能,增加mRNA的稳定性;pSIMPLE-18 EcoRV/BAP Vector 购于宝生物工程(大连)有限公司;基因组DNA提取试剂盒、质粒提取试剂盒、胶回收试剂盒 购于北京普博欣公司;KOD-plus-Neo DNA聚合酶 购于东洋纺;限制性内切酶NdeI、XhoI、T4polynucleotide Kinase 购于Fermentas公司;PCR引物 由Invitrogen合成;其余试剂 国产分析纯。
Mastercycler gradient PCR仪 德国eppendorf公司;超声细胞破碎仪 浙江新芝公司;ÄKTA explorer蛋白纯化系统 美国GE公司;Centrifuge 5418型离心机,BioPhotometer分光光度仪。
1.2 实验方法
1.2.1 转谷氨酰胺酶酶原基因的PCR扩增 利用细菌基因组DNA提取试剂盒提取茂原链霉菌的基因组DNA,以基因组DNA为模板,利用表1中的引物“pro-MTG-sense”和“pro-MTG-antisense”进行PCR扩增得到转谷氨酰胺酶酶原基因(pro-MTG)。以PEs-proMTG质粒为模板,利用表1中的引物“pro-MTG优化-sense”和“pro-MTG优化-antisense”进行PCR扩增,得到优化后的转谷氨酰胺酶酶原基因(pro-MTG优化)。以PEs-proMTG质粒为模板,通过融合PCR技术扩增得到pro-MTG成熟酶第二位丝氨酸突变为脯氨酸的突变基因(pro-MTG-S2P),利用的引物为“pro-MTGS2P-sense-1”、“pro-MTG-S2P-antisense-1”、“pro-MTG-S2P-sense-2”、“pro-MTG-S2P-antisense-2”,序列见表1。
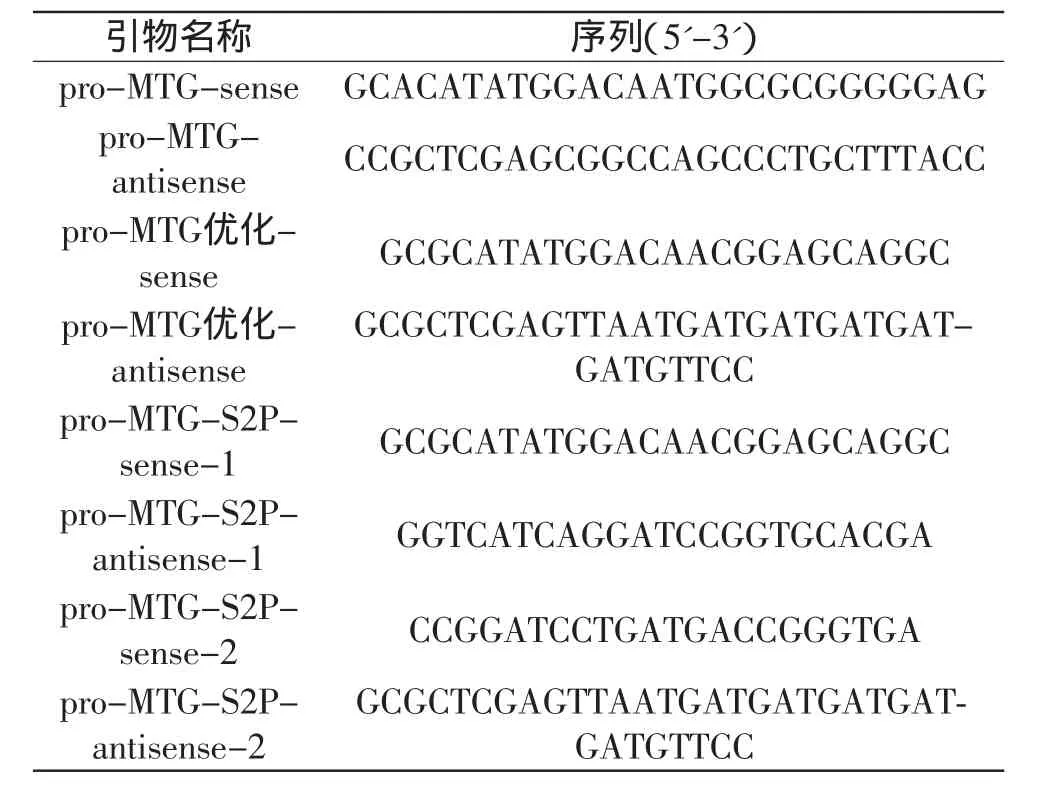
表1 PCR扩增pro-TG所使用的引物序列Table 1 PCR primers for amplification of pro-MTG gene
1.2.2 转谷氨酰胺酶表达载体的构建 通过PCR获得了转谷氨酰胺酶的基因片段,经胶回收后用T4polynucleotide Kinase对PCR产物进行磷酸化修饰,然后与克隆载体pSIMPLE-18 EcoRV/BAP Vector连接,得到重组质粒pSIMPLE-pro-MTG、pSIMPLE-pro-MTG优化、pSIMPLE-pro-MTG-S2P。重组质粒转化E.coli Mach1T1,挑选转化子并进行测序鉴定。
用NdeI+XhoI双酶切pro-MTG的重组质粒pSIMPLE-pro-TG、pSIMPLE-pro-MTG优化、pSIMPLE-pro-MTG-S2P以及载体pET22b(+),经胶回收后,用T4DNA连接酶将基因片段pro-MTG、pro-MTG优化、pro-MTG-S2P分别与经双酶切的载体pET22b连接并转化E.coli Mach1T1,挑选阳性转化子,提取质粒后转化E.coli BL21(DE3),所得转化子即为转谷氨酰胺酶的大肠杆菌工程菌株,分别命名为pET22bproMTG/BL21、pET22b-proMTG优化/BL21、pET22bproMTG-S2P/BL21。
1.2.3 转谷氨酰胺酶在重组大肠杆菌中的表达及纯化 将重组大肠杆菌pET22b-proMTG/BL21、pET22bproMTG优化/BL21、pET22b-proMTG-S2P/BL21接种到LB液体培养基中(含50mg/L氨苄青霉素Amp),37℃培养过夜后取1mL转接到100mL LB液体培养基中(含100mg/L Amp),37℃,200r/min培养2h,然后加入异丙基-β-D-硫代吡喃半乳糖苷(IPTG)至终浓度1mmol/L,22℃,200r/min培养过夜。
收集重组菌的培养液,采用超声破碎仪破碎细胞,条件为:功率20%、工作3s、间歇5s、破碎10min。细胞破碎后4℃,10000r/min离心15min,收集上清液即得到粗酶液。取上清液及沉淀分别制备SDS-PAGE电泳样品进行电泳检测。pro-MTG蛋白的纯化采用GE公司的His-tag亲和层析柱。
1.2.4 转谷氨酰胺酶酶原的激活及其酶活测定 分别取0.5mL粗酶液及经亲和层析纯化的酶,各加入50μL 0.1%的胰蛋白酶,混匀后37℃水浴30min,即得到成熟的转谷氨酰胺酶。酶活测定采用Crossowicz比色法[14],以N-α-CBZ-Gln-Gly作为底物,以L-谷氨酸-γ-单羟肟酸制作标准曲线。酶活力单位定义为:37℃时1min催化N-α-CBZ-Gln-Gly生成1μmol L-谷氨酸-γ-单羟肟酸所需要的酶量。
2 结果与分析
2.1 pro-MTG基因及其表达载体的鉴定

图1 转谷氨酰胺酶酶原基因的PCR扩增及其表达载体的酶切鉴定Fig.1 PCR amplification of pro-MTG gene and identification of its expression vectors by enzyme digestion
通过PCR扩增得到了pro-MTG基因片段以及经过密码子优化和定点突变的基因片段,电泳结果表明所得基因片段与预计大小一致(约1.2kb,图1A)。将所得基因片段分别与pSIMPLE-18 EcoRV/BAP Vector连接,得到的重组质粒经NdeI+XhoI双酶切后胶回收目的片段,将回收的片段分别与经NdeI+XhoI双酶切的pET22b(+)载体连接,构建得到pro-TG基因的表达载体pET22b-proMTG、pET22b-proMTG优化、pET22b-proMTG-S2P,双酶切鉴定得到了与pro-MTG基因大小一致的酶切片段(约1.2kb,图1B),表明表达载体构建成功,转化E.coli BL21(DE3)后得到相应的工程菌株pET22b-proMTG/BL21、pET22bproMTG优化/BL21、pET22b-proMTG-S2P/BL21。
2.2 pro-MTG的高效表达
培养三种pro-MTG的重组大肠杆菌,经诱导表达10h后离心收集菌体,破碎细胞后离心取上清液制备成粗酶液,体积均为30mL。表达载体pET22b(+)上含有his6标签序列,因此可利用His-tag亲和层析柱纯化酶蛋白。考马斯亮蓝法测定纯化后的蛋白浓度分别为0.8mg/mL(pro-MTG)、3.5mg/mL(pro-MTG优化)、3.8mg/mL(pro-MTG-S2P)。将粗酶液、沉淀及纯化蛋白等体积上样(20μL),进行SDS-PAGE电泳检测,结果表明经密码子优化后pro-MTG的表达量有显著提高,而且可溶性表达的pro-MTG占了绝大多数(图2)。以上结果表明密码子优化可以有效地提高外源蛋白在大肠杆菌中的表达水平。
对纯化后的pro-MTG蛋白进行酶活测定,结果表明未经密码子优化和定点突变的原始MTG蛋白的比活力为20.34U/mg,略低于文献报道的22.6U/mg[4];而经过密码子优化及定点突变的MTG蛋白的比活力分别达到了26U/mg和32.9U/mg。上述结果表明关键位点的定点突变可以有效提高MTG蛋白的比活力(表2)。

图2 pro-MTG表达产物的SDS-PAGE电泳检测Fig.2 SDS-PAGE verification of the expression level of pro-MTG gene
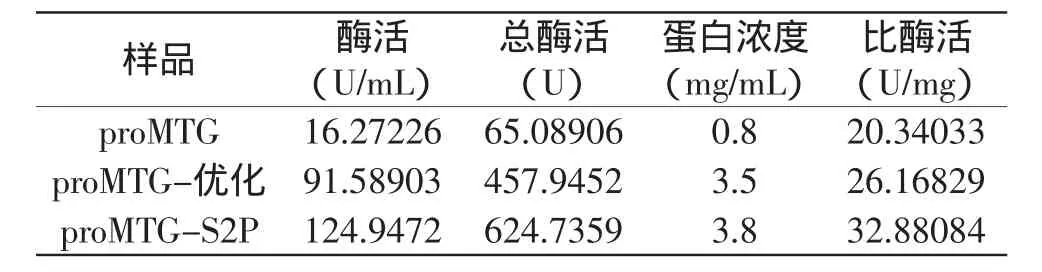
表2 亲和层析纯化后转谷氨酰胺酶的酶活测定Table 2 Enzyme activity assay of recombinant MTG after affinity chromatography
3 讨论
目前,商品化的转谷氨酰胺酶主要是通过茂源链霉菌发酵生产,此方法发酵周期长、发酵过程难控制及产量低,这些因素导致了其生产成本较高。通过基因工程的手段生产转谷氨酰胺酶是降低其成本的一个有效手段。大肠杆菌作为一个成熟的异源蛋白表达体系,可用于发酵生产转谷氨酰胺酶酶原,但是表达水平较低。由于链霉菌属基因组DNA的GC含量高,转谷氨酰胺酶基因自身的GC含量高达65%,这可能是造成其在大肠杆菌中表达水平低的原因。本研究对转谷氨酰胺酶酶原基因序列进行了密码子优化,使其GC含量降低至47.8%,并化学合成了优化后的基因,优化的基因在大肠杆菌中的表达量达到了未优化前的4.4倍。除了提高酶的表达量之外,提高酶的比活力也是降低生产成本的重要策略。本研究根据相关文献报道,利用融合PCR技术,将pro-MTG成熟酶第二位的丝氨酸突变为脯氨酸[13],使得突变后酶的比活力达到了突变前的1.26倍。上述研究结果表明通过密码子优化及定点突变技术可以提高转谷氨酰胺酶的表达效率。
此外,转谷氨酰胺酶对大肠杆菌是一种毒性蛋白,因此只能以酶原的形式表达,然后通过蛋白酶切割而形成有活性的成熟酶,这就增加了生产过程的成本,也给转谷氨酰胺酶的利用带来了不便。若能构建一个表达体系,使得可以直接表达成熟的转谷氨酰胺酶,将会大大降低生产成本,并有利于该酶的普及应用,这将是本课题进一步的研究方向。
[1]ZhuY,RinzemaA,TramperJ,et al.Microbial transglutaminasea review of its production and application in food processing[J]. Appl Microbiol Biotechnol,1995,44:277-282.
[2]黄志良,宁正祥.转谷氨酰胺酶对乳蛋白质的改性作用[J].食品工业科技,2002(3):77-79.
[3]韩璐,潘力.转谷氨酰胺酶在食品加工中的应用[J].食品科技,2007,32(1):140-143.
[4]Ando H,Adachi M,Umeda K,et al.Purification and characteristics of a noveltransglutaminase derived from microorganisms[J].Agric Biol Chem,1989,53:2613-2617.
[5]王璋,王灼维.微生物谷氨酰胺转胺酶高产菌株的诱变选育[J].食品科学,2003,24(5):62-67.
[6]王璋,王灼维,袁辉,等.微生物转谷氨酰胺酶生产菌的“神舟四号”飞船搭载育种研究[J].食品与发酵工业,2003,29(1):6-12.
[7]Yu YJ,Wu SC,Chan HH,et al.Overproduction of soluble recombinant transglutaminase from Streptomyces netropsis in Escherichia coli[J].Appl Microbiol Biotechnol,2008,81(3):523-532.
[8]徐斌,韩之波,杨萍,等.茂原链轮丝菌转谷氨酰胺酶基因在大肠杆菌中高效表达[J].生物工程学报,2005,21(5):794-798.
[9]Washizu K,Ando K,Koikeda S,et al.Molecular cloning of the gene for microbial transglutaminase from Streptoverticillium and its expression in Streptomyces lividans[J].Biosci Biotechnol Biochem,1994,58(1):82-87.
[10]Marx CK,Hertel TC,Pietzsch M.Purification and activation of a recombinant histidine-tagged pro-transglutaminase after soluble expression in Escherichia coli and partial characterization of the active enzyme[J].Enzyme Microb Technol,2008,42(7):568-575.
[11]Date M.High level expression of Streptomyces mobaraensis transglutaminase in Corynebacterium glutamicum using a chimeric pro-region from Streptomyces cinnamoneus transglutaminase[J]. J Biotechnol,2004,110(3):219-226.
[12]Yang HL,Pan L,Lin Y.Purification and on-Column activation of a recombinant histidine-tagged pro-Transglutaminase after soluble expression in Escherichia coli[J].Biosci Biotechnol Biochem,2009,73(11):2531-2534.
[13]Sommer C,Volk N,Pietzsch M.Model based optimization of the fed-batch production of a highly active transglutaminase variant in Escherichia coli[J].Protein Expres Purif,2011,77(1):9-19.
[14]Crossowicz N,Wainfan E,Borek E.The enzymatic formation of hydroxamic acids from glutamine and asparagine[J].J Biol Chem,1950,187:111-125.
Recombinant expression and optimization of pro-transglutaminase gene in Escherichia coli
WANG Kun,YANG Hui-lin,WANG Bin*,PAN Li
(School of Bioscience and Bioengineering,South China University of Technology,Guangzhou 510006,China)
The pro-transglutaminase gene was subjected to codon usage optimization and then expressed in E. coli.Results demonstrated that GC content of the optimized gene decreased and its expression level was improved by 3.4-fold than the unoptimized gene.In order to improve the specific activity of transglutaminase,the serine at the second site of transglutaminase was mutated to proline by site-directed mutagenesis technology.The specific activity was 1.26-fold of the unmutated gene.The above results suggested that codon usage optimization and site-directed mutagenesis technology could be utilized to improve the expression level of pro-transglutaminase in E.coli.
pro-transglutaminase(pro-TG);codonusageoptimization;site-directedmutagenesis;Escherichiacoli;expression
Q786
A
1002-0306(2012)07-0181-04
转谷氨酰胺酶(transglutaminase,TG,EC 2.3.2.13)是一种通过催化多肽链中酰基基团转移使蛋白质之间发生共价交联反应的转移酶[1],它催化蛋白分子之间发生交联反应,提高蛋白质的水溶性、持水性、塑性和热稳定性等,从而提高蛋白质的应用价值[2]。转谷氨酰胺酶可分为两大类:一类来源于哺乳动物,另一类来源于微生物。微生物转谷氨酰胺酶(microbial transglutaminase,MTG)多以酶原形式(pro-MTG)表达,活性不依赖钙离子,具有很多优势,因此它的应用领域非常广泛[3]。日本Ando等[4]以茂源链霉菌发酵生产MTG取得了一定的经济效应,但是其产量远未满足市场需求。目前,主要是通过以下几种方法来提高MTG的产量:第一,通过诱变育种筛选高效产酶的菌株,包括传统诱变育种和太空诱变育种[5-6];第二,通过基因工程的方法构建高效表达MTG的工程菌株[7-11]。然而,目前MTG的产量始终不尽如人意。本实验室曾构建了pro-MTG的大肠杆菌工程菌株,通过柱上激活的方法方便快速地获得了纯化的转谷氨酰胺酶[12],但是表达水平仍然比较低。本研究期望通过对pro-MTG的基因序列进行密码子优化,提高其在大肠杆菌中的表达水平。同时参考相关文献报道[13],通过融合PCR将pro-MTG成熟酶第二位的丝氨酸突变为脯氨酸,以期获得比活力更高的重组表达的pro-MTG。
2011-07-04 *通讯联系人
王坤(1989-),男,硕士研究生,研究方向:基因工程。
广东省科技攻关项目(2006B13001006)。
