树脂法同时脱除虫草粗多糖中色素与蛋白质
2012-11-02姚凌云王晓东袁晓凡
肖 杰,姚凌云,孙 健,王晓东,袁晓凡,赵 兵,*
(1.中国科学院过程工程研究所生化工程国家重点实验室,北京100190;2.中国科学院研究生院,北京100049)
树脂法同时脱除虫草粗多糖中色素与蛋白质
肖 杰1,2,姚凌云1,2,孙 健1,2,王晓东1,袁晓凡1,赵 兵1,*
(1.中国科学院过程工程研究所生化工程国家重点实验室,北京100190;2.中国科学院研究生院,北京100049)
引入综合吸附效应指数反映树脂的脱色、脱蛋白以及多糖保留能力,并以该效应指数评价了8种树脂对虫草粗多糖的脱色、脱蛋白效果。结果表明,D113树脂具有理想的脱色、脱蛋白效果。在优化的静态吸附工艺条件下,D113脱色率可达79.5%±1.7%,脱蛋白率达82.2%±1.7%,多糖保留率达75.0%±1.8%。对D113树脂的动态吸附性能研究表明,流速为1.5BV/h,树脂床径高比为1∶15,树脂处理量为8.4mg/mL时,D113脱色率为85.1%±1.9%,脱蛋白率为85.0%±2.0%,多糖保留率为80.2%±2.2%。50%乙醇盐酸溶液以12BV/h流速洗脱1h后,树脂再生性能良好。
虫草粗多糖,树脂,脱色,脱蛋白
冬虫夏草(Cordyceps sinensis)是我国传统名贵中药,含有虫草素、虫草酸、虫草多糖等多种生理活性成分[1],其中虫草多糖因具有抗肿瘤、降血糖及免疫调节作用等广泛的药理作用而倍受关注[2-4]。由于天然虫草资源匮乏,目前其资源主要是通过液态发酵等人工方法获得。发酵法获得的虫草菌丝体经水提醇沉即得虫草粗多糖,但其色泽为棕红色,并含有色素、蛋白质及一些小分子杂质。这不仅给多糖的分离纯化、结构鉴定及其生物活性研究带来困难,也限制了虫草多糖在临床制剂和保健产品领域的应用。目前,主要采用活性炭吸附法、过氧化氢氧化法去除虫草粗多糖中的色素,常用的脱蛋白方法为Sevage法(氯仿-正丁醇法)。但活性炭吸附以及过氧化氢氧化法的脱色效率不高,Sevage法脱蛋白效率低,多糖损失率高,且操作过程使用大量有机溶剂。因而探索高效的虫草粗多糖脱色、脱蛋白工艺十分必要。树脂法脱色、脱蛋白是近几年发展起来的一种新技术[5-6],其具有操作简便、脱色效果好、工艺稳定等优势。目前尚未见树脂法同时脱除虫草粗多糖中色素、蛋白质的研究报道。为客观评价树脂对粗多糖脱色、脱蛋白以及多糖保留的综合能力,实验中引入了综合效应指数,并依此效应指数对树脂进行了筛选,对筛选出的树脂进行了静态、动态吸附条件以及再生条件的考察。研究方法及结果不仅为虫草粗多糖脱色脱蛋白提供有效途径,也为其他多糖的脱色脱蛋白过程提供参考。
1 材料与方法
1.1 材料与仪器
发酵虫草菌丝体干粉 杭州雪域生物有限公司;ADS-7、NKA、D113、D72、D301、D201、ADS-8、X-5大孔吸附树脂 南开大学化工厂;考马斯亮蓝G250 美国Sigma公司,分析纯;苯酚、浓H2SO4、HCl、NaOH等 均为分析纯试剂。
2802紫外可见分光光度计 中国UNIC公司;HZQ-QG恒温振荡器 中国哈尔滨东联电子技术开发有限公司;FE-20精密pH酸度计 瑞士Mettler Toledo;玻璃层析柱(直径15mm,高300mm) 北京金志业仪器设备有限责任公司。
1.2 实验方法
1.2.1 虫草菌丝体粗多糖的制备 虫草菌丝体经乙醇回流脱脂、烘干后,采用超声波辅助水提,提取条件为:超声功率300W,料液比1∶35(g∶mL),提取时间30min,提取温度60℃,pH=5。提取液离心后,上清液浓缩至原体积的1/3,加入4倍体积无水乙醇,在4℃静置12h,离心进行固液分离,收集固相,经无水乙醇洗涤后于60℃下真空(-0.1MPa)干燥,得虫草粗多糖。1.2.2 树脂预处理 8种树脂经无水乙醇浸泡过夜后,按表1进行预处理。
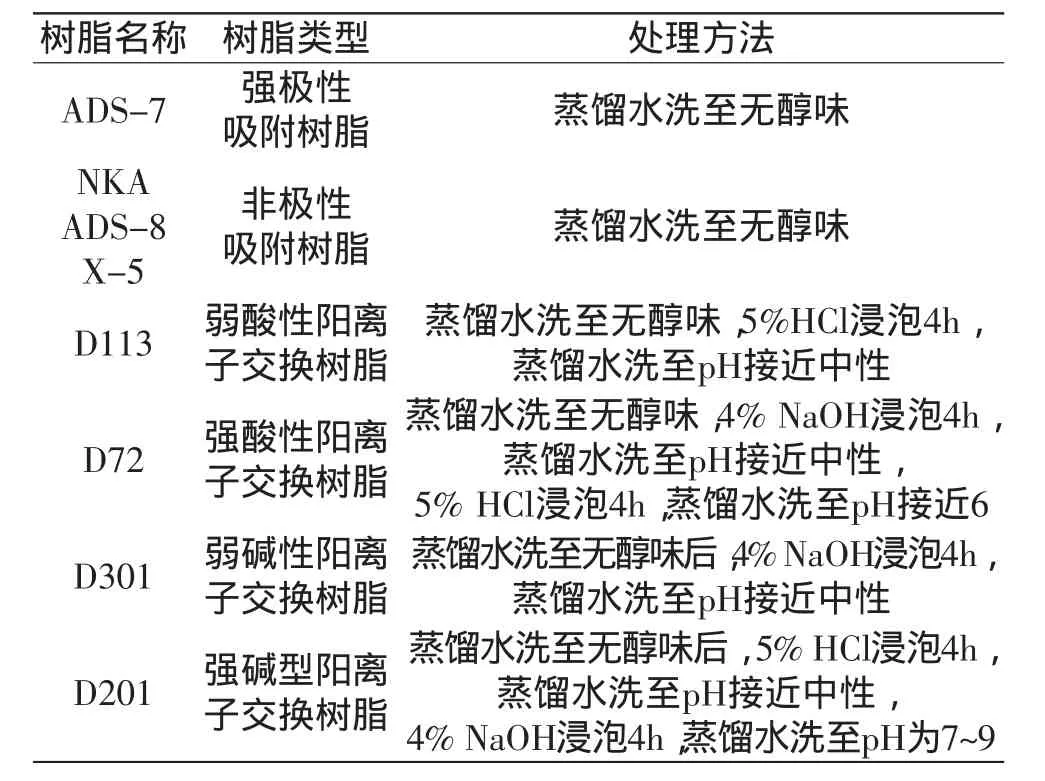
表1 树脂处理方法Table 1 Pretreatment methods for different resins
1.2.3 脱色率的测定 将虫草粗多糖配制为7mg/mL溶液,对其进行全波长扫描,结果表明,该溶液无最大吸收波长。由互补色原理可知,溶液呈现的颜色是其吸收光的互补色。由于虫草粗多糖溶液为橙黄色,故该溶液主要吸收蓝色波段可见光。因此对450~ 530nm波长范围内每隔10nm测定脱色率,计算脱色率平均值,以脱色率最接近该平均值的470nm作为测定波长,并按式(1)计算脱色率:

式中:X1为脱色率,A0、At分别表征吸附前后溶液的吸光度。
1.2.4 脱蛋白率的测定 粗多糖溶液中蛋白质的测定采用Bradford法[7]。为消除待测液pH对显色的影响,测定前调节粗多糖溶液pH为6.5,并按式(2)计算脱蛋白率:

式中:X2为脱蛋白率,C0、Ct分别表征吸附前后溶液中的蛋白质浓度。
1.2.5 多糖保留率的测定 粗糖溶液中多糖的测定采用苯酚-硫酸法[8]。为消除待测液pH对显色的影响,测定前调节粗糖溶液pH为6.5,并按式(3)计算多糖保留率:

X3为吸附结束后溶液中多糖的保留率,C0′,Ct′分别表征吸附前后溶液中多糖的浓度。
1.2.6 综合吸附效应指数的计算 整合分析(metaanalysis)是对同一主题下多个独立实验结果进行综合的统计学方法,被认为是目前最好的数量综合方法,其统计量为效应值[9]。为客观评价脱色脱蛋白方法的有效性,引入综合吸附效应指数ζ(0≤ζ≤1),其物理意义为树脂的脱色率、脱蛋白率以及多糖保留率的加权和。为一个无量纲的值,其值越大表明树脂的综合处理能力越好。其计算方法如下:

式中:ζi为树脂的综合吸附效应指数;xij为树脂的脱色率(j=1)、脱蛋白率(j=2)、多糖保留率(j=3)实验数据;w1、w2、w3分别表示脱色、脱蛋白、多糖保留能力的权重,由于本研究旨在考察树脂对多糖溶液的脱色及脱蛋白能力,但需兼顾处理方法对多糖的保留能力,故依重要性设定其值依次为0.4、0.4、0.2。
1.2.7 数据处理与分析 所有实验均重复三次或以上,实验数据以平均值±标准差表示,ζ值由实验数据的平均值计算得到,数据处理软件为SPSS 17.0,作图软件为OriginPro 8.0。
2 结果与讨论
2.1 不同树脂的处理性能
取预处理后的ADS-7、NKA、D113、D72、D301、D201、ADS-8、X-5各5mL,按体积比1∶5加入浓度为7mg/mL的虫草粗多糖溶液,置于恒温振荡器(30℃,80r/min)中,2h后取样测定相应的脱色率、脱蛋白率、多糖保留率,并计算ζ值,结果如表2所示。
多独立样本的Kruskal-Waillis分析结果显示,树脂种类对脱色率、脱蛋白率及多糖保留率的影响均非常显著(P值均<0.05)。且D113的脱色能力优于ADS-8、D301、D72、X-5、NKA(P<0.05);D113的脱蛋白能力显著优于D201、D301、D72、X-5(P<0.05);ADS-7对色素、蛋白质的吸附效果与D113无显著差异(P>0.05),但ADS-7的多糖保留率显著低于D113(P<0.05)。依据ζ值大小,各种树脂的综合处理效果优劣顺序为:D113>ADS-7>ADS-8>D201/NKA>X-5>D301>D72。故选取D113弱酸性阳离子树脂进行进一步实验。

表2 八种树脂对虫草粗多糖溶液的处理效果Table 2 Treatment effects of eight resins on crude Cordyceps polysaccharides
2.2 D113树脂的静态吸附性能
2.2.1 处理量的选择 定义每毫升树脂处理粗多糖的毫克数为树脂处理量(mg/mL),应该选择综合吸附效应指数较大时的最大处理量。分别向5mL处理后的D113湿树脂中加入初始浓度为1.6、2.8、4.2、5.6、7.2mg/mL的虫草粗多糖25mL(处理量依次为8、14、21、28、36mg/mL),置于30℃,80r/min恒温振荡器中,2h后取样测定,结果如图1所示。

图1 处理量对D113树脂处理效果的影响Fig.1 Effect of loading capacity on the treatment performance of D113
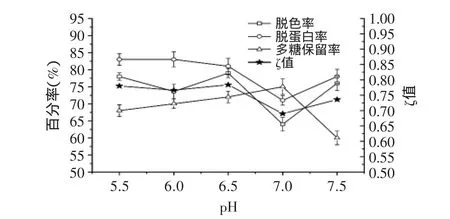
图2 pH对D113树脂处理效果的影响Fig.2 Effect of pH on the treatment performance of D113
随处理量增加,树脂的脱色、脱蛋白效果呈线性降低;相反,其多糖保留率呈线性增加的趋势。综合吸附效应指数ζ的变化更加直观地反映了树脂处理效果随处理量增加而逐渐降低的趋势。当处理量为8mg/mL时,ζ值最大,但当处理量增加到14mg/mL时,ζ值变化不大。考虑到树脂的利用率问题,处理量应控制为14mg/mL,这样既能达到较好的脱色脱蛋白效果,又使得树脂具有较高利用率。因此,后续静态吸附实验中将粗多糖溶液的浓度确定为与之相对应的2.8mg/mL,上样体积为柱体积的5倍。
2.2.2 pH的选择 pH通过影响糖液中色素、多糖以及蛋白质的解离状态而影响其与树脂的吸附作用,因而,有必要考察pH对D113树脂处理效果的影响。分别向5mL预处理后的D113湿树脂加入pH为5.5、6.0、6.5、7.0、7.5的虫草粗多糖溶液(2.8mg/mL)25mL,使树脂处理量为14mg/mL,置于30℃,80r/min恒温振荡器中处理2h,结果如图2所示。
结果显示,溶液酸碱度对树脂的吸附行为有较大影响。当糖液pH为7.0时,树脂对蛋白质和色素的吸附能力显著降低,其原因可能是中性条件下不利于多糖蛋白质及色素分子的解离,从而影响其与弱酸性离子交换树脂D113的结合效率。pH除影响树脂对色素分子的吸附能力以外,还可能对色素分子的结构产生影响。当pH=6.5时综合吸附效应指数ζ最高,表明该pH条件下,树脂D113对蛋白质及色素的吸附能力较强,而对多糖的吸附能力较弱。通过测定,粗糖液的初始pH为6.5,因此虫草粗多糖在用树脂吸附前不需调整pH。
2.2.3 处理时间的选择 分别向5mL预处理后的D113湿树脂加入初始浓度为2.8mg/mL虫草粗多糖25mL,置于30℃,80r/min恒温振荡器中,每隔30min取样测定,实验结果见图3。

图3 不同脱色时间对D113树脂处理效果的影响Fig.3 Effect of treatment time on the treatment performance of D113
结果表明,处理90min时,树脂的综合吸附效应指数达到最高,延长处理时间不但对脱色脱蛋白效果贡献不大,而且使溶液中多糖保留率不断降低。故处理时间应控制在90min,此时脱色率达79.5%±1.7%,脱蛋白率为82.2%±1.7%,多糖保留率为75.0%±1.8%。
2.3 D113树脂的动态吸附实验
2.3.1 上柱流速对树脂动态吸附性能的影响 称取预处理后的湿树脂,湿法装柱至柱床体积(BV)为15mL。配制2.8mg/mL的虫草粗多糖溶液,分别以1.5、2.5、3.5BV/h流速在同一实验条件下进行动态吸附,测定每BV流出液的即时脱色率、脱蛋白率及多糖保留率,并计算ζ值。为更好地描述上柱流速对树脂动态吸附性能的影响,在上样初始阶段还测定了0.5BV时的ζ值。分别以流出液的BV数及相应的ζ值为横纵坐标作如图4所示动态洗脱曲线。
实验结果表明,随上柱流速增加,相同处理容量下树脂的综合吸附效应指数减小,表明处理效果不断降低。当上柱流速为1.5BV/h时,树脂在处理容量为3BV时ζ值降低显著,表明该点为该条件下的渗漏点,由此计算得到粗多糖及树脂的比值应为8.4mg/mL。而2.5BV/h及3.5BV/h的上柱流速下ζ值在2BV时即出现渗漏现象。这是由于流速慢有利于色素及蛋白质在树脂上进行粒扩散和膜扩散,从而与树脂内部进行离子交换,树脂利用率较大,脱色脱蛋白效果较好。而当流速较大时,溶液与树脂接触的时间较短,色素不能充分进行扩散就流出树脂床,当树脂表面的可交换离子被交换后,树脂工作吸附量下降,“穿透”现象出现较早,树脂处理性能降低。

图4 上柱流速对树脂动态吸附性能的影响Fig.4 Effect of flow rate on the dynamic absorption performance of resin
2.3.2 径高比对树脂动态吸附性能的影响 取不同体积湿树脂湿法装柱,使其径高比分别为1∶5、1∶10、1∶15和1∶20。取2.8mg/mL粗多糖溶液,按8.4mg/mL的树脂处理量以1.5BV/h流速进行上柱,检测洗脱结束时脱色率、脱蛋白率、多糖保留率,并计算ζ值,结果见图5。

图5 径高比对树脂动态吸附性能的影响Fig.5 Effect of ratio of diameter to height on the dynamic absorption performance of resin
结果表明,随径高比增大,ζ值增大,并在1∶15时达到平衡,因此径高比确定为1∶15较为合适,此时脱色率为85.1%±1.9%,脱蛋白率为85.0%±2.0%,多糖保留率为80.2%±2.2%。
2.4 D113树脂再生条件的选择

表3 不同再生溶剂的再生效果比较Table 3 Comparison of different regenerate solutions on the regenerate effect
为提高树脂利用率,需要对树脂进行再生。分别向盛有5mL已吸附平衡D113树脂的三角瓶中加入1mol/L HCl、1mol/L NaOH、30%乙醇、50%乙醇和50%乙醇配制的1mol/L HCl各25mL。置于30℃,80r/min恒温振荡器中,12h后取样分别测定溶液在470nm处的吸光度值以及溶液经考马斯亮蓝测蛋白反应后在595nm处的吸光度值,二者值越高表明洗脱液中的色素及蛋白质含量越高,再生溶剂的效果越好。表3结果显示,酸液的再生效果较碱液及乙醇溶液好,其中以50%乙醇配制的1mol/L盐酸溶液对色素及蛋白的洗脱效果最佳。
室温25℃下,以50%乙醇盐酸溶液作为再生溶剂,以12BV/h的流速对已吸附饱和的树脂(柱体积为25mL)进行动态解析实验,初始10min内每2.5min测定一次洗脱液在470nm处的吸光度值,之后每5min测定一次洗脱液吸光度值,结果如图6所示。
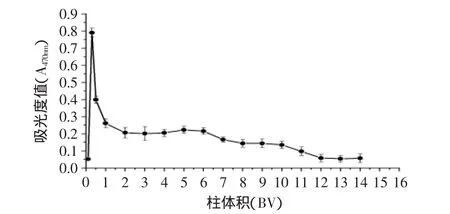
图6 D113树脂的再生洗脱曲线Fig.6 Regenerate curve of D113
洗脱1h后,洗脱液色泽接近无色,再生后的树脂呈米白色。以再生后的树脂进行脱色实验,流速为1.5BV/h,处理量为3BV时,脱色率为79.2%±1.8%,脱蛋白率为81.0%±1.2%,多糖保留率为75.2%±1.4%,说明树脂再生后脱色性能变化不大,树脂再生性能良好。
3 结论
D113树脂对虫草粗多糖溶液具有理想的脱色、脱蛋白效果。静态吸附实验表明:30℃,处理容量为14mg/mL,糖液pH为6.5,静态吸附平衡1.5h时,树脂对糖液的脱色率可达79.5%±1.7%,脱蛋白率达82.2%±1.7%,多糖保留率达75.0%±1.8%。上柱流速及径高比对树脂的动态吸附均有一定影响,流速为1.5BV/h,柱床径高比为1∶15条件下,当树脂处理量为8.4mg/mL时,D113树脂对粗多糖溶液的脱色率为85.1%±1.9%,脱蛋白率为85.0%±2.0%,多糖保留率为80.2%±2.2%。以50%乙醇盐酸溶液以12BV/h流速洗脱1h后,树脂再生性能良好。
[1]Zhu JS,Halpern MG,Jones K.The scientific rediscovery of an ancient Chinese herbal medicine:Cordyceps sinensis part I[J]. The Journal of Alternative and Complementary Medicine,1998,4(3):289-303.
[2]王普,郑明,何军邀,等.虫草多糖的化学结构及药理活性研究进展[J].浙江工业大学学报,2010,38(2):130-133.
[3]Wang Y,Yin HP,Lv XB,et al.Protection of chronic renal failure by a polysaccharide from Cordyceps sinensis[J].Fitoterapia,2010,81(5):397-402.
[4]Chen WX,Zhang WY,Shen WB,et al.Effects of the acid polysaccharide fraction isolated from a cultivated Cordyceps sinensis on macrophages in vitro[J].Cellular Immunology,2010,262(1):69-74.
[5]He YH,Sun LX,Cao XQ.Decolorization of crude Tussilago farfara L.polysaccharide by resins[J].Advanced Materials Research, 2011,236:1054-1057.
[6]Mo SP,Wu QP,Zhang JM,et al.Comparison of decolourization methods for myeetes polysaccharide[J].Modern Food Science and Technology,2009,25(12):1461-1463.
[7]Bradford M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of proteindye binding[J].Anal Biochem,1976,72(7):248-254.
[8]张惟杰.糖复合物生化研究技术[M].杭州:浙江大学出版社,1994:16.
[9]郑凤英,彭少麟.整合分析中结合效应值和总异质性的介绍[J].生态科学,2004,23(3):249-252.
Simultaneous removal of pigment and protein in crude Cordyceps polysaccharide by resin
XIAO Jie1,2,YAO Ling-yun1,2,SUN Jian1,2,WANG Xiao-dong1,YUAN Xiao-fan1,ZHAO Bing1,*
(1.National Key Laboratory of Biochemical Engineering,Institute of Process Engineering,Chinese Academy of Sciences,Beijing 100190,China;2.Graduate University of Chinese Academy of Sciences,Beijing 100049,China)
The integrated absorption index was introduced to evaluate the decolourization,deprotein and polysaccharides retaining capacity of resins.The decolourization and deprotein effects of 8 resins upon crude Cordyceps polysaccharides solution were screened based on the index.The results showed that D113 resin had the best decolourization and deprotein effects.Under optimum static adsorption conditions,the decolorization rate,deprotein rate and recovery rate of polysaccharide were 79.5%±1.7%,82.2%±1.7%and 75.0%±1.8%,respectively.When the dynamic absorption capacity was 8.4mg/mL(the flow rate was 1.5BV/h,the ratio of diameter to height of the resin column was 1∶15),the decolorization rate,deprotein rate and recovery rate of polysaccharide were 85.1%±1.9%,85.0%±2.0%and 80.2%±2.2%,respectively.When eluted by 1mol/L HCl(prepared by 50%ethanol solution)at the flow rate of 12BV/h for 1h,the resin was regenerated completely.
crude Cordyceps polysaccharide;resin;decolourization;deprotein
TS201.1
B
1002-0306(2012)07-0236-05
2011-06-03 *通讯联系人
肖杰(1985-),女,硕士研究生,研究方向:天然产物提取与分离。
西部行动计划高新技术项目(KGCX2-YW-509)。
