妊娠山羊腺垂体中ER与PRL、FSH和LH 的共存性研究
2012-09-26熊东升吕颜枝代盈盈王文丽赵慧英
熊东升,吕颜枝,2,代盈盈,王文丽,赵慧英*
(1.西北农林科技大学动物医学院,陕西杨凌712100;2.徐州生物工程职业技术学院,江苏徐州221006)
雌激素是下丘脑-垂体-性腺轴中影响动物生殖活动的重要激素之一,其主要通过雌激素受体(estrogen receptor,ER)调节靶细胞,ER 包括 ERα和ERβ两种经典亚型。腺垂体通过分泌多种激素如催乳素(prolactin,PRL)和促性腺激素(包括促卵泡素(follicle-stimulating hormone,FSH)和黄体生成素(luteinizing hormone,LH)等调节机体生殖相关内分泌活动,雌激素对这些激素的分泌具有反馈调节作用。有研究表明[1-2],妊娠大鼠腺垂体中有大量ER阳性细胞,其表达量随着妊娠进行而增加;RTPCR定量分析发现,在妊娠中期ERαm RNA表达有一个显著的高峰,但ERα蛋白水平表达恒定,ERβ在妊娠期的表达没有发生变化,与雌激素的水平不相关。雌激素可通过ER的介导来调节下丘脑促性腺激素释放激素(Gn RH)的刺激作用,进而调节FSH和LH的分泌;另外,雌激素还促进PRL的合成、储存和释放,为产后泌乳做好准备[3-4]。朱雨岚等[5]用双标记的方法对人类多激素型垂体腺瘤的研究中证明了ER在垂体的PRL、FSH和LH分泌细胞中表达。但目前对于妊娠期山羊腺垂体中ERα和ERβ与激素分泌细胞的共存研究尚未见报道。本试验用免疫组化双标记法对腺垂体中ERα和ERβ与PRL、FSH和LH的共表达进行研究,为阐明妊娠期山羊的生殖内分泌调节提供基础资料。
1 材料与方法
1.1 材料
1.1.1 试验用动物 妊娠前期(1 d~30 d)、中期(31 d~120 d)、后期(121 d~150 d)山羊各5只,购自杨凌农户。
1.1.2 主要试剂和仪器 抗兔免疫组织化学Max-Vision超敏试剂盒、兔抗羊PRL多克隆抗体、棕色DAB染色试剂盒,购自福州迈新生物技术开发有限公司;兔抗羊(ERα、ERβ、FSH、LH)多克隆抗体,购自北京博奥森生物技术开发有限公司;蓝色DAB显色剂、葡萄糖过氧化物酶,购自美国SIGMA公司;德国Leica石蜡切片机;Motic显微照相机;江苏捷达科技形态学分析软件。
1.2 方法
1.2.1 取材及材料处理 山羊经放血致死后迅速取下羊头,先用37℃的生理盐水向两侧颈总动脉同时注入400 mL~500 mL冲去残血,随后灌注等量4℃的40 g/L多聚甲醛固定液。开颅取出垂体后固定24 h。固定后自来水冲洗24 h,再酒精脱水,二甲苯透明后浸蜡包埋,最后做石蜡连续切片(6μm)。
1.2.2 免疫组织化双标记法染色法程序 切片经脱蜡复水和抗原修复后做双标染色:①滴加30 mL/L过氧化氢,室温10 min;②滴加ERα和ERβ多克隆抗体之一(1∶200)室温下孵育60 min;③滴加Max Vision试剂室温下孵育10 min~15 min;棕色DAB呈色;④25 g/L高锰酸钾-50 mL/L硫酸洗脱液洗脱5 min,灭活ER剩余抗体活性,再用5 g/L焦亚硫酸钠还原30 s。⑤滴加第二种一抗PRL、FSH 和LH 之一(1∶200)室温下孵育60 min;⑥滴加Max Vision试剂室温下孵育10 min~15 min;蓝色DAB呈色,以上各步之间均用0.01 mol/L PBS缓冲液冲洗。最后常规脱水、透明、封片。阴性对照试验用0.01 mol/L PBS代替两种一抗,其他步骤相同。最后观察结果,显微照相及用江苏捷达科技形态学分析软件分析。
2 结果
2.1 免疫组化双标染色的结果
经免疫组织化学双标记法染色的切片,ERα或ERβ免疫阳性产物为棕褐色;PRL、FSH和LH免疫阳性产物为蓝色;双标记则为棕黑色。
2.1.1 妊娠各期ERα与3种激素的共存 在妊娠前期ERα与PRL共同着色的细胞数量较少,多呈椭圆形,ERα多存在于PRL细胞的胞质中,胞核中少见着双色,背景呈浅蓝色(图1A1);妊娠中后期着蓝色较深的PRL阳性细胞较多,着棕色的ERα阳性细胞散在于PRL阳性细胞之间,仅少量的双着色细胞膜(图1A2、图1A3)。妊娠前期ERα与FSH共同着色的细胞数量较多,多数存在于血窦周围呈椭圆形或多边形,胞质重合着色较深,其他区域细胞可见胞膜着双色,背景呈浅棕色,妊娠前期和中期ERα和FSH共存于腺垂体细胞的胞质和胞膜中(图1B1、图1B2);后期多在胞质中共存(图1B3);妊娠前期和中期ERα与LH共同着色位置在细胞的胞质中(图1 C1、图1C2);妊娠后期可见胞膜着双色,还可见着棕色的ERα颗粒(图1C3)。
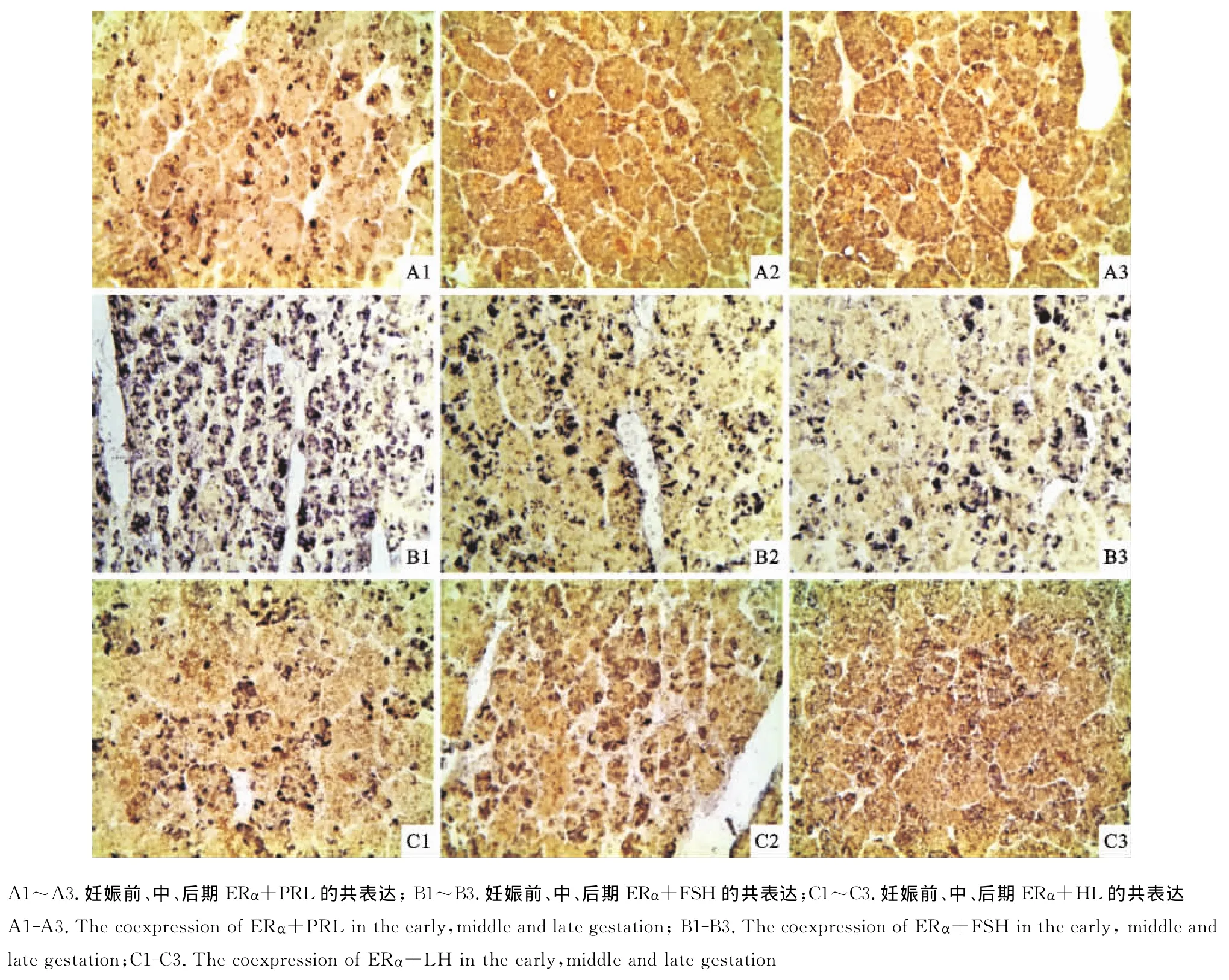
图1 山羊妊娠各期ERα和与PRL、FSH和LH在垂体中的免疫组化双标染色(400×)Fig.1 The immunohistochemical double labeled stain of ERαwith PRL,FSH,LH in pituitary of different gestation periods in goats(400×)
2.1.2 妊娠各期ERβ与3种激素的共存 ERβ和PRL的共存的细胞个体较小呈胞质深着色,夹杂在浅蓝色的PRL阳性细胞之间,数量在整个妊娠过程中有逐渐增多的现象,ERβ多数存在于PRL细胞的胞质中,少数存在于胞核中(图2A1、A2、A3)。妊娠过程中ERβ与FSH的共同着色细胞多为腺垂体远侧部的嗜碱粒细胞,形状与ERα和FSH共存的细胞相似,阳性物质多存在于胞质和胞核,未见有胞膜着色的,数量也呈减少趋势(图2B1、B2、B3)。在妊娠后期有个别全细胞着色(图2 B3)。妊娠前期和中期ERβ与LH的共同着色细胞为腺垂体远侧部的嗜碱粒细胞,阳性物质呈多边形(图2C1、C2),数量随妊娠的进行逐渐增多。在妊娠后期阳性细胞在胞质和核膜均有ERβ和LH的共存,未见核着色(图2C3)。
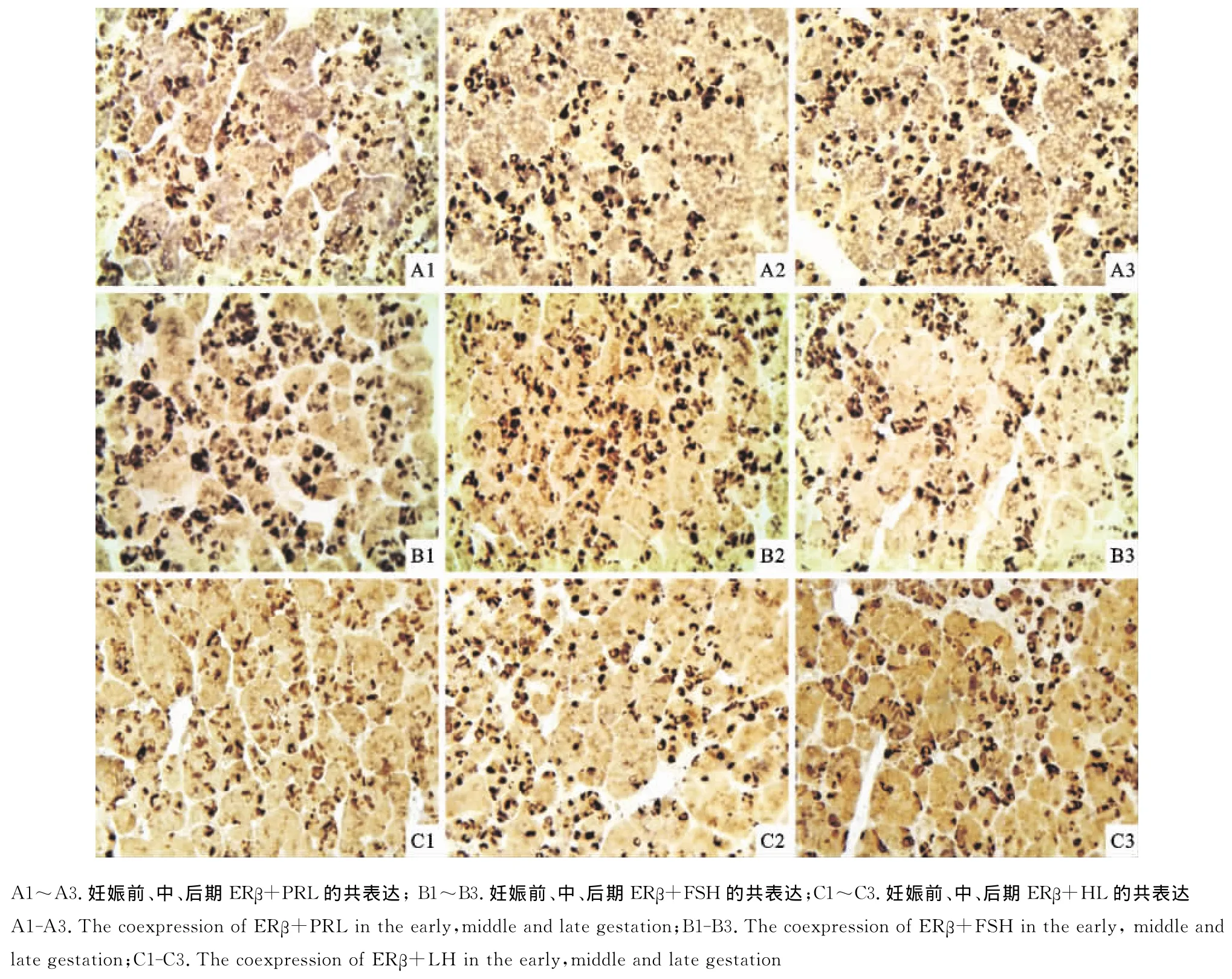
图2 山羊妊娠各期ERβ与PRL、FSH和LH在垂体中的免疫组化双标染色(400×)Fig.2 The immunohistochemical double labeled stain of ERβwith PRL,FSH,LH in pituitary of different gestation periods in goats(400×)
2.2 妊娠各期ER与腺垂体中3种激素共存细胞的数量
免疫组化双标染色结果显示,ERα和ERβ分别与PRL、FSH和LH共存的阳性细胞数量有一定变化趋势,表现为ERα和ERβ分别与PRL和LH共存的阳性细胞的数量随妊娠进行逐渐增加;与FSH共存的阳性细胞数量则逐渐减少(表1)。
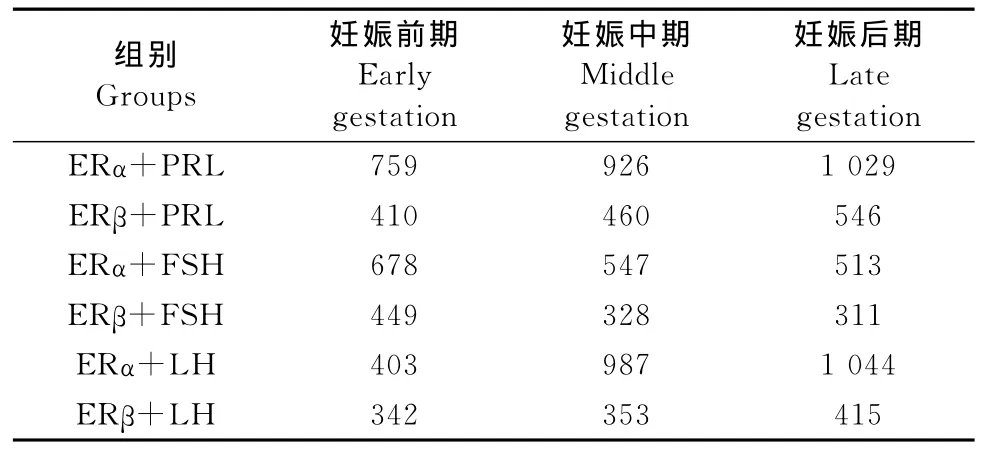
表1 妊娠期腺垂体中阳性细胞的数量Table1 The number of positive cells in adenohypophysis during pregnancy
3 讨 论
Gonza M等[6]研究大鼠垂体中ER两种亚型的分布,发现在大鼠整个发情期,ERα阳性产物均多数分布于PRL细胞,少数分布于FSH细胞,ERβ阳性产物仅有少数分布于PRL和FSH细胞;ERα的阳性产物存在于胞质及胞核,且与发情周期有关,ERβ的阳性产物多存在于胞质。本试验免疫组织化学染色显示,妊娠期山羊腺垂体ERα和ERβ均与PRL、FSH和LH有共存,主要共存于胞质中,也有少数在胞膜或胞核中共存,并随着妊娠的进行在细胞中分布位置发生变化。说明不同的动物不同的生理时期ERα和ERβ在细胞中的分布位置和存在细胞的类型也不一样。对绵羊垂体中ER的研究表明[7],妊娠145 d后绵羊垂体中ERα蛋白的表达较之前有很大的升高,但ERβ蛋白的表达与妊娠后80 d和120 d相比则是减少。研究表明[8],ER在分泌PRL和PRL细胞增生方面起重要作用,ER基因敲除小鼠PRL mRNA表达明显减少,PRL细胞数减少,而LH和FSH 细胞表达增加[9]。本试验结果表明ER与PRL和LH共存阳性细胞的数量表现为随妊娠的进行逐渐增加,与FSH的共存则相反,与该研究结构一致。胞浆内的ER具有运载雌激素的作用,胞核内的ER具有转录因子的作用[10-11],两种ER亚型均可以介导雌激素的作用[12-13],表明在妊娠期雌激素可能通过ERα和ERβ来作用于PRL、FSH和LH的分泌,但是以ERα对PRL和FSH的分泌调控为主,推测其主要目的是为产后泌乳做准备。
[1]杨永倩.ER和ICAM-1在妊娠早期和流产大鼠下丘脑、垂体、卵巢和子宫中的表达[D].陕西杨凌:西北农林科技大学,2008.
[2]Vaillant C,Chesnel F,Schausi D,et al.Expression of estrogen receptor subtypes in rat pituitary gland during pregnancy and lactation[J].Endocrinology,2002,143(11):4249-4258.
[3]Nett T M,Turzillo M,Baratta M,et al.Pituitary effects of steroid hormones on secretion of follicle-stimulating hormone and luteinizing hormone[J].Domest Anim Endocrinol,2002,23(12):33-42.
[4]Clarke I J,Cummins J T.Direct pituitary efects of estrogen and progesterone on gonadotropin secretion in the ovariectomized ewe[J].Neuroendocrinology,1984,39:267-274.
[5]朱雨岚,刘 伟,俞春江,等.雌激素受体在人类多激素型垂体腺瘤中的表达[J].哈尔滨医科大学学报,2004,38(5):429-434.
[6]González M,Reyes R,Damas C,et al.Oestrogen receptorα andβin female rat pituitary cells:An immunochemical study[J].Gene Compara Endocrinol,2008,155:857-868.
[7]Price R H,Butler C A,Webb P,et a1.A splice variant of estrogen receptor beta missing exon displays altered subnuclear localization and capacity fortranscriptional activation [J].Endocrinology,2006,142(5):2039-2049.
[8]Schaub C E,Gersting J A ,Maureen K W ,et al.Development of ER-αand ER-βexpression in the developing ovine brain and pituitary[J].Gene Expression Patterns,2008,8:457-463.
[9]Stefaneanu L.Pituitary sex steroid receptors:localization and function[J].Endocrine Pathology,1997,8:91-108.
[10]蔡 晶,曹治云,杜 建.雌激素受体的基因结构、组织分布及表达量的研究进展[J].中国老年学杂志,2007,27(24):2468-2470.
[11]Bulayeva N N,Wozniak A L,Lash L L,et al.Mechanisms of membrane estrogen receptor-alpha mediated rapid stimulation of Ca2+levels and prolactin release in apituitary cell line[J].Am J Physiol Endocrinol Metab,2005 ,288(2):388-397.
[12]Jensen E V,DeSombre E R,Estrogen-receptor interaction[J].Science,1973,182:126-134.
[13]Kuiper G G,Enmark E,Pelto-Huikko M,et al.Cloning of a novel estrogen receptor expressed in rat prostate and ovary[C].Proceedi Nation Aca Sci USA,1996,93:5925-5930.
