Cramp基因敲除对小鼠骨髓造血干细胞的影响
2012-09-17石桂英鞠振宇
石桂英,白 琳,鞠振宇
(中国医学科学院北京协和医学院实验动物研究所,卫生部人类疾病比较医学重点实验室,国家中医药管理局人类疾病动物模型三级实验室,北京 100021)
Cramp基因敲除对小鼠骨髓造血干细胞的影响
石桂英,白 琳,鞠振宇
(中国医学科学院北京协和医学院实验动物研究所,卫生部人类疾病比较医学重点实验室,国家中医药管理局人类疾病动物模型三级实验室,北京 100021)
目的 研究Cramp基因敲除在衰老过程中对小鼠造血干细胞的作用。方法 应用流式细胞仪分析3月龄及12月龄Cramp基因敲除小鼠及同窝野生型小鼠的骨髓造血干细胞的比例及不同发育阶段B淋巴细胞的比例。结果 与野生型小鼠相比,12月龄Cramp基因敲除小鼠的骨髓长期造血干细胞增多,多潜能造血祖细胞减少;前体B淋巴细胞和未成熟B淋巴细胞减少,成熟B淋巴细胞增多。结论 在衰老过程中,Cramp基因敲除对骨髓造血干细胞及B淋巴细胞发育有重要影响。
Cramp基因敲除小鼠;流式细胞术;骨髓造血干细胞;B淋巴细胞
小鼠 Cramp蛋白是由 Gallo等[1]首先分离鉴定的,该类蛋白与之前在人、猪、牛、兔、羊等动物中发现的抗菌肽前体,具有高度保守的区域即cathelin,因此,将这一大类抗菌肽命名为cathelicidins。目前已知其主要功能是抗菌活性,此外,还具有抑制组织损伤、促进创伤修复、结合内毒素、诱导血管生成等多种生物学功能。炎性衰老是目前国际衰老理论的研究热点[2-4],Cramp蛋白作为一种炎症因子,在老龄短端粒模型小鼠中高表达,而正常老龄野生型小鼠中其表达量未见明显升高[5],该蛋白在衰老中的作用值得深入研究。为了进一步研究Cramp蛋白在衰老中的作用,我们从德国引进了Cramp基因敲除小鼠,对不同月龄的Cramp基因敲除小鼠和同龄野生型小鼠的骨髓细胞,应用流式细胞仪分析了骨髓造血干细胞及不同发育阶段B细胞的的比例。
1 材料和方法
1.1 Cramp基因敲除小鼠
该小鼠由德国引进,在本所繁育【SCXK(京)2009-0007;SYXK(京)2011-0022】。动物饲养在SPF动物房内,分别在3月龄、12月龄时,脱颈椎处死小鼠进行实验。
1.2 PCR方法鉴定Cramp基因敲除小鼠的基因型
用2周龄小鼠尾尖提取基因组DNA,普通PCR鉴定基因型。反应条件:94℃预变性3 min;94℃ 30 s,60℃ 30 s,72℃ 30 s,35 个循环;72℃ 延伸 10 min。基因敲除小鼠的 PCR鉴定引物:CRAMP 1A:5'CCAGGGACTTCCATCCAGTAGAC 3',CRAMP 1B:5'AGACTGCCTTGGGAAAAGCG3',CRAMP2A:5'TGTTTTCTCAGATCCTTGGGAGC 3',CRAMP 2B:5'AATTTTCTTGAACCGAAAGGGC 3',PCR 产物长度,野生型为241 bp,CRAMP敲除为88 bp,杂合子同时有上述两条片段。引物由上海生物工程技术有限公司合成,PCR试剂购自宝生物工程有限公司。
1.3 流式分析
小鼠脱颈椎处死后,取后肢骨,置于冰上预冷的染色缓冲液(含1%BSA的PBS)中,用5mL注射器将骨髓细胞冲出,并吹打成细胞悬液,将细胞悬液用50 μm尼龙滤膜过滤后收集到15mL离心管中,用 PBS定容至 10mL,混匀后,取 10 μL细胞悬液,稀释10倍后计数细胞数。细胞悬液离心,1000 rpm,10 min,将细胞浓度调整为 1X108个细胞/mL。分别取106细胞标记荧光抗体(BD公司)。
骨髓造血干细胞的分析中用如下抗体进行标记:CD34-FITC、Flt3-PE、IL7R-Pcrcp-cy5.5、Sca1-PECy7、cKit-APC、Ter-119-Biotin、Gr-1-Biotin、Mac-1-Biotin、B220-Biotin、IL-7R-Biotin、CD4-Biotin、CD8-Biotin、Biotin-APC-Cy7。长期造血干细胞(LT-HSC)表面标记为 Lin-Sca1+cKit+CD34-Flt3-,短期造血干细 胞(ST-HSC)表面标记为 Lin-Sca1+cKit+CD34+Flt3-,多潜能造血祖细胞(MPP-HSC)表面标记为 Lin-Sca1+cKit+CD34+Flt3+。IgD-FITC、CD43-PE、B220-PE-Cy7、IgM-APC,标记不同发育阶段的B淋巴细胞。前体B细胞(Pre B)表面标记为B220+CD43-IgD-IgM-,未成熟 B细胞表面标记为B220+CD43-IgD-IgM+,成熟 B细胞表面标记为B220+CD43-IgD+IgM+。上述抗体加入细胞悬液,冰上避光,30 min;加1mL染色缓冲液,离心,2600 rpm,5 min,弃上清,加200 μL染色缓冲液重悬细胞,用50 μm尼龙滤膜过滤,冰上避光备用。
1.4 统计分析方法
数据分析采用SPSS13.0软件包进行统计分析,各组数据均采用±s表示。组间资料分析采用 t检验。以P<0.05表示差异有统计学意义。
2 结果
2.1 Cramp基因敲除小鼠基因型鉴定
为了建立Cramp基因敲除小鼠衰老研究队列,我们应用Cramp基因杂合小鼠配对繁殖,对子代小鼠进行基因型鉴定,保留Cramp基因敲除纯合及同窝野生型小鼠。基因型鉴定结果见图1。

图1 Cramp基因敲除小鼠基因型鉴定结果Fig.1 Genotyping of Cramp knockout mice
2.2 Cramp基因敲除对小鼠骨髓造血干细胞的影响
为了了解衰老过程中,Cramp基因敲除对小鼠骨髓造血干细胞的影响,我们分析了3月龄及12月龄Cramp基因敲除小鼠及同窝野生对照小鼠长期造血干细胞(LT-HSC)、短期造血干细胞(ST-HSC)、及多潜能造血祖细胞(MPP-HSC)的比例,结果发现与野生型小鼠相比,12月龄 Cramp基因敲除小鼠LT-HSC 显著减少(P=0.0025,图2A),MPP-HSC 显著增加(P=0.0073,图2B)。

图2 长期造血干细胞、多潜能造血祖细胞在骨髓LSK中的比例Fig.2 Percentage of LT-HSC、MPP-HSC in the bone marrow LSK cells
2.2 Cramp基因敲除对小鼠B淋巴细胞发育的影响
为了研究Cramp基因敲除在衰老过程中对小鼠B细胞发育的影响,我们分析了不同月龄Cramp基因敲除小鼠及同龄对照小鼠骨髓中不同发育阶段的B淋巴细胞的比较,结果显示,12月龄 Cramp基因敲除小鼠骨髓前体B淋巴细胞(P=0.02)和未成熟B淋巴细胞(P=0.0274)显著减少,而成熟 B淋巴细胞(P=0.0002)显著增加(图3)。?
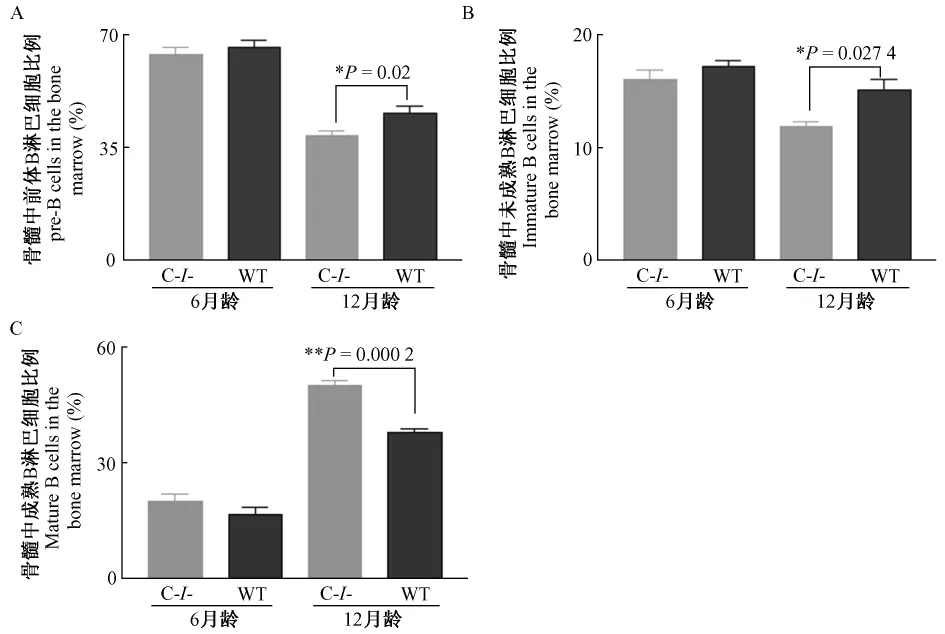
图3 Cramp基因敲除对小鼠B淋巴细胞发育的影响Fig.3 Influences of Cramp gene knockout on mice B lymphocytes development
3 讨论
随着人口老龄化,关于衰老的研究成为国际研究热点。衰老是全身系统性组织、器官功能退化,关于衰老已有多种假说,如端粒和端粒酶、炎性衰老等。已有研究发现,在端粒损伤衰老小鼠模型中,四种蛋白的表达量增加,其中包括 Cramp蛋白[4],在人类相关研究中也发现,随着年龄的增长,Cramp蛋白在人的血浆及各组织器官中的表达量增加,并且其表达量与端粒长度呈反比[6],上述研究均表明Cramp蛋白是衰老过程中的一个重要生物标记物。Cramp蛋白在衰老过程中究竟有何作用,对造血系统有没有影响,目前未见相关报道。
已有研究表明,在衰老过程中,小鼠骨髓造血干细胞数量增多,其中主要是增殖活化的造血干细胞数量增多[7,8,9]。但是,骨髓造血干细胞增殖活性提高,仅使造血干细胞数量增加,而不能增强其干细胞功能,生成淋巴细胞的能力降低,所以,老龄小鼠 B淋巴细胞及 T减少[7,8]。本研究发现随年龄增长,Cramp基因敲除后,骨髓长期造血干细胞(LTHSC)减少,而骨髓多潜能造血祖细胞(MPP-HSC)增多;同时,骨髓中前体B淋巴细胞和未成熟 B淋巴细胞减少,而成熟 B淋巴细胞增多。这说明Cramp基因在骨髓造血干细胞及B淋巴细胞发育及衰老中具有重要作用,其作用机制有待进一步深入研究。
[1]Gallo RL, Kim KJ, Bernfield M, et al. Identi fication of CRAMP,a cathelin-related antimicrobial peptide expressed in the embryonic and adult mouse[J].J Biol Chem.1997;272:13088-13093.
[2]Franceschi C.Inflammaging as a major characteristic of old people:can it be prevented or cured?[J].Nutrition reviews.[Review].2007;65:S173-176.
[3]Goto M.Inflammaging(inflammation+aging):A driving force for human aging based on an evolutionarily antagonistic pleiotropy theory?[J].Bioscience trends.[Review].2008;2:218-230.
[4]Navarrete-Reyes AP,Montana-Alvarez M.Inflammaging.Aging in flammatory origin[J]. Revista de investigacion clinica.[Review].2009;61:327-336.
[5]Jiang H,Schiffer E,Song Z,et al.Proteins induced by telomere dysfunction and DNA damage represent biomarkers of human aging and disease[J].Proceedings of the National Academy of Sciences of the United States of America.2008;105:11299-11304.
[6]Jiang H,Chen W,Qu L,et al.ELISA for aging biomarkers induced by telomere dysfunction in human plasma[J].Journal of biomedicine&biotechnology.2010;2010:121947.
[7]Rossi DJ,Bryder D,Zahn JM,Ahlenius H,Sonu R,Wagers AJ,et al.Cell intrinsic alterations underlie hematopoietic stem cell aging[J].Proceedings of the National Academy of Sciences of the United States of America 2005;102:9194-9.
[8]Sudo K,Ema H, Morita Y, NakauchiH.Age-associated characteristics of murine hematopoietic stem cells[J].Journal of Experimental Medicine 2000;192:1273-80.
[9]Chambers SM,Shaw CA,Gatza C,Fisk CJ,Donehower LA,Goodell MA.Aging hematopoietic stem cells decline in function and exhibit epigenetic dysregulation[J].PLoS Biology 2007;5:e201.
Influence of Cramp Knockout on the Function of Hematopoietic Stem Cell
SHI Gui-ying,BAI Lin,JU Zhen-yu
(Institute of Laboratory Animal Science,Chinese Academy of Medical Sciences& Peking Union Medical College,Key Laboratory of Human Disease Comparative Medicine,Ministry of Health,Key Laboratory of Human Diseases Animal Model,State Administration of Traditional Chinese Medicine,Beijing 100021,China)
Objective To study the influence of Cramp gene knockout on the function of hematopoietic stem cell in aging.Methods Cells from the bone marrow of different age Cramp knockout and wild type mice were analyzed by flow cytometry.Results Compared with 12 months old wild type mice,percentage of long term hematopoietic stem cell decreased,multipotent hematopoietic progenitor increased;percentages of pre B and immature B cells decreased,and mature B cells increased in Cramp knockout mice.Conclusion Cramp gene knockout plays an important role in hematopoietic stem cell and the development of B lymphocytes in aging.
Cramp knockout mouse;Flow cytometry;Hematopoietic stem cell;B lymphocyte
R332
A
1671-7856(2012)09-0013-03
10.3969.j.issn.1671.7856.2012.009.003
2012-08-25
中央级公益性科研院所基本科研业务费(DWS201010)。
石桂英,女,主管技师,研究方向:衰老与再生。
鞠振宇,E-mail:zhenyuju@hotmail.com。
