鼠棒状杆菌PCR检测方法的建立及其应用
2012-09-17唐连飞周智君蔡婧怡俞远京苏志杰
唐连飞,周智君,蔡婧怡,孟 芳,魏 颖,俞远京,苏志杰
(1.湖南出入境检验检疫局,长沙 410004;2.中南大学湘雅医学院实验动物学部,长沙 410008)
鼠棒状杆菌PCR检测方法的建立及其应用
唐连飞1,周智君2,蔡婧怡1,孟 芳1,魏 颖1,俞远京2,苏志杰2
(1.湖南出入境检验检疫局,长沙 410004;2.中南大学湘雅医学院实验动物学部,长沙 410008)
目的 建立鼠棒状杆菌PCR检测方法并应用于临床样本检测。方法 用脑心浸出液培养基复苏、培养鼠棒状杆菌(corynebacterium kutscheri,C.kutscheri)并提取基因组DNA作模板;根据GenBank中C.kutscheri的16S基因序列设计合成引物,建立鼠棒状杆菌PCR检测方法并进行敏感性和特异性的评价;人工感染昆明鼠,建立小鼠棒状杆菌感染模型,采集肝脏和肾脏,提取DNA进行检测。结果 成功建立了鼠棒状杆菌PCR检测方法,该方法可检测到100个阳性质粒;对小鼠沙门氏菌、肺炎链球菌和巴氏杆菌无交叉反应;全部8个人工感染样本全部检测为阳性。结论 建立的鼠棒状杆菌PCR检测方法灵敏度高、特异性好,可作为鼠棒状杆菌感染的快速检测方法。
鼠棒状杆菌;PCR检测方法;16S核糖体RNA
棒状杆菌属细菌是一种人畜共患的多种型传染病病原菌。鼠棒状杆菌病呈世界性分布,特别是在常规鼠群中,隐性感染非常普遍,发病率和死亡率高,暴发流行时可导致动物群覆没,在实验动物的病原菌控制中是小鼠和大鼠病原菌必检项目。目前国内外对鼠棒状杆菌的检测研究很少,主要进行病菌分离培养[1-4],国家标准 GB/T14926.9-2001规定也是进行病菌分离培养[5],还有进行血清学检测的报道[6-7]。这些方法操作复杂、时间长、灵敏度低,容易造成漏检。本实验采用PCR技术,根据GenBank发表的鼠棒状杆菌16S rRNA基因,设计了特异性引物,建立了准确、快速检测鼠棒状杆菌PCR方法,并能很好地应用于临床样本的检测。
1 材料和方法
1.1 菌株、培养基和培养条件
鼠棒状杆菌标准菌株(C.kutscheri,ATCC 11306),购于美国模式菌种收集中心,小鼠肺炎链球菌、沙门菌和巴氏杆菌由湖南出入境检验检疫局保存。用脑心浸出液对C.kutscheri菌种进行复苏、传代和液体培养。细菌用250mL锥形瓶于37℃、200 rpm恒温振荡培养。
1.2 细菌DNA提取
取10mL过夜培养液5000 rpm离心10 min,去上清液。加1mL TE悬浮沉淀,并加0.1mL 20%SDS,50 μL 10mg/mL蛋白酶 K,混匀,55℃孵育1 h。加 0.2mL 5 mol/L NaCl,0.2mL CTAB/NaCl溶液,混匀,65℃孵育20 min。加入等体积酚∶氯仿∶异戊醇(25∶24∶1),12000 rpm 离心 10 min,将上清液移至干净离心管。用等体积氯仿:异戊醇(24∶1)再抽提一次,取上清液移至干净管中。加1倍体积异丙醇,颠倒混合,室温下静止10 min。12000 rpm离心10 min,弃上清。70%乙醇漂洗后,吸干,溶解于0.1mLTE,-20℃保存备用。
1.3 引物设计与PCR反应
根据表1中C.kutscheri 16S rRNA基因序列,利用Primer Express 3引物设计软件来设计引物,宝生物(大连)有限公司合成。引物和序列如下:上游引物:GCAACGCGAAGAACCTTACC,下游引物:CCCG GCAGTCTCTCATGAGT,扩增片段大小为200 bp。

表1 引物和探针设计时所参照的菌株Tab.1 Strains used for designing primers and probe for C.kutscheri detection
1.4 PCR扩增体系及退火温度筛选
采用 GoTaq®Green Master Mix(promega)PCR试剂盒,体系如下:
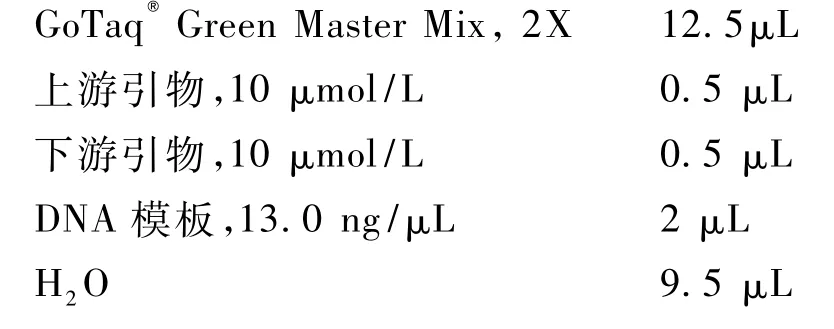
扩增条件为:94℃ 预变性5 min;按以下条件进行 30 个循环扩增:94℃ 40 s,48℃~56℃ 40 s,72℃40 s;最后 72℃延伸 5 min。温度梯度 PCR仪为Biometra TGradient。
1.5 阳性定量标准模板的制备
1.5.1 模板扩增:按 1.4对提取的 C.kutscheri ATCC 11306 DNA进行常规PCR扩增,退火温度选择1.4中最佳退火温度。
1.5.2 PCR产物纯化和克隆:将 PCR产物用TaKaRa(大连)公司DNA纯化试剂盒纯化并连接到pGEM®-T Easy载体(Promega)上,转化至感受态JM109。经LB/氨苄/IPTG/X-Gal平板蓝白筛选后挑取重组成功的白色菌落进行培养,用TaKaRa(大连)公司小批量质粒DNA纯化试剂盒进行质粒提取。
1.5.3 重组质粒鉴定:以质粒为模板,进行PCR扩增鉴定是否重组成功。
1.6 方法敏感性的分析 测定提取质粒的浓度,计算每微升质粒中的分子数。将质粒稀释使其在2μL 中分别含有 1×106、1×105、1×104、1×103、1×102、101拷贝数。按1.4进行PCR扩增,退火温度选择1.4中最佳退火温度。
1.7 方法的特异性分析 按1.4方法以C.kutscheri、小鼠肺炎链球菌、小鼠沙门菌和巴氏杆菌的DNA为模板,确定方法的特异性。
1.8 鼠棒状杆菌感染模型建立及样本采集 按每只5×106个细菌量通过腹腔注射方法分别感染4只SPF级昆明小鼠,发病后采集肝脏和肾脏,按标准[5]进行分离培养和常规方法提取组织 DNA。SPF级昆明小鼠来源于湖南斯莱克景达实验动物有限公司(SCXK(湘)2011-0003),体重为 18~22g,在中南大学实验动物学部进行实验(SYXK(湘)2011-0001)。
2 结果
2.1 PCR扩增和退火温度的筛选 以C.kutscheri(ATCC11036)DNA为模板,采用48℃~56℃的退火温度,成功扩增出与预期大小一致的200 bp的条带;在不同退火温度(55.2、54.3、53.4、52.4、51.5、50.5、49.6、48.7)下均能扩增出目的条带,但在以54.3℃最好(图1),因此选择54℃作为本方法的最佳退火温度。
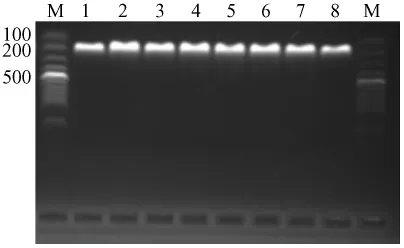
图1 温度梯度PCR扩增Fig.1 Temperature gradient PCR amplification
2.2 重组质粒的鉴定 以重组质粒为模板进行PCR扩增,1.5%琼脂糖凝胶电泳。结果显示产物大小与目的插入片段大小一致,重组成功(图2)。

图2 重组质粒PCR鉴定Fig.2 Identification of the recombined plasmid
2.3 不同模板拷贝数的PCR扩增 在反应体系中分别加入、1×104、1×103、1×102、1× 101、1× 100拷贝数的质粒时,1×104、1×103、1×102可见特异性产物,显示本方法检测低限为1×102拷贝(图3)。
2.4 检测方法的特异性分析 利用建立的方法对小鼠沙门菌、肺炎链球菌和巴氏杆菌DNA进行检测,结果显示方法对小鼠沙门菌、肺炎链球菌和巴氏杆菌无交叉反应,未出现扩增条带,只检测出鼠棒状杆菌(图4)。
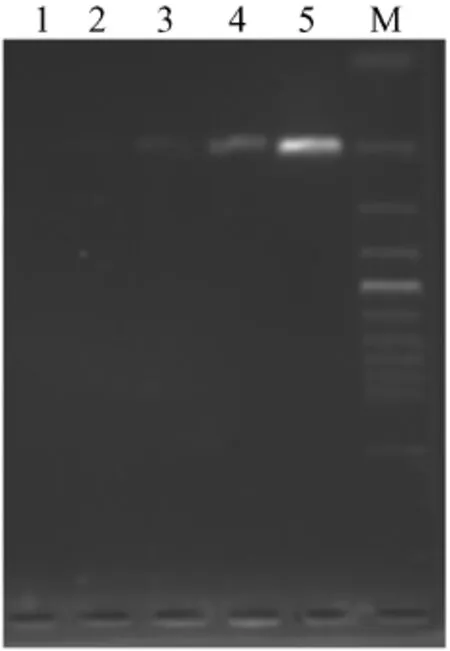
图3 不同模板拷贝数的PCR扩增Fig.3 PCR amplification of different copies of the target gene
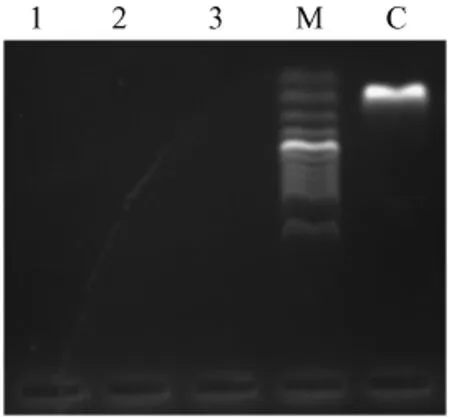
图4 方法的特异性检测Fig.4 Results of specificity test
2.5 小鼠棒状杆菌模感染型建立及样本采集和检测 小鼠注射7 d后全部发病,出现被毛逆立,精神萎靡不振,12 d时全部死亡,小鼠肝脏和肾脏出现化脓性坏死灶。取死亡小鼠的肝脏和肾脏病灶进行细菌分离培养和PCR方法检测均为阳性。
3 讨论
目前鼠棒状杆菌的检测主要包括2种方法:分离鉴定和血清学检测[1-7],还没有利用分子生物学技术检测的研究报道。与细菌分离鉴定和血清学检测相比,PCR方法具有操作简单、特异性强、灵敏度高和检测时间短等优点。本研究根据鼠棒状杆菌16S rRNA的核酸序列,设计的引物能特异性的扩增出大小200 bp的DNA条带(图1),而对小鼠沙门氏菌、肺炎链球菌和巴氏杆菌无交叉反应(图4);以重组质粒为模板进行灵敏度试验的结果表明建立的方法体系能够检测到100个拷贝的模板DNA,具有较高的敏感性。通过对试验感染样本的检测,8个样本全部为阳性,显示本方法可以很好的应用与临床病变组织样本的检测。
16S rRNA基因在其碱基组成、核苷酸序列、高级结构及生物功能等方面表现出进化上的高度保守性,被广泛用于物种的分类鉴定和系统发育的研究工作中[8],本研究利用鼠棒状杆菌的16S rRNA基因对其进行检测鉴定。
鼠棒状杆菌能在机体抵抗力下降时导致大鼠和小鼠发病甚至死亡,也影响实验结果的解释及评价,因此在实验动物微生物等级及监测中是大鼠和小鼠的必检项目,必须为阴性[9]。常规的检测方法都是从气管分泌物和回盲段内容物中对棒状杆菌进行直接分离培养,这种方法在隐性感染小鼠中的检出率分别为1%和3%,在诱发感染发病小鼠中的检出率也只有19%和12%的,对自然发病的小鼠检出率为22%和0[10],可见直接从气管分泌物和肠道内容物中分离培养的方法不适合对小鼠棒状杆菌监测和检测。通过选择性培养基增菌培养后有可能提高检出率[11-12]。
在小鼠棒状杆菌病中内脏表现为广泛性的化脓性病变,尤其是肝和肾的病变最为明显[13],因此,本实验以肝脏和肾脏作为检测对象来探讨所建立的方法的适用性。结果表面,对病变肝脏和肾脏,PCR方法和分离培养方法都能检出,但PCR方法操作更简单,所需时间更短。对其他临床样本的适用性有待于通过与培养方法的比较来进一步研究证实。
[1]陈德威,宋万敏.鼠棒状杆菌的分离与鉴定[J].《实验动物科学》,1987,4(2):43-45.
[2]高正琴,张强,邢进,等.鼠棒状杆菌的分离与鉴定[J].《实验动物科学》,2008,25(1):18-20.
[3]Amao H, AkimotoT, KomukaiY, et al. Detection of Corynebacterium kutscheri from the oral cavity of rats[J].Exp Anim,2002,51(1):99-102
[4]Amao H, MoriguchiN, KomukaiY, et al. Detection of Corynebacterium kutscheri in the faeces of subclinically infected mice[J].Lab Anim,2008,42(3):376-82.
[5]GB/T14926.9-2001,实验动物 鼠棒状杆菌检测方法[S].
[6]Ackerman JI, Fox JG, Murphy JC. An enzyme linked immunosorbent assay for detection of antibodies to Corynebacterium kutscheri in experimentally infected rats[J].Lab Anim Sci,1984,34(1):38-43.
[7]蒋观成,黄澜,郑京晶.应用血清学方法诊断大鼠中棒状杆菌的感染[J].中国实验动物学杂志,1994,4(1):17-19.
[8]唐连飞,肖家勇,朱中武,等.嗜酸氧化亚铁硫杆菌实时荧光定量PCR检测方法的建立[J].中国国境卫生检疫杂志,2010,33(5):339-342.
[9]GB 14922.2-2011,实验动物 微生物学等级及监测[S].
[10]李红,贾瑞胜,黄澜,等.小鼠感染鼠棒状杆菌的调查及检查方法的比较.中国实验动物学杂志,1992,2(3-4):170-171.
[11]崔洪波,凌秋,朱玉璞,等.鼠棒状杆菌的增菌培养基.中国畜禽传染病,1994,4:55-56.
[12]郑海洪,杨永良,赵林山.鼠棒状杆菌的增菌培养基试验.黑龙江畜牧兽医,2003,3:39.
[13]侯伶伶,靳彦华,陈德威.实验小鼠人工感染鼠棒状杆菌的病理形态学观察.实验动物科学,1987,4(4)125-128.
Development and Application of a PCR for the Detection of Corynebacterium Kutscheri in Mice
TANG Lian-fei1,ZHOU Zhi-jun2,CAI Jing-yi1,MENG Fang1,WEI Ying1,YU Yuan-jing2,SU Zhi-jie2
(1.Hunan Entry-Exit Inspection and Quarantine Bureau,Changsha 410004,China;2.Department of Laboratory Animal of Xiangya Medicine School,Centre South University,Changsha 410008,China)
Objective To develop a PCR for the detection of corynebacterium kutscheri(C.kutscheri)and apply it to clinical samples.Methods Genomic DNA was extracted as template for PCR from C.kutscheri(ATCC 11306)recoveried and cultivated in brain heart infusion medium.According to the C.kutscheri 16S rRNA gene sequence available in GenBank a pair of primes were designed and synthesized in order to develop a PCR for detection of C.kutscheri.After evaluated for sensitivity and specificity the PCR method was applied to detect the C.kutscheri in clinical livers and kidneys of mice artificially infected with C.kutscheri.Results The PCR for the detection of C.kutscheri was developed successfully and were specific enough to distinguish C.kutscheri from salmonella,streptococcus pneumoniae and Pasteurella.A minimum of 100 positive plasmids could be detected,indicating a good sensitivity of the assay.Conclusion This method repoted here is specific,sensitive and provides a fast detection of C.kutscheri and could be used for C.kutscheri clinical diagnosis.
Corynebacterium kutscheri;PCR method;16S rRNA
S858.91
A
1671-7856(2012)09-0051-04
10.3969.j.issn.1671.7856.2012.009.011
2012-08-17
湖南省科技厅科技项目资助(2011TT2016)。
唐连飞(1970-)男,高级兽医师,博士,病原生物学。
周智君(1971-)女,高级实验师,硕士,实验动物学。
