反复性力竭运动后大鼠心脏传导系统ADAMTS-1的变化及其在运动性心律失常发生中的作用
2012-09-15杨红霞
杨红霞,常 芸
反复性力竭运动后大鼠心脏传导系统ADAMTS-1的变化及其在运动性心律失常发生中的作用
杨红霞,常 芸
目的:探讨反复力竭运动后不同时相心脏窦房结、房室结和浦肯野氏纤维细胞炎性因子金属蛋白酶-1基因和蛋白水平的表达特点,为运动性心律失常发生机制的阐明提供实验依据。方法:100只健康成年雄性SD大鼠随机分为反复力竭组及相应的其对照组,每组10只。分别于
力竭运动后0、4 h、12 h及24 h取材,进行心电图、免疫荧光组化及实时荧光定量PCR分析。应用激光显微切割技术定位并收集房室结和浦肯野氏纤维细胞研究细胞炎性因子ADAMTS-1的mRNA和蛋白表达的变化。结果:反复力竭运动后即刻心脏传导系统ADAMTS-1 mRNA和蛋白表达均出现不同程度升高,随后在4 h、12 h、24 h心脏传导系统窦房结、房室结、浦肯野氏纤维ADAMTS-1基因mRNA和蛋白表达下降(P<0.05,P<0.01),乃至恢复。心脏传导系统不同部位在反复力竭游泳运动后ADAMTS-1 mRNA和蛋白表达存有差异,其中,运动后即刻,浦肯野氏纤维ADAMTS-1蛋白表达显著低于窦房结和房室结(P<0.01)。4 h,窦房结显著高于浦肯野氏纤维(P<0.01)。24 h,窦房结显著低于房室结和浦肯野氏纤维(P<0.01)。结论:反复力竭运动后即刻心脏传导系统ADAMTS-1 mRNA和蛋白表达均出现不同程度升高,作为炎性因子的大量表达,易引起传导系统炎性细胞浸润,细胞间质增
殖乃至纤维化,是运动性心律失常的诱发因素之一。
力竭运动;金属蛋白酶-1;心脏传导系统
运动性心律失常一直是运动医学领域十分关注的医学问题。而运动性心律失常的发生机制是一个极其复杂的过程,涉及众多因子。运动医学界对此进行了广泛的临床观察与调研[1]。常芸等针对运动性心律失常的发生机制进行了大量实验性研究[2-4]。目前运动性心律失常发生的可能原因仍未完全阐明,以往实验性研究方法,大多数集中心肌组织,很难概括心律失常发生的病理机制。心脏传导系统作为心电活动的控制中心和冲动传导的重要部位,其特殊的组织结构和细胞类型决定其具有不同于普通心肌的心电起搏和传导功能,与各种类型心律失常的发生和发展具有密切的关系。
金属蛋白酶(ADAMTS)是新近发现的具有蛋白质水解功能的金属蛋白酶家族,I型血小板结合蛋白基序(TSP)的解聚蛋白样金属蛋白酶(ADAMTS-1)是ADAMTS家族成员,属于分泌型蛋白,可由巨噬细胞、血管内皮细胞、平滑肌细胞、成纤维细胞等多种细胞合成和分泌[5]有研究表明[6]ADAMTS-1可能通过调节胶原代谢参与心肌纤维化的发生发展过程,可能与运动性心律失常的病理过程有关。而在运动条件下心脏传导系统中ADAMTS-1的变化还未见报道。
为此,本研究将对反复力竭运动后心脏传导系统的ADAMTS-1在基因和蛋白表达变化进行研究,试图为运动性心律失常发生机制的阐释提供理论与实验依据。
1 材料与方法
1.1 实验对象
健康雄性成年SD大鼠100只,8周龄,体重(22.0±8)g。国家标准啮齿动物饲料喂养,自由饮食。饲养环境为室温(20±2)℃,光照时间12 h,相对湿度40%~55%。
1.2 运动负荷
将100只实验大鼠随机分为10组,每组10只。其中一次力竭和2周反复力竭游泳运动[7]各4组,相应安静对照2组。安静对照组不运动,力竭运动各组大鼠尾部负重为体重的3%,每周运动6天,每天1次。力竭标准参照Thomas的报道[8]即:“经过10 s后动物仍不能返回水面,并且捞出后置于平面不能完成翻正反射。”
1.3 取材
最后一次力竭运动后即刻、4 h、12 h及24 h等不同时相取材,迅速取出心脏,沿心脏矢状面的方向将整个心脏用OCT包埋,液氮骤冷,作全心连续冰冻切片,光镜定位心脏传导系统,运用激光显微切割仪切割分别收集窦房结细胞或细胞团[9]。
1.4 实时荧光定量PCR检测
采用Trizol法提取总RNA,并逆转录cDNA,存于-20℃备用。通过互联网搜索Genbank查找目标因子结蛋白和内参照β-actin的引物基因序列,应用Primer 5软件进行引物设计,引物扩增目标基因片断长度均小于150 bp,其PCR产物用2%琼脂糖凝胶电泳检测验证引物可用后,再进行荧光定量 PCR,取定量PCR用 96孔板,加入cDNA和引物配置25μ L反应体系。实时定量RT-PCR主要过程:预变性95℃ 30 s,PCR反应95℃ 10 s,60℃ 30 s,40个循环。检测CT值(见表1)。设计的引物由上海生工生物技术有限公司合成。
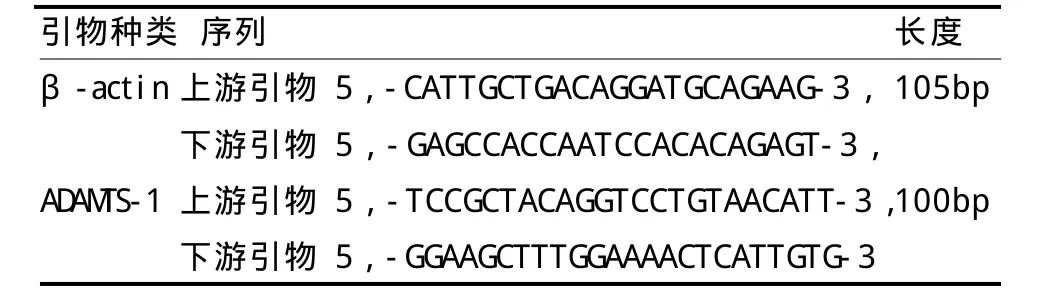
表1 PCR引物序列TableⅠ PCR Primer Sequence
1.5 免疫荧光检测
心脏传导系统冰冻切片进行免疫荧光组织化学染色,采用Leica AD MDW活细胞多维图成像工作站和Leica Qwin图像分析系统对目标因子蛋白荧光强度进行定量,荧光强度用积分灰度表示(IOD),参考阴性对照标本中荧光强度,灰度值在40~130之间为蛋白阳性表达。
1.6 统计学分析
利用SDS2.2软件对实时定量PCR数据进行分析处理,并导出文件及图像。利用管家基因对目的基因的表达进行校正,得到相对定量结果(相对数值)。结果用平均数±标准差表示,组间比较采用多因素方差分析,显著性水平为P<0.05。
2 结果
2.1 心脏传导系统一般指标
经过反复力竭运动后大鼠有不同程度出现心律失常,心脏肉眼观察有不同程度的充血,且反复力竭游泳运动后各时相组心脏重量指数均显著高于对照组心脏重量指数(P<0.05),具体数据结果参见[10]。
2.2 心脏传导系统ADAMTS-1mRNA表达结果
如表2所示,反复力竭游泳运动后即刻心脏传导系统窦房结、房室结ADAMTS-1基因mRNA表有所增高,随后在4 h、12 h、24 h心脏传导系统窦房结、房室结、浦肯野氏纤维ADAMTS-1基因mRNA表达均显著低于对照组(P<0.05),4 h又显著低于12 h(P<0.05);其中,反复力竭游泳运动后4 h、12 h房室结ADAMTS-1mRNA表达显著低于即刻和24 h(P<0.05);反复力竭游泳运动后4 h、12 h浦肯野氏纤维ADAMTS-1mRNA表达显著低于即刻(P<0.05)。
总体来看,反复力竭运动后大鼠传导系统各部位ADAMTS-1基因mRNA表达呈时相性规律,反复力竭运动后即刻大鼠窦房结、房室结、浦肯野氏纤维ADAMTS-1基因mRNA表达上升,之后迅速下降,到力竭后4 h接近低谷,一直持续到24 h,其中,窦房结和房室结的改变更为明显(见图1)。
2.3 心脏传导系统ADAMTS-1蛋白表达结果
如表3所示,经反复力竭游泳运动后,心脏传导系统窦房结ADAMTS-1蛋白表达即刻显著高于对照组(P<0.01),4 h、12 h、24 h又均显著低于对照组和即刻(P<0.01)。
房室结、浦肯野氏纤维ADAMTS-1蛋白表达4 h、12 h、24 h均显著低于对照组和即刻(P<0.01),4 h又显著低于12 h(p<0.05)和24 h(P<0.01)。其中,房室结ADAMTS-1蛋白表达即刻显著高于对照组(P<0.01),浦肯野氏纤维ADAMTS-1蛋白表达24 h显著高于12 h(P<0.01)。
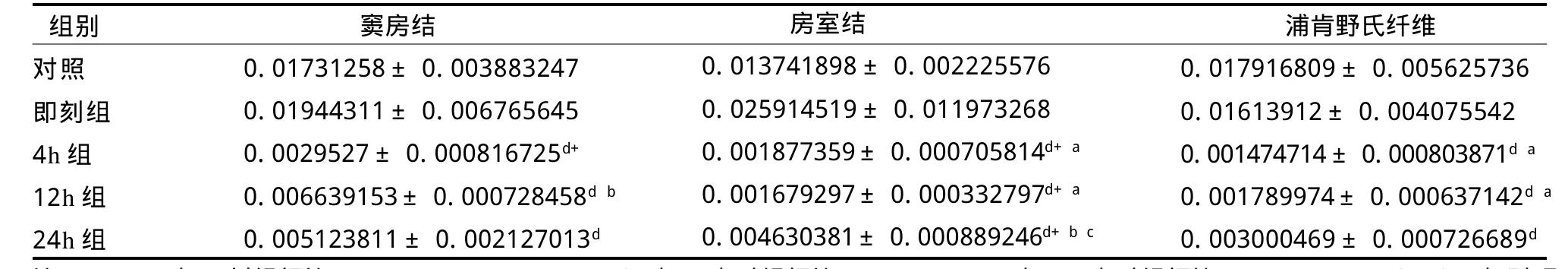
表2 反复力竭运动后大鼠ADAMTS-1mRNA相对表达量TableⅡ Relative Expression Quantity of Rat ADAMTS-1mRNA after Repeated Exhaustive Exercise
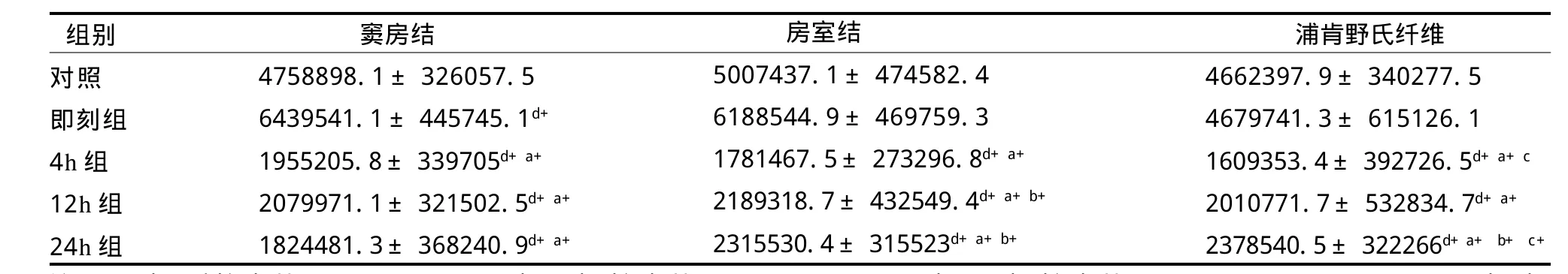
表3 反复力竭运动后大鼠ADAMT S-1蛋白表达总灰度值变化情况TableⅢ Changes of Total Gray Value of Rat ADAMTS-1 Protein Expression after Repeated Exhaustive Exercise
心脏传导系统不同部位在反复力竭游泳运动后存有差异。其中即刻,浦肯野氏纤维ADAMTS-1蛋白表达显著低于窦房结和房室结(P<0.01)。4 h,窦房结显著高于浦肯野氏纤维(P<0.01)。24 h,窦房结显著低于房室结和浦肯野氏纤维(P<0.01)。
总体来看,反复力竭运动后大鼠传导系统各部位ADAMTS-1基因蛋白表达呈时相性规律,运动后即刻大鼠窦房结、房室结、浦肯野氏纤维ADAMTS-1基因蛋白表达上升,之后迅速下降,到力竭后4 h接近低谷,一直持续到24 h,其中,窦房结和房室结的改变更为明显(见图2)。
3 讨论
ADAMTS是新近发现的具有蛋白质水解功能的金属蛋白酶家族,I型血小板结合蛋白基序(TSP)的解聚蛋白样金属蛋白酶(ADAMTS-1)是ADAMTS家族成员,属于分泌型蛋白,可由巨噬细胞、血管内皮细胞、平滑肌细胞、成纤维细胞等多种细胞合成和分泌[5],分泌后大多通过C末端3个TSP重复序列和间隔区锚定在细胞外基质(ECM)中,并与之结合从而参与ECM蛋白的调节[6、11]。有研究表明,ADAMTS-1参与动脉粥样硬化的病理过程与ECM重构关系密切,具有降解I型胶原的作用[12]。申锷,陈瑞珍等[13]研究表明ADAMTS-1可能通过调节胶原代谢而参与心肌纤维化的发生发展过程。也有学者观察柯萨奇病毒B组病毒感染小鼠引起急、慢性病毒心肌炎心肌ADAMTS-1表达发现,ADAMTS-1与CVB3感染所致病毒性心脏病心肌纤维化关系密切[14]。在运动条件下房室结和浦肯野纤维细胞中ADAMTS-1的变化还未见报道。
冯小兰、冯震博[15]利用结扎后造成心肌梗死模型,研究大鼠急性心肌梗死(AMI)ADAMTS-1的表达发现,结扎后6 h,ADAMTS-1 mRNA的表达到高峰,在ADAMTS-1表达高的区域出现心肌坏死,提示ADAMTS-1表达高的区域,心肌损害程度越严重。本研究发现,反复力竭运动后大鼠传导系统各部位ADAMTS-1基因mRNA表达呈时相性规律,反复力竭运动后即刻大鼠窦房结、房室结、浦肯野氏纤维ADAMTS-1基因mRNA表达上升,之后迅速下降,到力竭后4 h接近低谷,一直持续到24 h,其中,窦房结和房室结的改变更为明显。ADAMTS-1具有降解细胞外基质的功能,能破坏细胞结构,使酶活性丧失,糖蛋白分解,细胞功能的损坏,导致心肌细胞的凋亡或坏死。分析认为,反复运动后心肌缺血再灌注损伤加重。由于对反复力竭刺激产生适应,在运动后24 h的ADAMTS-1表达有所恢复。
研究发现[16],TNF-a可以诱导内皮细胞表达ADAMTS-1,从而分泌到细胞外基质并与之结合,参与细胞外基质蛋白的调节,降解蛋白多糖,聚集蛋白聚糖、多能聚糖以及胶原蛋白[17],引起心肌组织局部肌肉间隙增宽,导致心肌组织结构改变,最终影响心功能。本研究发现,反复力竭运动后呈现先下降后上升的趋势,且运动后4 h、12 h浦肯野氏纤维ADAMTS-1mRNA表达显著低于即刻,故反复力竭后运动性室性心律失常的易感性更高。综上,反复力竭运动后心脏传导系统ADAMTS-1 mRNA和蛋白表达均出现不同程度升高,可能影响正常心律的起搏与传导,构成运动性心律失常的发生基础。
4 小结
4.1 反复力竭运动后即刻心脏传导系统ADAMTS-1 mRNA和蛋白表达均出现不同程度升高,作为炎性因子的大量表达,易引起传导系统炎性细胞浸润,细胞间质增殖乃至纤维化,是运动性心律失常的诱发因素之一。
4.2 心脏传导系统不同部位在反复力竭游泳运动后ADAMTS-1 mRNA和蛋白表达存有差异,其中运动后即刻浦肯野氏纤维ADAMTS-1蛋白表达显著低于窦房结和房室结,而运动后4 h窦房结显著高于浦肯野氏纤维,24 h窦房结显著低于房室结和浦肯野氏纤维。
[1]曲绵域.实用运动医学[M].北京:北京科学技术出版社,1996: 311-318.
[2]常芸.运动心脏的实验研究[M].北京:人民体育出版社,1998.
[3]常芸.运动心脏理论与实践[M].北京:人民体育出版社,2008. 106-132.
[4]常芸.运动员心脏的医务监督[M].北京:北京体育大学出版社, 2009.203-207.
[5]王利,王宪,孔炜.新型金属蛋白酶ADAMT S家族的研究进展[J].生理科学进展,2008,3 9(1):49-52
[6]Kuno K, Kanada N, Nakashima E, et al.(1997). Molecular cloning of a gene encoding a new type of metallopmteinase-disintegrin family protion with thmmbospondin motifs as an inflammation associated gene[J]. J Bid Chem, 272(1):556-562.
[7]Kramer K, Dijkstra H, Bast A. (l993). Control of physical exercise of rats in a swimming basin. Physiol Behav, 53(2): 271-276.
[8]Thomas D P, Marshall Kl. (1988). Effect of repeated exhaustive exercise on myocardial subcellular membrane structures. Int J Sports Med. 9(4): 257-260.
[9]Splawski I, Shen J, Timothy KW, et al.(1998). Gramme structure of three long QT syndromegenes: KVLQTI, BERG, and KCNEI. Grammes, 51(1): 86
[10]常芸,杨红霞.不同力竭运动后大鼠心脏传导系统结蛋白m RNA和蛋白表达的变化及其在运动性心律失常发生中的作用[J].中国运动医学杂志,2012,31(04):34-321
[11]Mittaz L, Ricardo S, Martinez G, et al. (2005). Neonatal calyceal dilation and renal fibrosis resulting from loss of Adamts-1 in mouse kidney is due to a developmental dysgenesis [J]. Nephrol Dial Transplant, 20(2): 419-423.
[12]Jonsson-Rylander AC,Nilsson T, Fritsche-Danielson R et al. (2005). Role of ADAMTS-1 in atheroselerosis: remodeling of carotid artery,immunohistochemistry, and Proteolysis of
[13]versiean.Arterioseler Thromb Vasc Biol.25(l):180-185.申锷,陈瑞珍,杨英珍.ADAM TS-1与小鼠急、慢性病毒性心肌
[14]炎心肌纤维化相关性的初步研究[J].中华心血管病杂志, 2007,35(9):854-858.
[15]申锷.CvB3致小鼠病毒性心脏病心肌纤维化的发生机制及其药物治疗研究[D].复旦大学博士学位论文,2007,42.冯小兰,冯震博等实验性大鼠急性心肌梗死ADAM TS1表达的研究[J].广西医科大学学报,2008,25(3):373-375
[16]Kuno K, Kanada N, Nakashima E, et al. (1997). Molecular cloning of a gene encoding a new type of metallopmteinase-disintegrin family protion with thmmbospondin motifs as an inflammation associated gene[J]. J Bid Chem, 272(1):556-562
[17]Mittaz L, Ricardo S, Martinez G, et al.(2005). Neonatal calyceal dilation and renal fibrosis resulting from loss of Adamts-1 in mouse kidney is due to a developmental dysgenesis [J]. Nephrol Dial Transplant, 20(2):419-423.
(责任编辑:何聪)
Changes of ADAMTS-1 of the Rat Cardiac Conduction System after Repeated Exhaustive Exercise and Its Role in Athletic Arrhythmia
YANG Hong-xia, CHANG Yun
(China Institute of Sport Science, Beijing 100061, China)
Objective To find out the expressive characteristics of sinoatrial node, atrioventricular node and Purkinje's fibre cell inflammatory factor MMP-1 gene and protein level at the different phases after repeated exhaustive exercises so as to provide experimental reference for the occurrence mechanism of athletic arrhythmia. Method 100 healthy adult male SD rats were divided randomly into repeated exhaustive exercise groups and control groups. There are 10 rats in each group. Samples were collected immediately, 4h, 12h and 24h after the exhaustive exercise for electrocardiogram, immunofluorescence technology and PCR analysis. Adopting microdissection technology to position and collect the changes of cardiac conduction system ADAMTS-1 mRNA and protein expression of atrioventricular node and Purkiny's fibre cell inflammatory factor ADAMTS-1. Result Cardiac conduction system ADAMTS-1 mRNA and protein expression immediately after repeated exhaustive exercise rose to some extent. Then the cardiac conduction system sinoatrial node, atrioventricular node and Purkinye's fibre ADAMTS-1 mRNA and protein expression decreased at 4h, 12h and 24 hours (P<0.05, P<0.01) until recovery. There is a difference between ADAMTS-1 mRNA and protein expression of the different parts of cardiac conduction system after repeated exhaustive exercise. Purkinye's fibre ADAMTS-1 protein expression was clearly lower than those of sinoatrial node and atrioventricular node immediately after the exercise (P<0.01). After 4 hours, protein expression of sinoatrial node was significantly higher than that of Puekinye's. After 24 hours, The protein expression of sinoatrial node was evidently lower than those of atrioventricular node and Purkinye's fibre (P<0.01). Conclusion ADAMTS-1 mRNA and protein expression rose to some extent immediately after repeated exhaustive exercise. Large quantity expression of inflammatory factor may cause inflammatory cell filtration , Intercellular substances proliferation and fibrosis. This is one of the risk factors for athletic arrhythmia.
exhaustive exercise; MMP-1; cardia conduction system
G804.5
A
1006-1207(2012)04-0021-04
2012-06-27
国家体育总局体育科学研究所基本科研业务经费(10-01)
杨红霞,女,研究生. 主要研究方向:运动心脏病理与医学监督.
国家体育总局体育科学研究所,北京体育馆路11号,北京100061
