自分泌运动因子在乳腺癌中表达情况及与预后关系
2012-09-07李卫民杨振宇
李卫民 杨振宇
1.河南省安阳县总医院普外一科,河南安阳 455000;2.河南省安阳市第六人民医院胸外科,河南安阳 455000
乳腺癌是发生于乳腺的恶性肿瘤,是女性排名第一的恶性肿瘤,近年来其发病率呈逐年上升趋势。在亚洲乳腺癌发病年龄多在45~55岁,临床上主要采用手术切除、放化疗以及内分泌的方法治疗乳腺癌。目前发现乳腺癌和环境[1](如亚硝胺[2]、病毒[3])、饮食(缺乏维生素[4]、缺乏某些微量元素[5-6])和遗传因素[7]有关,但是其具体的分子机制依旧不清楚。
自分泌运动因子受体(AMFR)又名E3泛素蛋白连接酶,位于16q21,编码323个氨基酸。AMFR主要参与组成滑面内质网的亚结构,它能在内质网中催化降解折叠错误的蛋白质,确保只有正确折叠的蛋白质进入分泌途径。AMFR主要有3种配体,即自分泌运动因子AMF、神经营养因子NLK和磷酸葡萄糖异构酶PGI,AMFR和不同的配体结合能够发挥不同的生理作用。
目前,AMFR的研究主要集中在肿瘤方面,AMFR在许多肿瘤组织特别是侵袭性或转移性的肿瘤(如膀胱癌[8]、胃癌[9]等)中表达上调,而且AMFR的表达水平与肿瘤的侵袭、转移和预后密切相关,AMFR表达比较高的患者其复发率和生存率也显著高于AMFR表达低的患者。AMFR的表达情况在乳腺癌[10-11]中也有研究,但是AMFR表达和预后之间的关系则在国内研究甚少。
在本实验中,笔者在mRNA水平和蛋白水平研究了AMFR在乳腺癌中的表达情况,分析了AMFR表达和临床之间的关系,并对AMFR表达和生存时间之间进行了研究,探讨了AMFR在乳腺癌中的诊断、治疗和预后中的作用。
1 资料与方法
1.1 组织标本
为了在mRNA水平检测AMFR的表达,笔者在2010年8月~2011年5月收集了在安阳县总医院普外一科手术切除的乳腺浸润性癌及癌旁正常组织29例。手术切除的新鲜组织立即放入含有 RNAlater(Invitrogen,US)的溶液中,4℃保存过夜,以使RNAlater充分地浸入到组织中,然后-80℃冻存。
另外,还收集了80例病理诊断明确的乳腺浸润性癌和癌旁正常组织石蜡组织块(2003年9月~2010年10月在安阳县总医院普外一科手术切除),术后这些患者均未进行过系统的放化疗治疗。笔者在2011年6月采用电话和上门的方式对这些患者进行了随访,患者的生存期为3~78个月,中位生存期为33个月,其他相关的临床资料见表1。
1.2 实时荧光定量PCR
使用 TRIZOL 试剂盒提取总 RNA(Invitrogen,US),然后使用Omniscript逆转录试剂盒(Qiagen,Germany)合成第一链的cDNA。合成第一链cDNA后使用Agilent2100 Bioanalyzer(Agilent technologies,US)来测量合成的第一链cDNA的浓度。
AMFR和内参GAPDH的引物都用Primer 5软件合成,AMFR上游引物为5'-CACAGCGGTCAGATAGCA-3',下游引物为5'-AAGTCCAGCGTCTCCTCC-3',内参GAPDH的上游引物为5'-ACCCACTCCTCCACCTTTGA-3',下游引物序列为5'-ACCACCCTGTTGCTGTAGCC-3'。
使用Invitrogen的实时荧光定量PCR试剂盒,实时荧光定量PCR仪器是ABI7700,PCR反应体系为20 μL,其中包括 1 μL cDNA,9 μL SYBR Green mix,上下游引物各 0.8 μL,ROX 0.4 μL,双蒸水 8 μL、扩增条件是 95°C 孵育 2 min,然后 95°C 变性 5 s,57°C 退火 30 s,68°C 延伸 30 s,进行 40 个循环。实验完毕后收集数据进行统计分析。
1.3 免疫组化分析及评价
对80例乳腺浸润性癌和癌旁正常组织进行了免疫组化分析,所有的步骤均按照经典的程序来。简单来说如下,首先进行脱蜡和水化,将石蜡切片放在二甲苯溶液中浸泡20 min,重复一次,然后使用梯度浓度的乙醇(无水乙醇、95%、90%、85%、80%)浸泡,自来水冲洗,然后在微波炉中加热用枸橼酸钠缓冲液浸泡的组织切片进行抗原修复,PBS缓冲液冲洗后加入H2O2溶液灭活过氧化物酶活性,然后用非免疫性动物血清BSA 37°C进行抗原封闭30 min,弃血清后加入AMFR抗体(Abcam,Britain,1∶250 稀释)50 μL 4°C 过夜。 最后经PBS缓冲液冲洗之后,加入生物素标记的二抗50 μL孵育30 min,再次经PBS缓冲液冲洗后加入链霉菌抗生素过氧化物酶溶液孵育30 min后加入DAB溶液显色,显微镜下观察掌握染色程度,最后用苏木素复染,自来水冲洗后脱水、透明、封片和镜检。
实验人员分别独立地对这些免疫组化结果进行了评价,采用的标准如下:根据细胞染色的比例进行打分,0分为阴性,1分为阳性细胞≤10%,2分为11%~50%,3分为51%~75%,4分为>75%。染色强度打分为,0分为无色,1分为淡黄色,2分为棕黄色,3分为棕褐色。染色强度和染色细胞比例乘积得分如下:0,1,2,3,4,6,8,9,12。 ≤4 分认为 AMFR 蛋白表达降低,≥6分认为蛋白表达升高[12]。
1.4 统计学分析
使用SPSS 17对所有的数据进行统计分析,对实时荧光定量PCR,对乳腺癌和癌旁正常组织进行配对样本的t检验;对免疫组化结果,AMFR蛋白表达和临床特征之间关系采用卡方检验;对随访结果,使用Kaplan-Meier的方法绘制生存曲线并用log-rank进行分析,P<0.05为差异有统计学意义。
2 结果
2.1 乳腺浸润性癌和癌旁正常组织mRNA水平统计结果
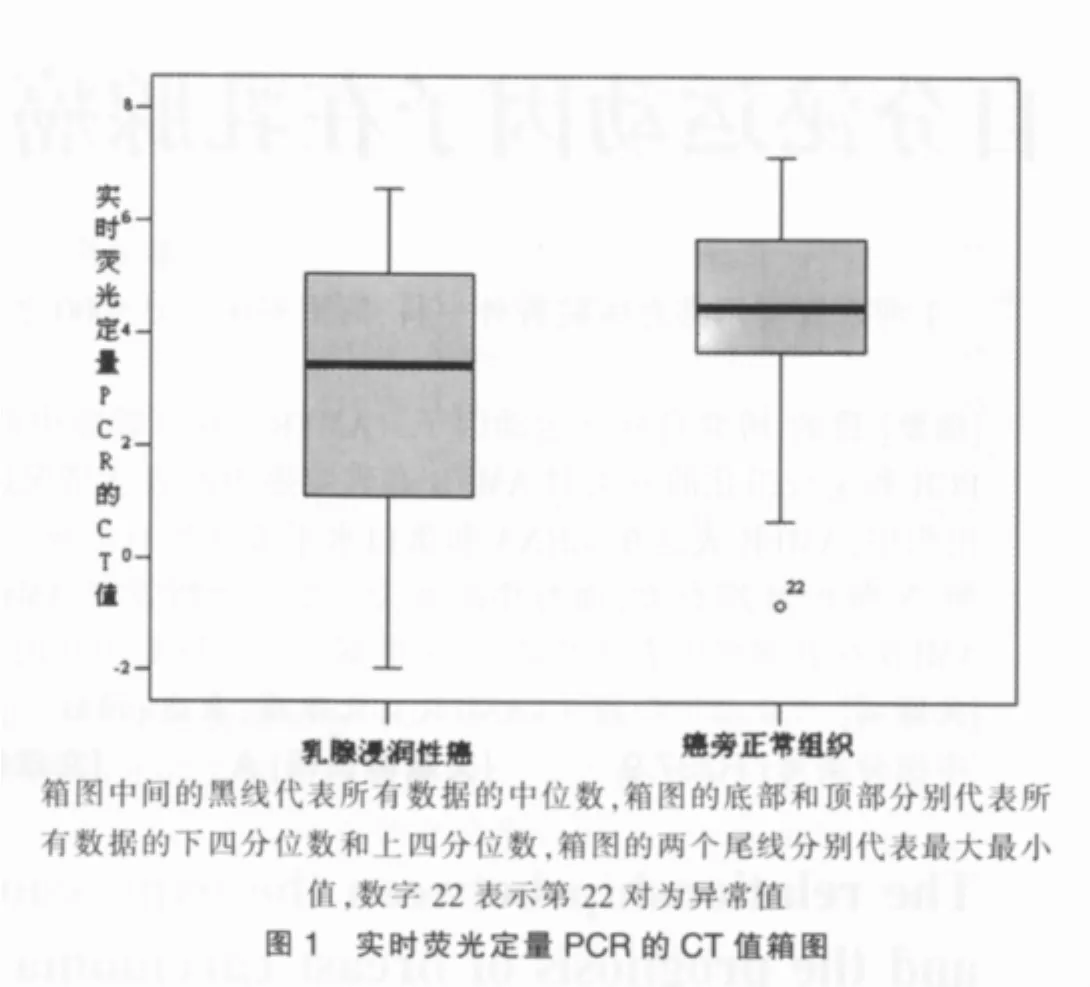
对收集的29例乳腺浸润性癌和癌旁正常组织进行统计分析,方法为配对样本t检验,在29例乳腺浸润性癌中,有23例AMFR表达高于癌旁正常组织,乳腺癌的CT均值为3.06,癌旁正常组织的CT值为4.47,配对样本t检验结果t值为-3.794,P=0.001,乳腺浸润性癌和癌旁正常组织AMFR表达差异有统计学意义。如图1。
2.2 乳腺癌和癌旁正常组织的免疫组化分析
在正常的乳腺细胞中,AMFR的蛋白主要定位于细胞的胞浆和细胞膜,在80例乳腺浸润性癌中,有57例AMFR表达升高,而在癌旁正常组织中,有42例AMFR蛋白表达升高,卡方检验结果为χ2=5.961,P=0.015,在AMFR蛋白水平,乳腺癌和癌旁正常组织表达差异有统计学意义。如图2、3。

2.3 乳腺癌中AMFR蛋白表达和临床之间的关系
使用卡方检验对AMFR蛋白在乳腺浸润性癌表达情况与临床特征之间的关系进行统计分析探讨,在80例乳腺浸润性癌中有57例AMFR蛋白表达升高(分数≥6分),而表达降低的仅有23例(≤4分)。通过统计发现,乳腺癌中的AMFR表达水平和病变大小(χ2=4.929,P=0.026)、T 期(χ2=9.235,P=0.010)、N 期(χ2=5.740,P=0.017)和 M 期(χ2=13.518,P<0.001)有关,而与年龄无关(χ2=0.188,P=0.665)无关。见表1。

表1 乳腺癌中AMFR蛋白表达和临床之间的分析(n)
2.4 生存分析
笔者在2011年6月采用电话和上门的方式对这80例患者进行了随访,患者的生存期为3~78个月,中位生存期为33个月。为了探讨AMFR表达和预后之间的关系,使用了Kaplan-Meier分析和log-rank检验的方法。发现AMFR表达水平和总的生存率有关,AMFR表达增高的患者生存时间比较短。AMFR表达降低的患者的平均生存期为44.73个月,中位生存期为31个月,而表达AMFR升高的患者生存期为25.651个月,中位生存期为20个月,log-rank检验表明这两组之间生存率差异有统计学意义(χ2=7.071,P=0.008)。生存曲线如图4。
3 讨论
自分泌运动因子受体AMFR又名E3泛素蛋白连接酶,它能够在内质网中清除折叠错误的蛋白[13]。AMFR与不同的配体结合能发挥不同的作用,目前研究发现其主要有3种配体,即:自分泌运动因子AMF、神经营养因子NLK和磷酸葡萄糖异构酶PGI。AMFR与AMF结合可以刺激细胞的运动,与肿瘤细胞的生长、转移有关[14];与NLK结合与神经元的生长、存活有关[15-16];而与PGI结合则与糖代谢有关[17]。
AMFR在肿瘤中研究的比较多,在浸润性导管癌组织中AMFR表达水平明显高于正常乳腺上皮,组织学Ⅰ、Ⅱ、Ⅲ级癌组织表达强度逐渐升高,说明AMFR与乳腺癌的发生、分化程度都有关[11];在肝癌转移组织中,AMFR的mRNA显著高于未转移组,说明AMFR与肿瘤的转移有关[18];在胃癌中也发现了AMFR表达增加,并且AMFR与TNM分期有关[9]。此外,在膀胱癌[8]、舌癌[19]和肺癌[20]等多个组织都都有AMFR表达的升高,但是在乳腺癌中还没有将AMFR与预后联系的报道。

本文通过实时荧光定量PCR发现在乳腺癌中AMFR的mRNA表达显著增加,进一步使用免疫组化的方法,发现在80例乳腺癌中有57例AMFR蛋白表达升高,与癌旁正常组织差异有统计学意义。通过与临床特征之间分析发现,AMFR表达与病变长度、T期、N期和M期有关,但是与性别和年龄差异则无统计学意义。生存分析发现AMFR表达与患者生存率有关,AMFR表达增高的患者生存时间比较短。log-rank检验表明AMFR表达增高与表达降低之间生存率差异有统计学意义,说明AMFR的表达可以作为一个预后指标。
应该指出的是,由于本研究是单一医院的回顾性研究,由于有不可测量的误差存在而可能影响实验结果。所以为了进一步研究清楚AMFR在乳腺癌发生发展中的作用,多中心多点的回顾性研究是必须的。
通过研究发现,AMFR在乳腺癌中表达升高,而且其表达高低还与预后有关,抑制其表达或者活性可能成为肿瘤治疗的一种新方法新模式,AMFR可能也是肿瘤治疗的一个新靶点和预后新指标,这需要做进一步的研究。
[1]Yokoyama A.Risk factors of esophageal squamous cell carcinoma[J].Nihon Rinsho,2011,69(Suppl 6):42-47.
[2]Zheng S,Vuitton L,Sheyhidin I,et al.Northwestern China:a place to learn more on oesophageal cancer.Part one:behavioural and environmental risk factors[J].Eur J Gastroenterol Hepatol,2010,22(8):917-925.
[3]Qi Z,Jiang Q,Yang J,et al.Human papillomavirus (HPV) infection and the risk of esophageal squamous cell carcinoma[J].Dis Esophagus,2012,9(10):1111.
[4]Yang H,Fang J,Jia X,et al.Chemopreventive effects of early-stage and late-stage supplementation of viatamin E and selenium on esophageal carcinogenesis in rats maintained on a low vitamin E/selenium diet[J].Carcinogenesis,2011,32(3):381-388.
[5]Jessri M,Rashidkhani B,Hajizadeh B,et al.Macronutrients,vitamins and minerals intake and risk of esophageal squamous cell carcinoma:a case-control study in Iran[J].Nutr J,2011,10:137.
[6]Cross AJ,Freedman ND,Ren J,et al.Meat consumption and risk of esophageal and gastric cancer in a large prospective study[J].Am J Gastroenterol,2011,106(3):432-442.
[7]Percesepe A,Ponz De Leon M.Hereditary factors in tumors of the digestive system[J].Ann Ist Super Sanita,1996,32(4):629-642.
[8]Korman HJ,Peabody JO,Cerny JC,et al.Autocrine motility factor receptor as a possible urine marker for transitional cell carcinoma of the bladder[J].J Urol,1996,155(1):347-349.
[9]Gong W,Jiang Y,Wang L,et al.Expression of autocrine motility factor correlates with the angiogenic phenotype of and poor prognosis for human gastric cancer[J].Clin Cancer Res,2005,11(16):5778-5783.
[10]Jiang WG,Raz A,Douglas-Jones A,Mansel RE.Expression of autocrine motility factor (AMF) and its receptor,AMFR,in human breast cancer[J].J Histochem Cytochem,2006,54(2):231-241.
[11]吕正梅,张婉媛,陈晓蓉,沈少辉.E-钙黏附素、自分泌运动因子受体在乳腺癌中的表达[J].安慰医科大学学报,2006,41(2):137-139.
[12]徐良中,杨文涛.免疫组织化学反应结果的判断标准[J].中国癌症杂志,1996,6(4):229-231.
[13]Haga A,Komazaki S,Funasaka T,et al.AMF/G6PI induces differentiation of leukemic cells via an unknown receptor that differs from gp78[J].Leuk Lymphoma,2006,47(10):2234-2243.
[14]Li W,Tu D,Brunger AT,et al.A ubiquitin ligase transfers preformed polyubiquitin chains from a conjugating enzyme to a substrate[J].Nature,2007,446(7133):333-337.
[15]Romagnoli A,Oliverio S,Evangelisti C,et al.Neuroleukin inhibition sensitises neuronal cells to caspase dependent apoptosis[J].Biochem Biophys Res Commun,2003,302(3):448-453.
[16]LuoY,LongJM,LuC,etal.Alinkbetweenmazelearningandhippocampal expression of neuroleukin and its receptor gp78[J].J Neurochem,2002,80(2):354-361.
[17]Jeffery CJ,Bahnson BJ,Chien W,et al.Crystal structure of rabbit phosphor glucose isomerase,a glycolytic enzyme that moon-lights as neuroleukin,autocrine motility factor and differentiation mediator[J].Biochemistry,2000,39(5):955-964.
[18]蒲癸宏,郭丽华,张国元,等.自分泌运动因子及受体mRNA表达与肝癌临床分期的关系[J].检验医学与临床,2011,8(18):2219-2220.
[19]Endo K,Shirai A,Furukawa M,et al.Prognostic value of cell motility activation factors in patients with tongue squamous cell carcinoma[J].Hum Pathol,2006,37(8):1111-1116.
[20]Takanami I,Takeuchi K,Watanabe H,et al.Significance of autocrine motility factor receptor gene expression as a prognostic factor in nonsmall-cell lung cancer[J].Int J Cancer,2001,95(6):384-387.
