粉尘螨Ⅰ类变应原瞬时表达载体的构建及其在烟草中的表达*
2012-08-21李朝品李秋雨姜玉新
李朝品,石 连,李秋雨,姜玉新
2.安徽理工大学医学院病原生物与免疫学教研室,淮南232001
过敏性哮喘为临床常见病、多发病,而粉尘螨Ⅰ 类变应原(Derf1)是诱发过敏性哮喘最重要的变应原[1]。变应原特异性免疫治疗(Allergen-specific immunotherapy,ASIT)是目前治疗过敏性哮喘的唯一病因疗法[2],但目前进行ASIT所用的变应原浸液成分复杂、易产生副作用[2-3],因此变应原的制备必须标准化[1-2]。重组DNA技术可实现变应原的标准化[3],并提高 ASIT的安全性[4]。本文拟将粉尘螨Ⅰ类变应原基因Derf1构建于瞬时表达载体TRBO(TMV RNA-based overexpression)中,通过PCR、测序、酶切等分子生物学技术鉴定后,侵染烟草叶片,观察其表达情况,以期获得表达于烟草的Der f 1蛋白,为后期大规模生产粉尘螨变应原疫苗奠定基础。
1 材料与方法
1.1 材料
1.1.1 粉尘螨 从芜湖某面粉厂的地角粉中分离获得,经形态学鉴定证实为粉尘螨,并进行大规模培养。
1.1.2 本 氏 烟 (Nicotianabenthamiana):8~12 w,由本实验室种植。
1.1.3 菌株E.coliDH-5α为本实验室保存;根癌农杆菌GV1301株由浙江大学生物技术研究所吴建祥教授惠赠。
1.1.4 质粒 p MD18-T载体购自 Ta KaRa公司;TRBO质粒由浙江大学生物技术研究所吴建祥教授惠赠。
1.1.5 引物 根据 GenBank公布的Derf1(EF139429.1)基因序列设计特异引物,上游引物:5′-ATG GAT CCA GCG CTT GCC GTA TCA ATT CGG TTA AC-3′,下 游 引 物:5′-CTC GAG GTT GTT TCC GGC TTG GAA ATA TCC G-3′,并引入PacI和NotI酶切位点,由生工生物工程(上海)有限公司合成。扩增片段长度为627 bp。
1.1.6 工具酶TaqDNA聚合酶及高保真即用PCR扩增试剂盒、限制性内切酶PacI和NotI购自生工生物工程(上海)有限公司;T4DNA连接酶购自TAKARA公司;MMLV first strand cDNA synthesis Kit购自BBI(加拿大)公司。
1.1.7 主要试剂 Trizol®购自Invitrogen公司;硝酸纤维素膜、氨苄青霉素和卡那霉素购自BBI(加拿大)公司;SanPrep柱式DNA胶回收试剂盒、San-Prep柱式PCR产物纯化试剂盒、SanPrep柱式质粒DNA小量抽提试剂盒、100 bp DNA ladder、DAB显色试剂盒购自生工生物工程(上海)有限公司;DL2000 DNA Marker购自 Ta KaRa公司;PacI、NotI、PageRuler®Unstained Protein Ladder(SM0661)购自 Fermentas公司;抗β-actin抗体、HRP标记的羊抗兔二抗购自Sigma公司;兔抗Der f 1抗体为本实验室保存;其他均为国产分析纯。
1.1.8 主要仪器 Beckman高速冷冻离心机,Bio-Rad水平和垂直电泳仪、细菌培养箱、Syngene G:BOX化学发光荧光凝胶成像系统、BTX ECM630电击转化仪。
1.2 方法
1.2.1Derf1基因的扩增 根据粉尘螨避光的特性,收集约500只用Trizol®一步法提取总RNA。Derf1基因的反转录反应:粉尘螨总RNA 2μL,Oligo(d T)18引物(0.5μg/μL)1μL,dd H2O 9μL,70℃预变性5 min,冰浴30s,加入5×反应缓冲液4 μL,RNase inhibitor(20 U/μL)1μL,d NTP Mixture(10 mmol/L)2μL,充分混匀后,37℃孵育5 min。加入 MMLV reverse transcriptase(20 U/μL)1μL,37℃孵育60 min。70℃灭活逆转录酶。PCR体系(20μL)为:cDNA 1μL,10×PCR Buffer 1 μL,d NTP Mixture 1μL,Derf1上、下游引物各1 μL,TaqDNA polymerase(5 U/μL)1μL,dd H2O 14 μL。反应条件:94℃4 min,94℃30 s,55℃45 s,72℃1 min,共35个循环,最后72℃延伸10 min。RT-PCR产物行1.0%琼脂糖凝胶(含0.5μg/m L的溴化乙锭,下同)电泳,用DNA胶回收试剂盒回收目的基因片段。
1.2.2Derf1基因克隆载体的连接及测序鉴定
将RT-PCR产物和p MD18-T载体按1∶8的摩尔浓度比用T4DNA连接酶16℃连接12 h,将连接产物电击转化入感受态E.coliDH-5α中。电击条件为电压2 500 V,电阻100Ω,电容50μF。后涂布含氨苄青霉素(50μg/m L)的LB板,37℃过夜。随机挑取克隆进行质粒提取、PCR扩增及PacI和NotI双酶切鉴定,PCR反应体系及反应条件同1.2.1所述;酶切体系(20μL)按说明书进行,操作如下:p MD18-T-Derf1模板5μL,10×酶切缓冲液2 μL,10×BSA(0.1 mg/m L)2μL,PacI(10 U/μL)1 μL,NotI(10 U/μL)1μL,dd H2O 9μL;混匀后37℃反应3 h,酶切产物经1.0%琼脂糖凝胶电泳后,阳性克隆进行测序验证,由生工生物工程(上海)有限公司完成。
1.2.3 质粒TRBO的扩增 将含TRBO的E.coliDH-5(接种在含50μg/m L卡那霉素的LB液体培养基中37℃培养过夜。按照说明书进行质粒抽提。
1.2.4 重组质粒TRBO-Derf1的构建及电击转化 按常规方法进行目的基因和载体的制备及连接,并根据1.2.2所述的条件电击转化根癌农杆菌(A.tumefaciens)GV1301菌株。
1.2.5 重组质粒TRBO-Derf1的PCR及酶切鉴定 以从A.tumefaciens中抽提的重组质粒TRBO-Derf1为模板进行PCR。同时用PacI和NotI对重组质粒进行双酶切,酶切体系按照说明书进行,同1.2.2所述。
1.2.6 Der f 1在烟草叶片中的表达 挑取含TRBO-Derf1重组质粒的GV1301阳性克隆于含抗生素(Km+Rif,各50μg/m L)的YEP液体培养基培养至OD600≈0.5,3000×g离心10min收集菌体,无菌水重悬,再次离心收集菌体,用含终浓度为10 mmol/L MgCl2,10 mmol/L MES(p H5.6)和200μmol/L乙酰丁香酮(As)的无菌水重悬浮,调整菌液浓度至OD600≈1.0,室温下放置3 h;用1 m L注射器针头在烟草叶片背面刺2个小孔,按住叶面小孔处,用无针头的针管将菌液沿小孔慢慢注入叶片组织空隙。取接种3、4、5、6 d后的烟草叶片(同时设健康植株为对照);按1∶4(w/v)加入提取缓冲液(50 mmol/L phosphate,p H 8.0;10 mmol/L Tris,p H 8.0;500 mmol/L NaCl;0.1%Tween-20;0.1%NP-40;0.1% β-巯 基 乙 醇;1 mmol/L PMSF),研磨数分钟;4℃12 000×g离心20 min;取上清,进行SDS-PAGE(12.5%)电泳检测。
1.2.7 Western blot鉴定 取15μL上述提取的总蛋白,加等体积的2×SDS加样缓冲液混合,沸水浴10 min,冰浴冷却进行SDS-PAGE电泳(分离胶浓度为12.5%)。将蛋白转移至硝酸纤维膜。以5%脱脂牛奶的PBST(含0.01%的 Tween-20的PBS缓冲液)37℃封闭转移膜1 h,加1∶25 00倍稀释液的Der f 1抗体为一抗,室温孵育1 h,PBST洗膜5 min/次,共5次,用HRP酶标二抗(1∶10 000)室温孵育1 h,PBST洗膜5 min/次,共5次,用DAB底物进行显色。出现条带立即中止反应,拍照。设2次独立的重复试验以验证结果的可靠性。
2 结 果
2.1Derf1基因的 RT-PCR 扩增 RT-PCR 扩增产物的电泳结果显示在500~750 bp之间有一条清晰条带,其大小与预期的Derf1基因片段大小基本一致,见图1。
2.2Derf1基因克隆载体的鉴定 将载体p MD18-T和 RT-PCR 产物连接后转化 DH-5α,挑选单个菌落进行PCR扩增以及PacI和NotI双酶切鉴定,电泳结果显示获得了相应大小的扩增片段(图2)和酶切片段(图3),表明重组克隆载体已成功构建。阳性菌落测序,经BLAST序列比对分析确认为Derf1基因,进一步表明已成功克隆Derf1基因。

图1 Der f 1的RT-PCR产物M:DL2000分子量标准;1:Der f 1基因 RT-PCR产物;2:阴性对照Fig.1 Product of Der f 1 by RT-PCR M:DL2000 DNA marker;1:RT-PCR product of Der f 1;2:Negative control
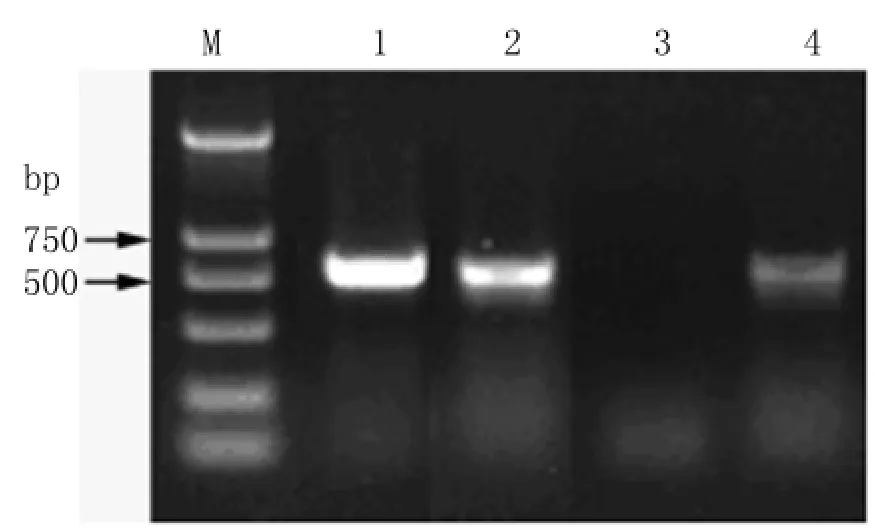
图2 重组质粒p MD18-T-Der f 1的PCR鉴定M:DL 2000分子量标准;1、2、4:含重组质粒p MD18-T-Der f 1的阳性菌;3:阴性菌Fig.2 Identification of recombinant plasmid p MD18-TDer f 1 by PCRM:DL 2000 DNA marker;1,2,4:Positive bacterial colonies containing recombinant plasmid p MD18-T-Der f 1;3:Negative bacterial colony
2.3 重组质粒TRBO-Derf1的PCR鉴定 将载体TRBO和基因片段Derf1的酶切产物连接后转化GV1301菌株,随机挑取单菌落行PCR反应,可扩增出大小为627bp左右的目的基因片段(图4)。2.4 重组质粒TRBO-Derf1的双酶切鉴定 经PacI和NotI双酶切后,电泳结果显示质粒TRBO呈现唯一条带,而重组质粒TRBO-Derf1则分别呈现TRBO载体片段和627bp大小的Derf1基因片段(图5)。
2.5 重组质粒TRBO-Derf1在烟草叶片中的表达 含重组质粒TRBO-Derf1的GV1301菌株注射本氏烟草叶片3、4、5、6 d后提取烟草总蛋白,进行SDS-PAGE电泳,结果显示,在注射后的5 d和6 d Der f 1蛋白的表达明显升高(图6),且大小与预期大小相一致(约25 k D),表明Der f 1蛋白可成功表达于烟草叶片中。Western blot进一步得到证实(图7)。

图3 重组质粒p MD18-T-Der f 1的酶切结果M:DL2,000分子量标准;1:Pac I和Not I双酶切空质粒p MD18-T;2,3:Pac I和 Not I双 酶 切 重 组 质 粒p MD18-T-Der f 1Fig.3 Double digestion of p MD18-T-Der f 1 plasmids by Pac I and Not IM:DL2000 DNA marker;1:p MD18-T plasmid double digested by Pac I and Not I;2,3:Recombinant plasmid p MD18-T-Der f 1 double digestion by Pac I and Not I
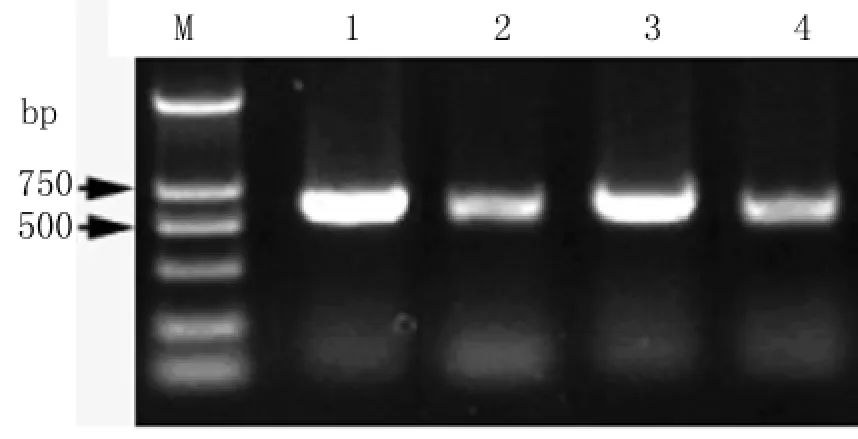
图4 重组质粒TRBO-Der f 1的PCR鉴定M:DL 2000分子量标准;1-4:含重组质粒 TRBO-Der f 1的阳性菌Fig.4 Identification of recombinant plasmid TRBO-Der f 1 by PCRM:DL2000 DNA marker;1-4:Positive bacteria colonies containing recombinant plasmid TRBO-Der f 1
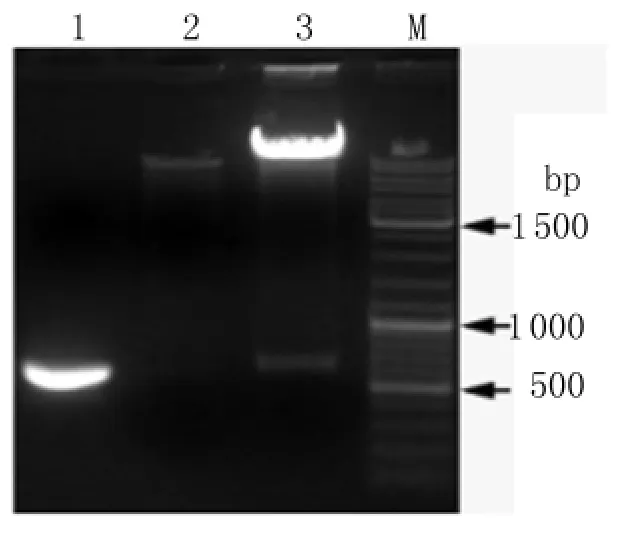
图5 重组质粒TRBO-Der f 1的酶切鉴定结果M:100 bp DNA ladder;1:Der f 1基因 PCR 产物;2:TRBO空载体;3:重组质粒TRBO-Der f 1的Pac I和Not I双酶切产物Fig.5 Double digestion of p MD18-T-Der f 1 plasmids by Pac I and Not IM:100 bp DNA ladder;1:PCR products of Der f 1 gene;2:TRBO plasmid double digested by Pac I and Not I;3:Recombinant plasmid TRBO-Der f 1 double digested by Pac I and Not I
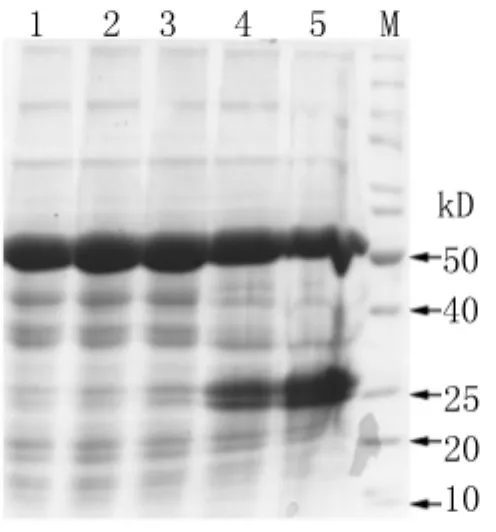
图6 接种不同时间烟草总蛋白中Der f 1蛋白的检测M:蛋白 Marker;1:未处理烟草;2-5:分别为 GV1301侵染3、4、5、6 d的烟草总蛋白Fig.6 Detection of Der f 1 protein from total protein in tobacco leaves harvested at different timeM:Protein marker;1:Untreated tobacco;2-5:Total protein in tobacco leaves harvested at 3,4,5 and 6 day after infiltration

图7 Western blot验证接种不同时间烟草总蛋白中Der f 1蛋白M:蛋白 Marker;1:未处理烟草;2-5:分别为 GV1301侵染3、4、5、6 d的烟草总蛋白Fig.7 Detection of Der f 1 protein from total protein in tobacco leaves harvested at different time by Western blotM:Protein marker;1:Untreated tobacco;2-5:Total protein in tobacco leaves harvested at 3,4,5 and 6 day after infiltration
3 讨 论
粉尘螨是常见的气传变应原,可引起哮喘、过敏性鼻炎、异位性皮炎等多种变态反应性疾病,80%左右的哮喘患者对尘螨过敏[5-6],其中粉尘螨Ⅰ类变应原是最主要的变应原之一。ASIT是唯一可改善变应性疾病自然病程且疗效显著的治疗措施。但尘螨变应原粗浸液因成分复杂、易产生严重的副作用等原因使其应用受到限制,故应用基因工程技术研制标准化的尘螨变应原疫苗备受关注[7-8]。本文用RT-PCR方法以Derf1基因的特异性引物从粉尘螨总RNA中克隆出Derf1基因,测序并经BLAST(www.ncbi.nlm.nih.gov/BLAST/)序列比对分析后,进一步确认为Derf1基因,为标准化的粉尘螨变应原疫苗的制备提供基础材料。
用分子生物学技术从原材料中大规模分离纯化变应原耗时长、成本高、难以解决纯度和避免副反应等问题的发生[9-10],因而难以满足其实际需要。转基因植物在药用蛋白中的应用越来越受重视[10]。植物生物反应器作为一种安全、便捷和经济转基因重组蛋白生产系统而被广泛接受,并成功应用于抗体、疫苗、工业酶、生物多糖等的生产。其中,烟草是重要的植物反应器之一。烟草花叶病毒(TMV)可侵染多种植物并能高水平复制而被广泛用作载体表达外源基因。TRBO(TMV RNA-based overexpression)载体为改进型的TMV载体,具有转染效率高、外源蛋白高表达等特点[11-12],是生产外源重组蛋白的较好选择。本研究利用分子生物学技术将Derf1基因正向插入到TRBO载体中,通过PCR、双酶切等生物学方法鉴定后,表明该基因已克隆入TRBO载体,并成功转化到了农杆菌GV1301菌株中。接种本氏烟草叶片后在第5 d和6 d可见Der f 1蛋白明显表达,并通过Western blot得到进一步验证,为在烟草中的大规模表达Der f 1蛋白奠定了基础。目前正大规模分离纯化Der f 1蛋白并进行过敏性哮喘的变应原特异性免疫治疗的动物实验研究,检测其过敏原性及免疫原性,探讨其临床应用前景。
[1]Yasuhara T,Takm T,Yuuki T,et al.Cloning and expression of cDNA encoding the complete prepro-form of all isoform ofDer f1,the major group 1 allergen from house dust miteDermatophagoidesfarinae[J].Biosci Biotechnol Biochem,2001,65(3):563-569.DOI:10.1271/bbb.65.563
[2]Bousquet J,Lockey R,Malling HJ.Allergen immunotherapy:therapeutic vaccines for allergic diseases.A WHO position paper[J].J Allergy Clin Immunol,1998,102(4 Pt 1):558-562.DOI:10.1111/j.1398-9995.1998.tb04930.x
[3]Valenta R.The future of antigen-specific immunotherapy of allergy[J].Nat Rev Immunol,2002,2(6):446-453.DOI:10.1038/nri824
[4]Akdis CA,Blaser K.Bypassing IgE and targeting T cells for specific immunotherapy of allergy[J].Trends Immunol,2001,22(4):175-178.DOI:10.1016/S1471-4906(01)01862-2
[5]Arlian LG,Platts-Mills TA.The biology of dust mites and the remediation of mite allergens in allergic disease[J].J Allergy Clin Immunol,2001,107(3 Suppl):S406-413.DOI:10.1067/mai.2001.113670
[6]Pittner G,Vrtala S,Thomas WR,et al.Component-resolved diagnosis of house-dust mite allergy with purified natural and recombinant mite allergens[J].Clin Exp Allergy,2004,34(4):597-603.DOI:10.1111/j.1365-2222.2004.1930.x
[7]Kussebi F,Karamloo F,Rhyner C,et al.A major allergen genefusion protein for potential usage in allergen-specific immunotherapy[J].J Allergy Clin Immunol,2005,115(2):323-329.DOI:10.1016/j.jaci.2004.11.041
[8]Burtin D,Chabre H,Olagnier B,et al.Production of native and modified recombinantDerp1 molecules in tobacco plants[J].Clin Exp Allergy,2009,39(5):760-670.DOI:10.1111/j.1365-2222.2009.03201.x
[9]Avesani L,Bortesi L,Santi L,et al.Plant-made pharmaceuticals for the prevention and treatment of autoimmune diseases:where are we[J].Expert Rev Vaccines,2010,9(8):957-969.DOI:10.1586/erv.10.82
[10]Decker EL,Reski R.Moss bioreactors producing improved biopharmaceuticals[J].Curr Opin Biotechnol,2007,18(5):393-398.DOI:10.1016/j.copbio.2007.07.012
[11]Lindbo JA.TRBO:A high-efficiency tobacco mosaic virus RNA-based overexpression vector[J].Plant Physiol,2007,145(4):1232-1240.DOI:10.1104/pp.107.
[12]Streatfield SJ,Howard JA.Plant production systems for vaccines[J].Vaccine,2003,2(6):763-775.DOI:10.1586/14760584.2.6.763
