干扰素干预HBeAg阴性乙型肝炎疗效中血清HBsAg定量检测的意义
2012-08-20黄成河杨国敬
黄成河,杨国敬
(中国航天科工集团七三一医院,北京 100074)
干扰素干预HBeAg阴性乙型肝炎疗效中血清HBsAg定量检测的意义
黄成河,杨国敬
(中国航天科工集团七三一医院,北京 100074)
我国属HBV感染高流行区,据2006年全国人群乙肝血清流行病学调查,由于乙肝疫苗预防接种工作的开展,我国1-59岁一般人群的乙型肝炎表面抗原(Hepatitis B surface antigen,HBsAg)携带率已由9.75%降至7.18%[1]。但由于我国的人口基数大,HBV感染及所致疾病仍然是一个严重的社会公共卫生问题。
慢性乙型肝炎(Chronic hepatitis B,CHB)主要为抗病毒干预,干扰素和核苷(酸)类似物为临床干预一线用药。目前用于临床干预的干扰素为普通干扰素α(IFN-α)和聚乙二醇化干扰素α(PegIFN-α),其主要通过直接抗病毒作用及诱导机体的免疫反应以达到清除病毒的效果。干扰素干预的优点在于疗程相对固定、可获得乙型肝炎e抗原(Hepatitis B e antigen,HBeAg)血清学转换、持续病毒学应答(sustained virological response,SVR)、HBsAg 消失率或血清学转换以及不会产生病毒耐药变异[2]。但是患者应答率低、需要注射给药、明显的不良反应、以及抑制HBV DNA不如核苷类药物作用强和起效快限制了其在临床的应用[3]。
本研究对聚乙二醇干扰素α-2a(PegIFNα-2a)干预过程中患者血清HBsAg水平进行动态监测,探讨其临床意义。
1 材料与方法
1.1 研究对象慢性乙型肝炎患者为既往乙型肝炎病史或HBsAg阳性超过6个月并且肝组织学检查有肝炎病变,诊断均符合《慢性乙型肝炎防治指南》标准[4]。36例 HBeAg阴性患者以 PegIFNα-2a 180μg/周干预48周,其中男29例,女7例,年龄18-65岁(平均43岁)。病例纳入标准:①HBV DNA≥2000IU/mL;②干预前血清 ALT水平持续升高,ALT≥80U/L且≤400U/L,血清总胆红素<51.4μmol/L;③血清 HBsAg阳性;④HBeAg阴性;⑤在干预前半年内没有接受过抗病毒干预;⑥排除HCV感染等其他慢性肝病;⑦临床无失代偿性肝硬化或肝细胞癌;⑧排除有严重心、肺、肾、血液、内分泌等病变及精神异常病史;⑨非妊娠及哺乳期妇女。
1.2 干预应答判断病毒学应答:血清HBV DNA检测不到;持续应答:干预结束后随访24周HBV DNA检测不到;复发:干预结束时HBV DNA检测不到,但是停药后24周HBV DNA升高或阳转;无应答:干预结束时HBV DNA无改善。
1.3 实验室检测血清中HBV DNA定量按照HBV核酸定量检测试剂盒(深圳凯杰生物工程有限公司)说明书操作,用LightCycler 480实时荧光定量PCR仪(美国Roche公司)进行测定。血清HBsAg定量按照化学发光微粒子免疫测定方法(Chemiluminescent microparticle immunoassay,CMIA)试剂盒(美国Abbott公司)说明书操作,用Architect i2000型免疫发光分析仪 美国Abbott公司)进行测定。监测点为基线,干预中(12、24和48周)及干预后(72周)。
1.4 统计学处理应用SPSS 16.0统计软件进行数据分析。计数资料用百分数,计量资料以均数±标准差表示;两组间计量资料比较用t检验,计数资料比较用χ2检验,P<0.05有统计学意义。
2 结果
2.1 基线值测定对患者临床指标基线水平,包括年龄、血清 ALT水平、HBV DNA及 HBsAg与PegIFNα-2a干预后是否获得SVR进行了统计学分析(见表1)。血清ALT基线水平与PegIFNα-2a干预后持续病毒学应答相关,SVR组血清ALT水平高于未获得SVR组,差异有统计学意义(P<0.05),年龄、HBV DNA及 HBsAg基线值差异无统计学意义。
2.2 病毒学应答36例患者有21例(58%)干预结束时产生病毒学应答,15例(42%)无病毒学应答。干预结束后随访24周,有8例(25%)获得SVR,13例(36%)复发。不同应答组血清 HBV DNA水平见图1。在干预第12、24和48周,SVR组 HBV DNA下降分别为3.9±1.3、4.1±1.7和4.1±1.8log10IU/mL,无应答组为2.6±1.4、2.4±1.5和2.3±1.6log10IU/mL(图1A),复发组为3.0±1.9、3.4±1.4和3.4±1.5log10IU/mL(图1B)。SVR组HBV DNA降低与无应答组比较差异有统计学意义(P<0.05),与复发组之间差异未见统计学意义。

表1 36例HBeAg阴性患者干预前临床指标测定

图1 A)持续病毒学应答(SVR)组和无应答组患者血清中HBV DNA水平;B)持续病毒学应答(SVR)组和复发组患者血清中HBV DNA水平。血清中HBV DNA最低检出限为500IU/mL(2.70log10IU/mL)。
2.3 血清中HBsAg定量干预前SVR组和未获得SVR组患者血清中HBsAg水平无差别,分别为3.5±0.8log10IU/mL和3.5±0.6log10IU/mL。PEG-IFNα-2a干预第12周、24周和48周,SVR组患者血清 HBsAg下降分别为0.8±0.6、1.3±0.7和2.1±1.3log10IU/mL,比无应答组(图2A)和复发组(图2B)显著降低。
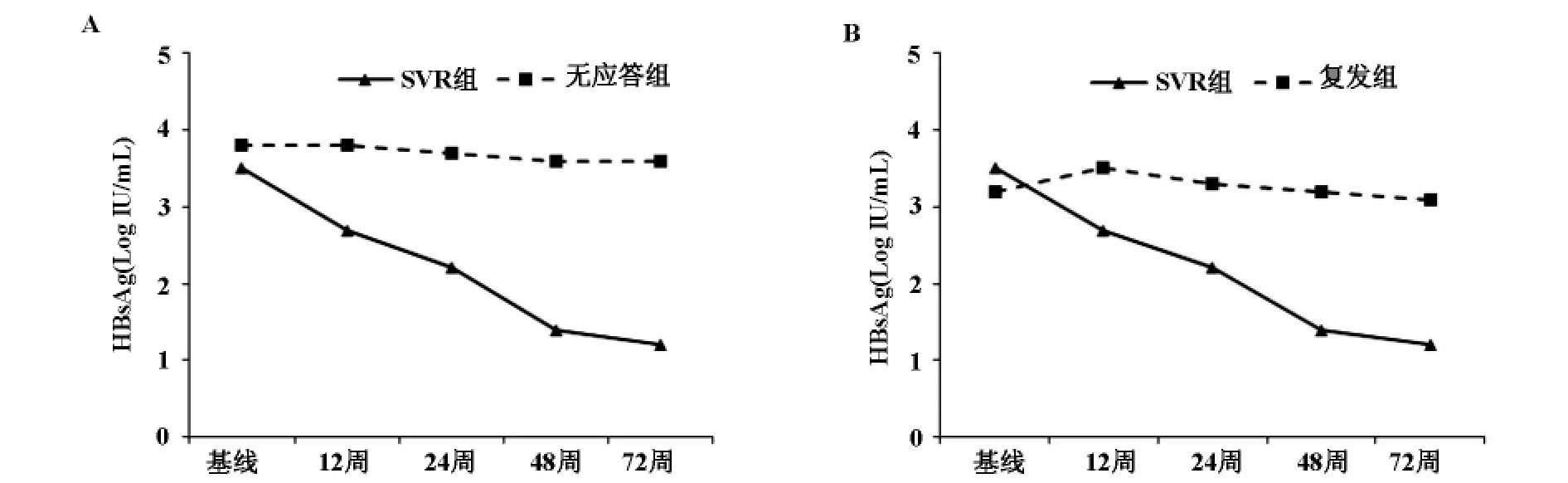
图2 A)持续病毒学应答(SVR)组和无应答组患者血清中HBsAg水平;B)持续病毒学应答(SVR)组和复发组患者血清中HBsAg水平。
3 讨论
HBeAg阴性慢性乙型肝炎患者由于HBV基因前核/核心启动子区变异导致HBeAg减少或消失。这类患者预后差、低自发清除率以及高复发率导致持续病毒学应答率低,尤其是对于核苷类药物的抗病毒干预。Marcellin等5用PegIFNα-2a、拉米夫定或PegIFNα-2a拉米夫定联合用药分别干预HBeAg阴性CHB患者。研究结果显示,PegIFNα-2a干预组19%的HBeAg阴性患者获得持续病毒学应答,3年随访数据显示有12%的患者HBV DNA水平在低于检测下限(400copies/mL)以及每年递增的HBsAg消失率。由此可见,对于这类患者用干扰素干预比需要长期服药来维持病毒抑制的核苷(酸)类似物具有一定的优势。PegIFNα-2a干预结束时有63%的患者出现病毒学应答,却只有19%的患者在干预结束24周后获得持续病毒学应答。因此,在干预早期亟需明确的指标来预测干扰素抗病毒干预效果,进而帮助临床医生判断是否继续干扰素的干预。
近年来随着免疫发光检测技术在临床实验室的应用及定量试剂的上市,HBsAg定量已成为重要的临床检测实验[6]。HBsAg定量比HBV DNA检测花费少并且具备高通量的完全自动化检测能力,不仅是HBV感染重要的血清学标志物,也可用于预测临床预后和抗病毒干预效果。近来研究表明,PegIFN-α能够比核苷类药物更迅速地降低血清HB-sAg水平,PegIFN-α治疗获得持续病毒学应答的中,HBsAg水平均显著降低[7,8]。
本研究以PegIFNα-2a对HBeAg阴性CHB患者进行干预,发现干预第12、24和48周SVR组患者血清中HBV DNA下降均高于无应答组,可据此观察患者对干预的病毒学应答情况。但是治疗结束时,21例(58%)产生病毒学应答,其中13例(36%)复发。仅仅根据血清HBV DNA下降的指标并不能明确干预结束后患者能否获得持续病毒学应答。我们对干预期间患者血清HBsAg动态监测,研究结果发现SVR组患者血清中HBsAg下降高于无应答和复发组。因此,血清中HBsAg水平不仅可以明确临床干预效果,而且监测早期HBsAg水平还可预测患者能否获得持续病毒学应答。
综上所述,血清中HBsAg定量检测在评价CHB抗病毒干预中起到重要的作用,对HBeAg阴性患者监测HBsAg水平不仅可预测临床干预效果,并且可根据应答指导干预以提高干预方法的成本效益。
[1]Liang X,Bi S,Yang W,et al.Epidemiological serosurvey of hepatitis B in China-declining HBV prevalence due to hepatitis B vaccination[J].Vaccine,2009,27:6550.
[2]Perrillo RP.Therapy of hepatitis B-viral suppression or eradication[J]?Hepatology,2006,43(Suppl 1):S182.
[3]P Marcellin,GKK Lau,F Bonino,et al.Peginterferon Alfa-2aA-lone,Lamivudine Alone,and the Two in Combination in Patients with HBeAg-Negative Chronic Hepatitis B[J].N Engl J Med,2004,351:1206.
[4]中华医学会肝病学分会,中华医学会感染病学分会.慢性乙型肝炎防治指南[J].肝脏,2005,10:348.
[5]Marcellin P,Bonino F,Lau GK,et al.Sustained response of hepatitis B e antigen-negative patients 3years after treatment with peginterferon alpha-2a[J].Gastroenterology,2009,136:2169.
[6]Kohmoto M,Enomoto M,Tamori A,et al.Quantitative detection of hepatitis B surface antigen by chemiluminescent microparticle immunoassay during lamivudine treatment of chronic hepatitis B virus carriers[J].J Med Virol,2005,75:235.
[7]Brunetto MR,Moriconi F,Bonino F,et al.Hepatitis B virus surface antigen levels:aguide to sustained response to peginterferon alfa-2ain HBeAg-negative chronic hepatitis B[J].Hepatology,2009,49:1141.
[8]Wong VW,Wong GL,Yan KK,et al.Durability of peginterferon alfa-2btreatment at 5years in patients with hepatitis B e antigenpositive chronic hepatitis B[J].Hepatology,2010,51:1945.
1007-4287(2012)10-1897-03
2011-09-11)
