Agkihpin对人肝癌SMMC-7721细胞COX-2、MRP1和E-CD表达的影响
2012-07-31胡启平许淑茹黄程新袁志刚
胡启平,许淑茹,黄程新,马 军,方 玲,袁志刚
(1广西医科大学细胞生物学与遗传学教研室,南宁 530021;2漳州卫生职业学院)
近年来,蛇毒的抗肿瘤作用重新引起了国内外学者的关注[1~3]。精氨酸酯酶(Arginine Esterase,AEase)广泛存在于蝰科蛇类的蛇毒中蛇毒精氨酸酯酶(Agkihpin)是我们前期研究中从蝮蛇毒中自行分离纯化并命名的一种AEase,其为电泳纯,约25.46 kD[4],可下调抑制人鼻咽癌 CNE-2 细胞系中环氧合酶-2(Cyclooxygenase,COX-2)、表皮钙黏素(Epidermal cadherin,E-CD)和多药耐药相关蛋白1(Multidrug resistance associated proteins 1,MRP1)的转录和表达[5~7],并抑制鼻咽癌细胞的活力、增殖和迁移[8]。以往有研究发现,从蝮蛇毒中分离出来的AEase活性峰(非电泳纯)对人肝癌细胞株的杀伤能力比蝮蛇粗毒高5倍[9];我们的前期研究亦发现Agkihpin可抑制人肝癌SMMC-7721细胞株的活力、增殖和迁移。近年研究发现,COX-2、E-CD和MRP1在正常肝组织和肝细胞癌(HCC)组织中转录和表达差异较大,与HCC癌组织分化程度、肿瘤分级和转移关系密切。2011年3~12月,我们观察了Agkihpin对人肝癌 SMMC-7721细胞中 COX-2、MRP1和E-CD表达的影响,旨在进一步探讨Agkihpin影响人肝癌SMMC-7721细胞活力、增殖和迁移的机制。
1 材料与方法
1.1 材料 人肝癌细胞株SMMC-7721(中南大学提供);Agkihpin( 自 行 分 离 纯 化)[4],RPMI1640(GIBCO),0.25% 胰酶(索莱宝公司),新生牛血清(杭州四季青公司),兔抗人COX-2、MRP1和E-CD抗体(北京博奥森公司)、羊抗兔HRP抗体(北京中山公司);免疫组化试剂盒(福州迈新生物公司),RNA提取试剂盒(天根公司),MTT(Sigma公司),逆转录试剂盒(Fermentas公司)等;倒置显微镜(日本Olympus公司),PCR扩增仪为(ABI公司),凝胶成像系统(DIO-RAD公司)。
1.2 实验方法
1.2.1 细胞培养 取人肝癌细胞株 SMMC-7721,用含10%新生牛血清的RPMI1640培养基(添加100 IU/mL青霉素和链霉素),于37℃、5%CO2培养箱中培养,2~3 d换液一次,选用对数生长期的细胞用于下述实验。
1.2.2 细胞干预及 COX-2、E-CD、MRP1 蛋白表达检测 ①免疫细胞化学法:取对数生长期SMMC-7721细胞,以1×105个/mL接种于预置盖玻片的6孔板中,每孔加2 mL的培养基,在37℃、5%CO2培养箱培养24 h,细胞贴壁后分为8组,换置新培养液,分别加入终质量浓度为 4.130、2.065、1.033、0.516、0.413、0.259、0.207 及0.000 g/mL 的 Agkihpin的培养基,培养72 h后PBS洗涤3次,Elivison二步法进行细胞染色:PBS配置的0.5%Triton X-100室温孵育10 min,一抗4℃孵育过夜,PBS洗涤3次,广谱二抗室温孵育30 min,PBS洗涤3次,DAB显色,以PBS代替一抗为空白对照。实验重复3次。染色结果用Image-Pro Plus6.0软件分析,蛋白表达强度用平均吸光密度(Average optical density,AOD)表示;按公式计算下调率(Down-regulated rate,DRR):DRR=(AOD对照组-AOD实验组)/AOD对照组×100%。②Western blotting法:取对数生长期SMMC-7721细胞,以1×105/mL接种于100 mL培养瓶,37℃、5%CO2培养箱培养24 h。细胞贴壁后分为8组,同上加入含Agkihpin的培养基培养72 h,用RAPI裂解液提取蛋白,用BCA试剂盒测定蛋白含量。以每样品总量20 μg蛋白于8%SDSPAGE凝胶电泳,采用半干式转印法将蛋白转印到PVDF膜上,0.5 mA恒流电转移30 min;滤膜经5%脱脂奶粉于室温下封闭1 h;加一抗4℃孵育过夜;洗膜,辣根过氧化物酶标记的二抗与PVDF膜于室温下孵育2 h;充分漂洗,ECL显色试剂盒显色,对显色条带进行光密度分析,以目的基因与内参基因βactin的光密度比值(Ratio of AOD,RAOD)作为COX-2、E-CD及MRP1蛋白的相对表达量;同上计算DRR。
1.2.3 细胞干预及 COX-2、E-CD、MRP1 mRNA 转录检测 细胞培养及干预方法同1.2.2。检测步骤:①引物:根据GenBank数据库提供的mRNA序列信息,采用 Primer Premier5.0软件设计引物,经BLAST比对后由上海生工生物工程有限公司合成。COX-2:5'-TCCTCCTGTGCCTGATGATTG-3',5'-AAACTGATGCGTGAAGTGCTG-3',172 bp;MRP1:5'-TC TACTTCTTCGTCCAGAGGTTCT-3',5'-CTCAGTCTCTGAATACTCCTTGAGC-3',440 bp;E-CD:5'-CTGAT TCTGCTGCTCTTGCTGTT-3',5'-TCAAAGTCCTGGTCCTCTTCTCC-3',137 bp; β-actin:5'-AACTCCATCATGAAGTGTGA-3',5'-ACTCCTGCTTGCTGATCCAC-3',247 bp。②RNA提取和 cDNA合成:按 RNA提取试剂盒说明书提取肝癌细胞总RNA,经琼脂糖凝胶电泳鉴定其完整性,通过紫外分光光度计测定260、280 nm处光密度值,计算RNA纯度与浓度。根据MBI公司RT试剂盒操作说明将RNA逆转录为cDNA,保存于-70℃冰箱备用。③基因转录水平检测:采用RT-PCR法。反应体系25 μL:其中10× buffer 2.5 μL,25 mM/L MgCl22 μL,10 mM/μL dNTP 2 μL,10 pmol/μL 上、下游引物各 1 μL,cDNA模板2 μL,Taq 聚合酶 0.3 μL,再用 ddH2O 补足至25 μL。PCR循环参数:95℃预变性5 min,94℃变性30 s,55 ℃退火30 s,72 ℃ 延伸30 s,扩增35 个循环,72 ℃后延伸5 min。取RT-PCR 产物5 μL,在1.5%琼脂糖凝胶上进行电泳,溴化乙锭显色,置自动凝胶成像分析系统中照相,分别取目的基因与内参基因β-actin RT-PCR产物电泳条带灰度比值(Ratio of gray value of electrophoresis strip,RGVES),作为目的基因mRNA的相对含量。DRR计算同上。
1.3 统计学方法 应用SPSS13.0软件进行统计学处理。计量数据采用±s表示。计量资料多组比较经方差齐性检验,方差齐者采用方差分析(Oneway ANOVA),两两比较采用LSD法。检验水准α=0.05。
2 结果
2.1 COX-2蛋白表达 ①AOD:COX-2阳性染色颗粒主要位于SMMC-7721细胞质中,呈棕黄色或浅黄色,以PBS代替一抗的阴性对照染色结果显示无阳性表达(图1);COX-2蛋白的AOD随Agkihpin质量浓度上升而下降(R2=0.909 3),呈一定程度浓度依赖性;与质量浓度为0者比较其余质量浓度组表达均显著下降(P<0.01),见图 1和表 1。②RAOD:COX-2蛋白的RAOD随Agkihpin质量浓度上升而下降(R2=0.961 4),呈一定程度浓度依赖性,且与质量浓度为0者比较其余质量浓度组表达均显著下降(P<0.01),见表1和图2A。
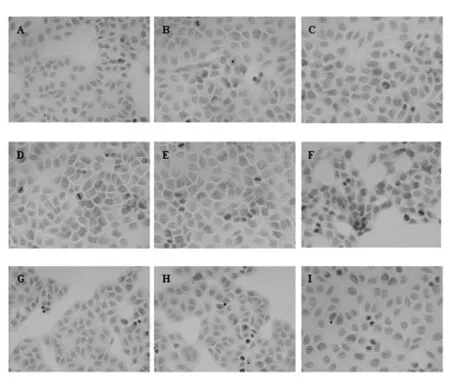
图1 免疫细胞化学法检测SMMC-7721细胞中COX-2蛋白表达(×400)
2.2 COX-2 mRNA转录 COX-2的 RGVES值随Agkihpin质量浓度上升而下降(R2=0.984),呈一定程度浓度依赖性,且与质量浓度为0者比较其余质量浓度组表达均显著下降(P<0.01),见表1和图2B。
表1 不同质量浓度Agkihpin作用72 h后SMMC-7721细胞 COX-2 表达(±s)
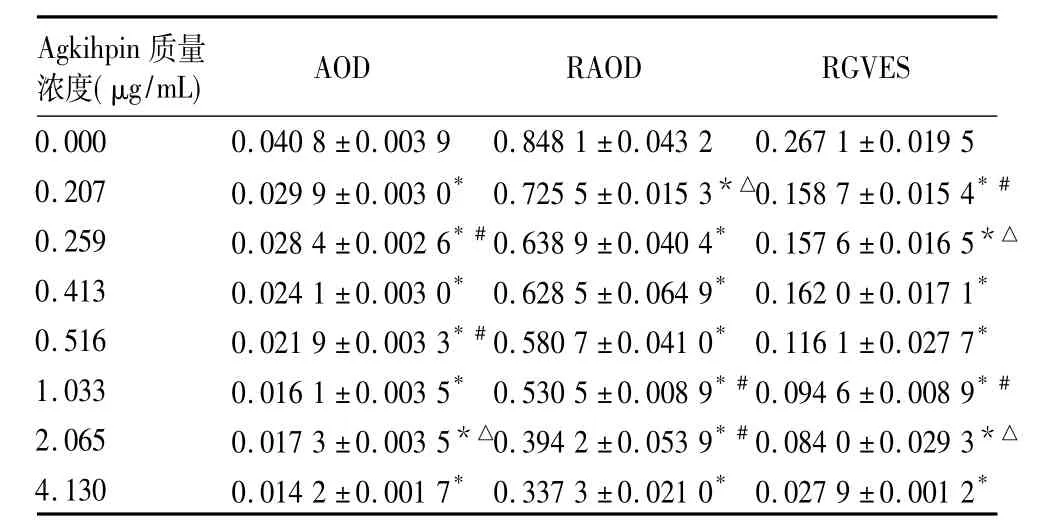
表1 不同质量浓度Agkihpin作用72 h后SMMC-7721细胞 COX-2 表达(±s)
注:与质量浓度为0者比较,*P<0.01;与上一质量浓度比较,△P<0.05,#P <0.01
Agkihpin质量浓度(μg/mL)AOD RAOD RGVES 0.000 0.040 8 ±0.003 9 0.848 1 ±0.043 2 0.267 1 ±0.019 5 0.207 0.029 9 ±0.003 0* 0.725 5 ±0.015 3*△0.158 7 ±0.015 4*#0.259 0.028 4 ±0.002 6*#0.638 9 ±0.040 4* 0.157 6 ±0.016 5*△0.413 0.024 1 ±0.003 0* 0.628 5 ±0.064 9* 0.162 0 ±0.017 1*0.516 0.021 9 ±0.003 3*#0.580 7 ±0.041 0* 0.116 1 ±0.027 7*1.033 0.016 1 ±0.003 5* 0.530 5 ±0.008 9*#0.094 6 ±0.008 9*#2.065 0.017 3 ±0.003 5*△0.394 2 ±0.053 9*#0.084 0 ±0.029 3*△4.130 0.014 2 ±0.001 7* 0.337 3 ±0.021 0* 0.027 9 ±0.001 2*
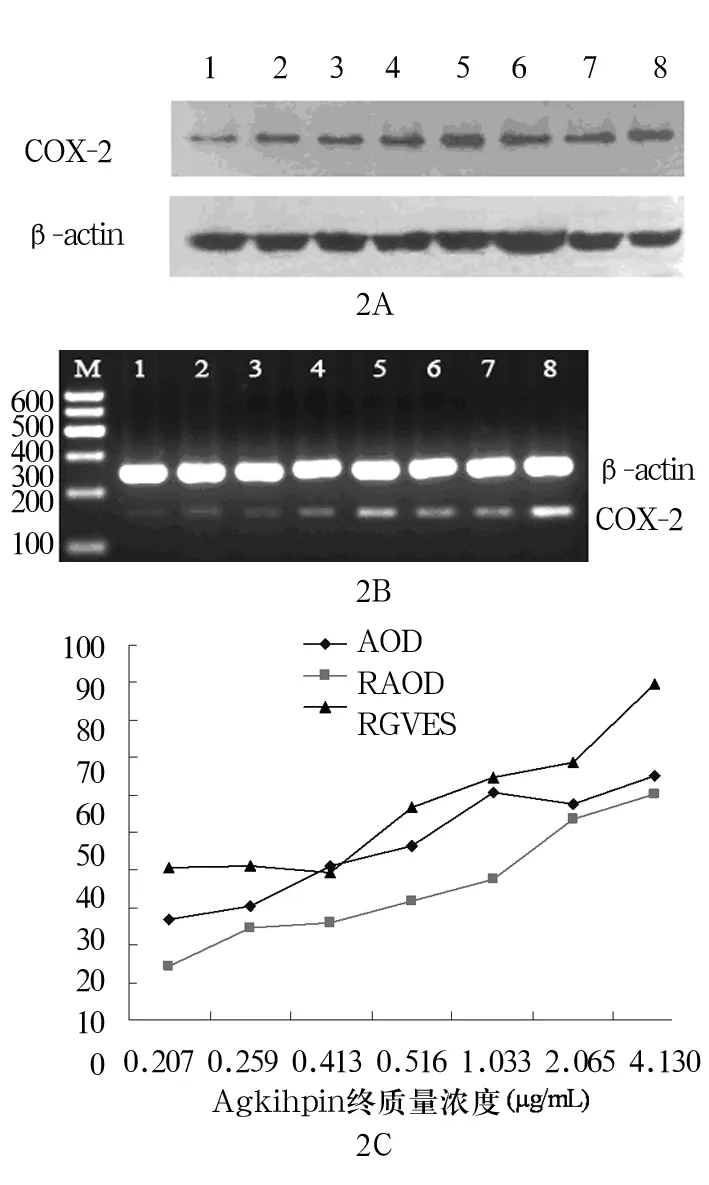
图2 不同质量浓度Agkihpin处理后SMMC-7721细胞COX-2 mRNA表达
2.3 COX-2、MRP1、E-CD 之间的蛋白表达和 mRNA转录的关系 Agkihpin作用72 h后,SMMC-7721细胞中COX-2与E-CD的蛋白表达和mRNA转录呈负相关,MRP1与E-CD的蛋白表达和mRNA转录呈负相关,COX-2与MRP1的蛋白表达和mRNA转录呈正相关(细胞免疫化学法、Western Blotting和RT-PCR法检测结果的相关系数r分别为0.960 1、0.947 4 和 0.943 9)。见图 3A、3B(MRP1和E-CD蛋白表达和mRNA转录的具体数据另文详细发表)。
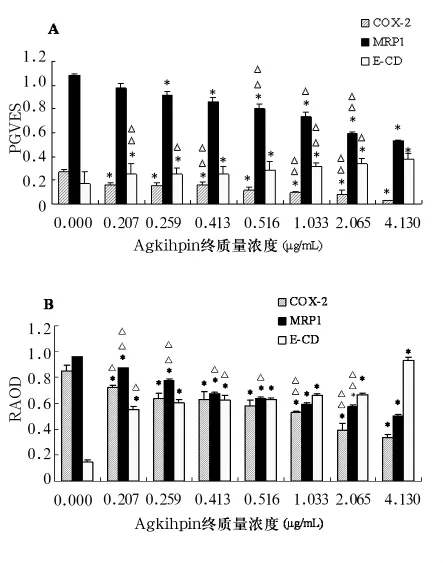
图3 不同浓度Agkihpin作用72 h后SMMC-7721细胞COX-2、MRP1、E-CD的蛋白和mRNA表达
3 讨论
多项研究显示,Agkihpin可影响人肝癌SMMC-7721细胞活力、增殖和迁移,但具体机制不明。COX-2是人体内花生四烯酸代谢过程中的限速酶,一般在受促癌剂或癌基因产物等因素刺激时迅速合成,因此COX-2在HCC癌组织中的表达均显著高于癌旁组织和正常肝组织[10~11]。其作用机制包括促进肿瘤细胞增殖,抑制凋亡;增加金属蛋白酶-2的活性,溶解胞外基质,促进肿瘤的浸润等。本研究免疫细胞化学、Western blotting和RT-PCR检测显示,COX-2的 AOD、RAOD及RGVES均随Agkihpin质量浓度上升而下降,呈一定程度浓度依赖性,且与质量浓度为0者比较其余质量浓度组表达均显著下降。提示Agkihpin可在体外条件下显著下调细胞中COX-2的蛋白表达和基因转录水平,且呈一定浓度依赖性。此可能为其抑制SMMC-7721细胞增殖和迁移的机制之一。研究显示,癌组织中COX-2表达高者术后生存率低,且无瘤生存期也较短[12]。故Agkihpin可考虑作为提高肝癌患者术后生存率、抑制肝肿瘤形成的药物。本研究还显示,免疫细胞化学法和Western blotting检测的COX-2蛋白表达水平DRR不一致,前者稍高。可能原因为免疫细胞化学法检测时显微镜下目标视野的选定主观性较强,而Western blotting检测的是培养细胞整体的蛋白表达水平,因此后者结果更可信[6]。鉴于Agkihpin可下调COX-2 mRNA转录,说明Agkihpin可通过某一信号通路将其COX-2表达调节作用转导进入SMMC-7721细胞。此外,本研究中免疫细胞化学法及Western blotting所测COX-2的DRR均明显低于RT-PCR所测结果。推测Agkihpin还参与了COX-2的翻译调节,可使COX-2的翻译上调。本研究中图3还显示,Agkihpin作用后各组 MRP1蛋白表达和基因转录水平均比较相近,而COX-2和ECD的蛋白表达水平均比基因转录水平高出许多。提示Agkihpin亦参与了E-CD的翻译调节。
Oshima等认为COX-2基因可能与腺瘤性息肉病(Adenomatous polyposis coli,APC)基因相关联,而APC基因产物又与E-CD的配体β-连环素相关联,提示Agkihpin也可能通过APC调控COX-2和E-CD表达。有研究表明,部分AEase具有磷酯酶A2(Phospholipase A2,PLA2)特性[13],而在人的多种组织细胞中均可检测到PLA2 M型受体[14],蛇毒中部分PLA2可与PLA2 M型受体结合产生细胞因子、趋化因子和激素而起抗肿瘤作用[15]。Agkihpin有可能作为一种PLA2与SMMC-7721细胞膜上的PLA2 M型受体结合,通过PLA2信号转导途径调节COX-2的转录和翻译水平。此外,Agkihpin具有胰蛋白酶活性,能消化细胞基质和细胞表面蛋白[8],对于MRP1和E-CD等表达在细胞膜上和(或)细胞内的蛋白[6,7],其转录和表达的调节可能是胰蛋白酶活性和PLA2信号转导途径综合作用的结果;而对于COX-2等仅在细胞质中表达的蛋白,其表达调节可能以PLA2信号转导途径为主。具体机制尚待深入研究。Lu等[16]认为,COX-2表达上调可引起前列腺素合成增加,诱导PKC表达,进而诱导MRP1表达,Agkihpin可能间接通过下调COX-2表达下调MRP1的转录和表达。本研究显示,Agkihpin作用72 h后,SMMC-7721细胞中COX-2与E-CD蛋白表达呈负相关,MRP1与E-CD的蛋白和mRNA表达呈负相关,COX-2与MRP1的蛋白和mRNA表达呈正相关,与上述文献一致。
MRP1过度表达是产生肿瘤耐药的主要原因[17],细胞耐药程度与MRP1表达强度呈明显正相关[18]。本研究显示,Agkihpin 作用后 SMMC-7721细胞 MRP1表达量下调。提示Agkihpin可降低SMMC-7721细胞对细胞毒性物质的排除能力,使细胞损伤加剧。此可能是Agkihpin能降低SMMC-7721细胞活力的原因之一。MRP反义RNA可有效封闭MRP基因表达,在体外实验中能增加人肝癌SMMC-7721耐药细胞株对化疗药物的敏感性,对肝癌耐药细胞的多药耐药表型有较好的逆转作用[19]。故Agkihpin可通过下调SMMC-7721细胞的MRP1表达,在一定程度上提高肝癌细胞对化疗药物的敏感性、逆转肝癌耐药细胞的多药耐药表型。E-CD在正常肝组织中表达,在肝癌组织中表达程度减弱或缺失[20],高转移潜能肝癌细胞E-CD表达较低转移肝癌细胞明显降低[21],癌组织中E-CD黏附系统受到干扰、破坏可触发癌细胞的浸润和转移[22]。提示E-CD表达下调或缺失是促进肿瘤细胞浸润和转移的重要因素[23~24]。本研究显示,Agkihpin 作用后SMMC-7721细胞中E-CD基因转录和蛋白表达水平均显著上调,且呈一定程度的剂量依赖性。提示Agkihpin可能通过上调细胞表面E-CD表达,进一步使其与α-/β-/γ-连环蛋白形成复合物,加强E-CD介导的细胞—细胞间、细胞—介质间的黏附,避免细胞与介质间脱离。此可能是Agkihpin抑制肝癌SMMC-7721细胞迁移的主要原因。
综上所述,Agkihpin可通过下调 MRP、COX-2表达及上调E-CD表达抑制人肝癌SMMC-7721细胞的的活力、增殖和迁移,有望用于提高肝癌细胞对化疗药物的敏感性、逆转肝癌耐药细胞的多药耐药表型、提高肝癌患者术后生存率、抑制肝癌细胞的浸润和转移。
[1]Jokhio R,Ansari AF.Cobra snake venom reduces significantly tissue nucleic acid levels in human breast cancer[J].Journal Pakistan Medical Association,2005,(55):71-73
[2]Stephen S,Fritz C,Radu M,et al.Intravenous liposomal delivery of the snake venom disintegrin contortrostatin limits breast cancer progression[J].Pak J Physiol,2006,2(1):499-511.
[3]李振南,张小燕,芮景.蛇毒抗高凝状态酶对种植肝癌H22小鼠肿瘤抑制作用的研究[J].实用临床医药杂志,2007,11(3):45-48
[4]胡启平,舒雨雁.江浙蝮蛇毒精氨酸酯酶Agkihpin的研究:Ⅰ、分离纯化和初步表征[J].四川动物,2006,25(2):251-256.
[5]胡启平,许淑茹,马军,等.蛇毒精氨酸酯酶Agkihpin对人鼻咽癌CNE-2细胞系环氧合酶-2表达的影响研究[J].中国全科医学,2011,14(24):2761-2764.
[6]许淑茹,马军,袁志刚,等.蛇毒精氨酸酯酶Agkihpin对人鼻咽癌CNE-2细胞系MRP1表达的影响[J].肿瘤防治研究,2011,38(7):731-735.
[7]许淑茹,马军,袁志刚,等.蛇毒精氨酸酯酶Agkihpin对人鼻咽癌CNE-2细胞系E-钙粘素表达的影响[J].中华全科医学,2011,9(4):503-504,507.
[8]胡启平,舒雨雁.江浙蝮蛇毒精氨酸酯酶Agkihpin的研究:Ⅱ.对鼻咽癌细胞活力、增殖、迁移和细胞形态的影响[J].四川动物,2006,25(2):257-260.
[9]陈清澄,刘广芬,王晴川.蝮蛇蛇毒柱层析分离及生化药理作用[J].福建医学院学报,1994,28(2):134-136.
[10]陈连周,夏金堂,李雯,等.肝细胞肝癌中环氧合酶-2与半胱氨酸蛋白酶-3的表达及意义[J].中华临床医师杂志(电子版),2008,2(10):1128-1134.
[11]Koga H,Sakisaka S,Ohishi M,et al.Expression of cyclooxygenase-2 in human hepatocellular carcinoma:relevanee to tumor dedifferentiation[J].Hepatology,1999,29(3):688-696.
[12]Kondo M,Yamammoto H,Nagamo H,et al.Increased expression of COX-2 in non tumor liver tissue is associated with hepatoceluller carcinoma[J].Clin Cancer Res,1999,5(12):4005-4012.
[13]Zhang QY,Wang JY,Han Y,et al.Identification of a novel thrombin-like phospholipase A2 from Gloydius ussuriensis snake venom[J].Blood Coagul Fibrinolysis,2007,18(8):723-729.
[14]Boskovic J,Arnold JN,Stilion R,et al.Structural model for the mannose receptor family uncovered by electron microscopy of Endo180 and the mannose receptor[J].J Biol Chem,2006,281(13):8780-8787.
[15]Zuliani JP,Fernandes CM,Zamuner SR,et al.Inflammatory events induced by Lys-49 and Asp-49 phospholipases A2 isolated from Bothrops asper snake venom:role of catalytic activity[J].Toxicon,2005,45(3):335-346.
[16]Lu JK,Wang YQ,Sun YH,et al.Correlation between COX-2 and MRP in NSCLC[J].Chin J Pathophysiol,2008,24(3):605-606,616.
[17]Funato T,Harigae H,Abe S,et al.Assessment of drug resistance in acute myeloid leukemia[J].Expert Rev Mlo Diagn,2004,4(5):705-713.
[18]Konig J,Hartel M,Nies AT,et al.Expression and localization of human multidrug resistance protein(ABCC)family members in pancreatic carcinoma[J].Int J Cancer,2005,15(3):359-367.
[19]陈琳,苟兴华,严律南,等.重组腺病毒介导MRP反义RNA对人肝癌耐药细胞株MDR表型逆转的实验研究[J].实用肿瘤杂志,2005,20(6):484-489.
[20]闫田静,易永芬,邓玮,等.高尔基体α-甘露糖苷酶Ⅱ和E-钙黏素在正常肝组织及肝癌组织中的表达及其意义[J].中国生物制品学杂志,2011,24(5):534-537,546.
[21]张传海,许戈良,荚卫东,等.缺氧诱导因子-1α与上皮型钙黏素在肝癌中的表达及其意义[J].安徽医科大学学报,2011,46(4):337-341.
[22]Becker KF,Kremmer E,Eulitz M,et al.Functional allelic loss detected at the protein level in archival human tumours using allelespecific E-cadherin monoclonal antibodies[J].Pathol,2002,197(5):567-574.
[23]Fukunaga Y,Liu HJ,Shimizu M,et al.Defining the Roles of beta-catenin and Plakoglobin in Cell-cell Adhesion:Isolation of betacatenin/plakoglobin-deficient F9 Cells[J].Cell Struct Funct,2005,30(2):25-34.
[24]Shen XD,Kramer RH.Adhesion-mediated squamous cell carcinoma survival through ligand-independent activation of epidermal growth factor receptor[J].Am J Pathol,2004,165(4):1315-1329.
