两种关键信号转导通路活性状态与K562细胞对DNR、Ara-C敏感性的关系
2012-07-31
(广州医学院第一附属医院,广州 510120)
近年来研究发现,白血病存在Ras/磷脂酰肌醇-3-激酶(PI3K)/蛋白激酶人第10染色体缺失磷酸酶及张力蛋白同源基因(PTEN)/蛋白激酶(Akt)/哺乳动物雷帕霉素靶体蛋白(mTOR)和(或)Ras/Raf/细胞外信号调节酶(MEK)/丝裂原活化蛋白激酶(ERK)等关键信号转导通路的异常[1,2]。磷酸化蛋白如 p-Akt和 p-ERK1/2 的激活,会使肿瘤细胞增殖潜能、逃避凋亡和免疫杀伤的能力增强,肿瘤细胞增殖失控,对诱导凋亡的药物敏感性下降并导致耐药性产生[3,4]。这些信号转导通路的磷酸化蛋白有望作为分子靶向治疗的位点之一。2011年10~12月,本研究对粒细胞白血病细胞株K562采用通路靶点抑制剂U0126(MEK抑制剂)、LY294002(PI3K抑制剂)和雷帕霉素(mTOR抑制剂)以及激活剂佛波酯(PMA,ERK激活剂)进行处理,观察两种关键信号通路的活性状态与K562细胞对柔红霉素(DNR)和阿糖胞苷(Ara-C)敏感性的关系。现报告如下。
1 材料与方法
1.1 实验材料 RPMI1640和胎牛血清购自美国Gibco公司;细胞固定液(含16%甲醛)、细胞破膜液Ⅲ(含90%甲醇)、Stain Buffer、Annexin Ⅴ/PI凋亡试剂盒购自美国Becton Dickinson公司;IGG1鼠抗人单克隆抗体、p-Akt T308-PE、p-Akt S473-Alexa 647、p-ERK1/2-Alexa 488购自美国Becton Dickinson公司;U0126、LY295002、雷帕霉素、佛波酯(PMA)购自美国Sigma公司;柔红霉素购自深圳万乐公司;阿糖胞苷购自哈尔滨莱博通公司;K562由广州医学院附属肿瘤医院生物工程室馈赠。
1.2 细胞培养及分组 将K562置于含有15%胎牛血清(FPS)的RPMI1640培养液中,在37℃、含5%CO2、饱和湿度的恒温孵育箱中培养,取对数生长期细胞进行实验。用含有10%FPS的RPMI1640重悬K562细胞,使细胞密度达到(1~5)×106/mL。将细胞分为5个组,经U0126、LY294002、雷帕霉素处理的细胞分别为抑制剂A、B、C组,经PMA刺激的细胞为激活剂组,未作处理者为对照组。
1.3 K562中磷酸化蛋白的检测 细胞内磷酸化蛋白抗体标记:IGG1阴性对照管为IGG1-Alexa 488/IGG1-PE/IGG1-Alexa 647;磷酸化抗体标记管为p-ERK1/2-Alexa 488/p-Akt T308-PE/p-Akt S473-Alexa 647。根据所标记单抗使用要求,K562分别予固定、破膜处理后[1],加入上述单抗进行胞内磷酸化信号蛋白的标记。采用磷酸化流式细胞术检测K562中的 p-ERK1/2、p-Akt T308 和 p-Akt S473。
1.4 细胞凋亡检测 将5组细胞分别加入DNR、Ara-C,对照组不加药。细胞于37℃、5%CO2环境中孵育48 h。采用AnnexinⅤ/PI标记法检测细胞凋亡率。取细胞密度为(1~5)×106/mL的细胞悬液1 mL,分别加入AnnexinⅤ和PI,混匀,室温避光孵育15 min。加入Wash Buffer上流式细胞仪检测。
1.5 统计学方法 采用SPSS17.0统计软件。计量数据以±s表示,组间比较采用t检验。P≤0.05为差异有统计学意义。
2 结果
2.1 各组K562中磷酸化蛋白的表达变化 见表1。
表1 各组K562中磷酸化蛋白的表达变化(%,±s)
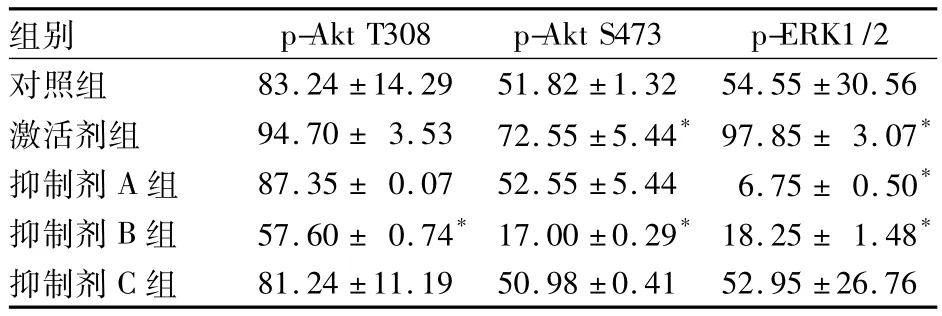
表1 各组K562中磷酸化蛋白的表达变化(%,±s)
注:与对照组相比,*P <0.05
组别p-Akt T308 p-Akt S473 p-ERK1/2对照组83.24 ±14.29 51.82 ±1.32 54.55 ±30.56激活剂组 94.70 ± 3.53 72.55 ±5.44* 97.85 ± 3.07*抑制剂 A 组 87.35 ± 0.07 52.55 ±5.44 6.75 ± 0.50*抑制剂 B 组 57.60 ± 0.74* 17.00 ±0.29* 18.25 ± 1.48*抑制剂C组81.24 ±11.19 50.98 ±0.41 52.95 ±26.76
2.2 Ara-C和DNR作用后各组K562细胞凋亡率比较 见表2。
表2 Ara-C和DNR作用后各组K562细胞凋亡率比较(%,±s)

表2 Ara-C和DNR作用后各组K562细胞凋亡率比较(%,±s)
注:与对照组相比,*P <0.05
组别 K562细胞凋亡率Ara-C作用后 DNR 作用后对照组65.15 ±0.21 58.50 ±0.57激活剂组 48.10 ±2.83* 23.40 ±2.78*抑制剂 A 组 63.80 ±0.15 89.70 ±3.12*抑制剂 B 组 72.60 ±2.07* 79.70 ±1.26*抑制剂 C 组 82.50 ±0.33* 88.60 ±2.04*
3 讨论
Ras/PI3K/Akt/mTOR是标准的生存通路,在白血病等多种恶性肿瘤中被激活。其初级效应分子Akt激活后转入核内磷酸化一系列胞内底物,这些底物参与调控细胞凋亡、细胞周期进程、转录和转化[5]。实验证明,与没有Akt激活的细胞相比,存在Akt活化的细胞株在化疗药物的作用下增殖力和集落生成能力增强[6]。研究表明,Ras/PI3K/PTEN/Akt/mTOR通路活化与多种肿瘤发生耐药有关,而阻断Ras/PI3K/Akt/mTOR的磷酸化蛋白表达能快速诱导细胞凋亡,尤其适用于肿瘤的联合治疗[7]。ERKs位于一系列受体的下游,活化转入核内磷酸化其他转录因子[8,9],主要通过下调肿瘤细胞对药物的敏感性从而产生耐药。抑制Ras/Raf/MEK/ERK通路中的Raf和MEK能提高白血病的化疗效果,纠正耐药、改善患者生存质量[10]。
PMA是K562中 p-ERK1/2的强效激活剂[10]。在本研究中,K562经PMA刺激10 min后p-ERK1/2阳性表达明显增强。由于Ras/Raf/MEK/ERK和Ras/PI3K/PTEN/Akt/mTOR信号通路能通过通路间的共同位点(如FLT3-ITD、Ras、CREB等)发生相互作用[10],所以 K562 中 p-Akt T308、p-Akt S473 的表达也有不同程度的升高。通路激活增强后,DNR、Ara-C所诱导的 K562凋亡减少,提示 Ras/PI3K/PTEN/Akt/mTOR和Ras/Raf/MEK/ERK通路与肿瘤细胞抗凋亡、耐药有关,与文献[6]报道一致。
U0126是Ras/Raf/MEK/ERK通路中MEK的抑制剂,能阻止下游的ERKs将膜表面信号转录到胞内,从而阻断通路活化[10]。本研究中,抑制剂A组中p-ERK1/2表达下降,DNR诱导的K562凋亡率与对照组相比明显增加,但Ara-C诱导的K562细胞凋亡率与对照组相近。LY294002是PI3K的抑制剂,能通过级联反应特异性抑制Akt的磷酸化[11]。我们采用LY294002作用K562后,细胞中p-Akt表达明显降低,证明LY294002可以抑制p-Akt表达。DNR和Ara-C作用于抑制剂B组后,细胞凋亡率均较对照组明显增加。雷帕霉素是mTOR抑制剂,它通过与FK506连接蛋白FKBP-12相结合,抑制下游转录因子作用的同时能反向抑制Akt,从而抑制因Ras/PI3K/PTEN/AKT/mTOR通路的异常激活[12,13]。但由于雷帕霉素是作用于 Akt下游的mTOR,所以本研究中我们未能检测到p-Akt表达的下降。DNR和Ara-C分别作用后,抑制剂C组K562凋亡率较对照组均有所升高。上述结果说明,联用Ras/PI3K/PTEN/AKT/mTOR通路抑制剂能增强白血病细胞对DNR和Ara-C的敏感性,抑制Ras/Raf/MEK/ERK通路能增强DNR的抗肿瘤效应,但对Ara-C诱导的细胞凋亡的作用不明显。
有学者发现,抑制Ras/PI3K/PTEN/Akt/mTOR和Ras/Raf/MEK/ERK通路能提高ADM和紫杉醇等药物对伴有信号转导通路异常激活的肿瘤的治疗效果[6]。本研究中DNR作用后抑制剂A、B组的细胞凋亡率均较对照组增加,说明抑制 Ras/PI3K/PTEN/Akt/mTOR和Ras/Raf/MEK/ERK通路能增强K562对DNR的敏感性。联用Ras/PI3K/PTEN/Akt/mTOR通路抑制剂也增强了Ara-C的抗肿瘤效应。提示Ras/PI3K/PTEN/AKT/mTOR和Ras/Raf/MEK/ERK通路激活与肿瘤对蒽环类药物耐药的产生有关,联用通路抑制剂不仅能纠正耐药,还可降低化疗药使用剂量,从而减少化疗相关不良反应。但在本研究中,抑制K562Ras/Raf/MEK/ERK通路未能提高Ara-C的抗肿瘤效应。这可能与K562对信号转导通路抑制剂的敏感性有差异有关。
[1]McCubrey JA,Abrams SL,Ligresti G,et al.Involvement of p53 and Raf/MEK/ERK pathways in hematopoietic drug resistance[J].Leukemia,2008,22(11):2080-2090.
[2]Irish JM,Kotecha N,Nolan GP.Mapping normal and cancer cell signalling net-works:towards single-cell proteomics[J].Nat Rev Cancer,2006,6(2):146-155.
[3]Gallay N,Santos CD,Cuzin L.The level of AKT phosphorylation on threonine 308 but not on serine 473 is associated with high-risk cytogenetics and predicts poor overall survival in acute myeloid leukaemia[J].Leukemia,2009,23(6):1029-1038.
[4].梁爱斌,李莉,谢晓恬.不同危险分组ALL细胞PI3K/AKT磷酸化激活的初步研究[J].同济大学学报(医学版),2005,26(26):52-55.
[5]Nicholson KM,Anderson NG.The protein kinase B/Akt signalling pathway in human malignancy[J].Cell Signal,2002,14(5):381-395.
[6]Stephen L.The Raf/MEK/ERK pathway can govern drug resistance,apoptosis and sensitivity to targeted therapy[J].Cell Cycle,2010,9(9):1781-1791.
[7]Noor SM,Bell M.Shooting the messenger:Targeting signal transduction pathways in leukemia and related disorders[J].Crit Rev in Oncol/Hematol,2011,78(1):33-44.
[8]McCubrey JA,Steelman LS,Abrams SL,et al.Emerging Raf Inhibitors[J].Exp Opin Emerging Drugs,2009,14(4):633-648.
[9]Martelli AM,Evangelisti C,Chiarini F,et al.The emerging role of the phosphatiylinositol 3 kinase/Akt/mammalian target of rapamycin signaling network in normal myelopoiesis and leukemogensis[J].Biochim Biophys Act,2010,1803(9):991-1002.
[10]Steelman LS,Chappell WH,Abram SL.Roles of the Raf/MEK/ERK and PI3K/PTEN/Akt/mTOR pathways in controlling growth and sensitivity to therapy-implications for cancer and aging[J].Aging,2011,3(3):192-222.
[11] LoPiccolo J.Targeting the PI3K/Akt/mTOR pathway:effective combi-nations and clinical considerations[J].Drug Resist Updat,2008,11(1-2):32-50.
[12]Parcells BW,Ikeda AK,Simms WT,et al.FMS-liketyrosine kinase 3 in normal hematopoiesis and acute myeloid leukemia[J].Stem Cells,2006,24(5):1174-1184.
[13] Cheng Z.Effect of phosphatase and tensin homology deleted on chromosome 10(PTEN)gene transfection on reversal of multidrug resistance in K562/ADM cells[J].Leuk Lymphoma,2012,1.[Epub ahead of print]
