川芎嗪对LPS致心肌细胞损伤的影响及机制研究
2012-07-28刘丹,尹东,曾姝,何明
刘 丹,尹 东,曾 姝,何 明
(1.南昌大学医学院药理学教研室,2.江西省分子医学重点实验室,江西 南昌 330006)
四甲基吡嗪(TMPZ)又名川芎嗪,是从川芎的生物碱中分离得到的有效单体。川芎嗪有良好的心肌保护作用,主要与其具备抗钙与抗自由基双重作用有关[1-2]。脂多糖(lipopolysaccharide,LPS)为革兰阴性细菌胞壁的重要成分,是引起炎症反应和休克的关键介质之一,常引起全身炎症反应并可导致多器官功能衰竭,累及心脏。有研究报道[3],LPS可增加心肌细胞NADH氧化酶的表达及过氧化物增殖而导致心肌损伤。鉴于川芎嗪的抗氧自由基作用,我们假设川芎嗪可以保护LPS损伤的心肌细胞,目前尚未见报道。因此,本研究利用LPS诱导心肌细胞损伤,观察川芎嗪对LPS诱导的心肌细胞损伤的影响,并检测活性氧(reactive oxygen species,ROS)生成、细胞的氧化应激状态及NF-κB p65的核移位情况,探讨川芎嗪对抗LPS损伤的可能机制。
1 材料与方法
1.1 受试药品与主要试剂 TMPZ:中国药品生物制品检定所,NF-κB p65、β-actin抗体及相应二抗:Santa Cruz;DCHF-DA:Molecular probes;胎牛血清:杭州四季青生物工程材料有限公司;MDA、SOD、GSH-Px检测试剂盒:南京建成生物工程研究所;胞核-胞质蛋白制备试剂盒:北京普利莱基因技术有限公司;MEM培养基:Gibco BRL;LPS(伤寒菌内毒素脂多糖)、胰酶、HEPES、MTT、增强化学发光印迹试剂、硝酸纤维素膜(Amersham,UK)、丙烯酰胺、PMSF、亮肽素、SDS、亚甲基双丙烯酰胺、过硫酸铵、TEMED、EDTA和DTT:Sigma公司;其它试剂均为分析纯。
1.2 心肌细胞的分离培养 参照以前的实验方法[4],以出生1~3 d的SD乳鼠心室肌组织为实验对象,0.1%胰酶消化分离,MEM培养基(含15%胎牛血清)混悬后放CO2培养箱(5%CO2,37℃)孵育2 h去除成纤维细胞,然后分别按5×105cells·well-1、1 ×105cells·well-1接种于 6 孔、96 孔培养板,隔天换培养液,前3 d加入0.1 mmol·L-1Brdu抑制纤维细胞生长。培养4 d随机分组进行实验。
1.3 药物处理 用不同剂量的TMPZ预处理3 h,弃原培养基,用PBS清洗3次,换新的MEM培养基,再加LPS(5mg·L-1)继续培养6 h,收集细胞进行实验。每次实验均分溶剂对照组(正常对照)、LPS处理组及药物干预组(TMPZ+LPS),每组至少重复6次,TMPZ用生理盐水溶解。
1.4 细胞存活率 MTT比色法检测细胞存活率。胰酶消化收集细胞,每组细胞以1×104cells·well-1浓度接种至96孔培养板中。细胞融合至80%左右开始检测。吸弃原培养基,每孔加入20 μl MTT 溶液(5 g·L-1溶于PBS),37 ℃,4 h,然后每孔加DMSO 150 μl振荡10 min,使蓝色结晶充分溶解,在490 nm波长处测定其光吸收值(OD值)。
1.5 生化检测 各组处理结束后取上清200 μl,生化自动分析仪检测LDH活性。
1.6 流式细胞法检测心肌细胞内ROS含量 实验结束后,用4℃预冷的PBS洗涤细胞2~3次,加入0.25%胰蛋白酶 (含0.02%EDTA)消化细胞后收集,将配制好的 10 μmol·L-1DCFH-DA 溶液 500 μl重悬细胞,37℃孵育30 min,离心,800 ×g,5 min,弃上清,预冷的PBS洗涤细胞2~3次,制成1×108cells·L-1的悬液,立即进行流式细胞仪检测,以488 nm为激发波长,530 nm为发射波长。以不加DCFH-DA的一管为阴性对照。
1.7 细胞内丙二醛(MDA)含量、SOD及GSH-Px活性测定 实验结束后,消化收集心肌细胞,反复冻融破碎细胞,离心后取上清液,按试剂盒说明书进行操作。
1.8 Western blot检测 实验结束后,按试剂盒说明书提取心肌细胞核蛋白,同等量蛋白质行SDSPAGE后,电转膜,分别结合一抗、二抗,最后X线胶片曝光分析。
1.9 数据处理 应用SPSS11.5统计软件行组间方差分析,各实验组数据以±s表示。
2 结果
2.1 TMPZ对LPS致心肌细胞损伤的影响 如Fig 1,2 所示,心肌细胞用不同剂量(40、80、120 μmol·L-1)TMPZ 预处理 3 h,加入 10 mg·L-1LPS,心肌细胞的存活率随TMPZ剂量的增大而升高,LDH值则随TMPZ剂量的增大而减少,具有明显的剂量依赖性。
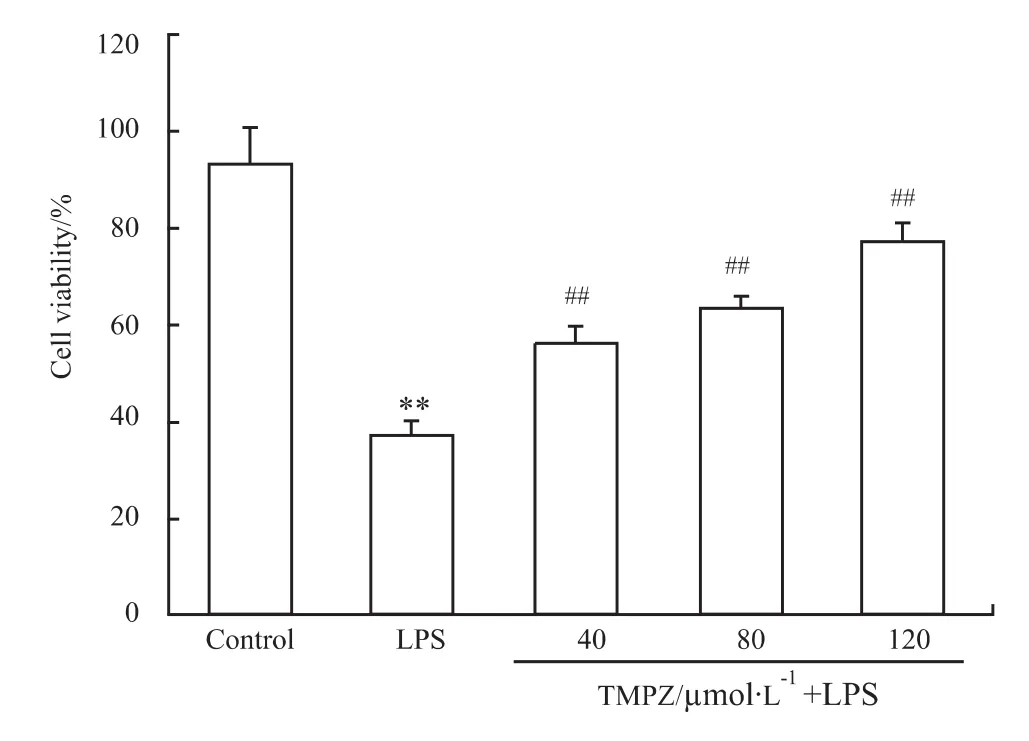
Fig 1 Effects of TMPZ on viability of cardiac cells subjected to LPS-induced injury(±s,n=6)
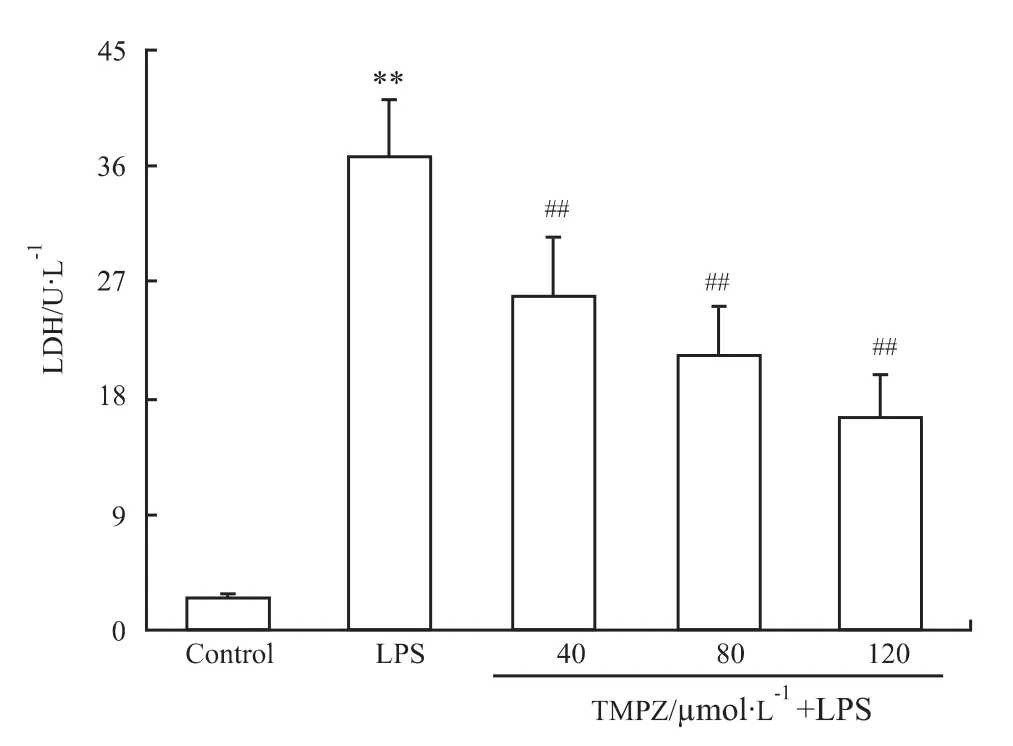
Fig 2 Effects of TMPZ on LDH activity of cardiac cells subjected to LPS-induced injury(±s,n=6)
2.2 TMPZ剂量依赖性地减少ROS生成 流式细胞仪检测结果显示(Fig 3),用10 mg·L-1LPS处理培养的心肌细胞,ROS生成明显增加(与对照组比,P <0.01),用40 ~120 μmol·L-1TMPZ 预处理心肌细胞3 h,从 40 μmol·L-1TMPZ 开始,ROS 生成明显降低(与LPS处理组相比,P<0.01)。说明随着药物浓度的增加,ROS的生成逐渐减少。
2.3 TMPZ剂量依赖性地抑制NF-κB p65核移位
Western blot结果显示(Fig 4),用10 mg·L-1LPS处理培养的心肌细胞,核蛋白中NF-κB p65蛋白含量明显增加(与对照组比,P<0.01),用40~120 μmol·L-1TMPZ 预处理心肌细胞3 h,从40 μmol·L-1TMPZ开始,核蛋白中NF-κB p65蛋白含量明显降低(与LPS处理组相比,P<0.01)。说明随着药物浓度的增加,抑制NF-κB p65蛋白向细胞核的转移。
2.4 TMPZ剂量依赖性地抑制脂质过氧化,提高抗氧化酶活性 如Fig 5所示,用10 mg·L-1LPS处理培养的心肌细胞,MDA含量明显增加,SOD及GSH-Px活性下降(与对照组比,P<0.01),用40~120 μmol·L-1TMPZ 预处理心肌细胞 3 h,从 40 μmol·L-1TMPZ开始,MDA 含量开始下降,SOD 及GSH-Px活性增加(与LPS处理组相比,P<0.01)。说明随着药物浓度的增加,脂质过氧化被抑制,抗氧化酶活性增加。
3 讨论
LPS是革兰阴性细菌致病的主要因素,它可引起机体的一系列炎症反应,是一种重要的致炎因子[5]。根据文献报告[3,6],LPS可增加心肌细胞NADH氧化酶的表达及过氧化物增殖,造成ROS生成增加。ROS具有较高的反应活性,正常情况下,细胞存在抗氧化酶类,包括SOD、GSH-Px等,能够清除细胞代谢过程中不断产生的ROS,使得细胞内ROS的生成与清除处于一个相对稳定的水平。但当其生成较多,超过细胞抗氧化酶类的清除水平时,会造成细胞的广泛损伤,如膜脂质过氧化、蛋白质及核酸损伤等。因此,刺激心肌细胞产生过多的ROS可能是LPS诱导心肌细胞损伤的机制之一。我们的研究证实,LPS处理心肌细胞后,会使得MDA含量升高,SOD、GSH-Px活性下降,ROS含量增加,心肌细胞存活率减少。
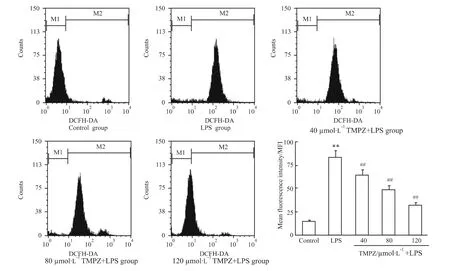
Fig 3Effects of TMPZ on ROS production of cardiac cells subjected to LPS-induced injury(±s,n=6).
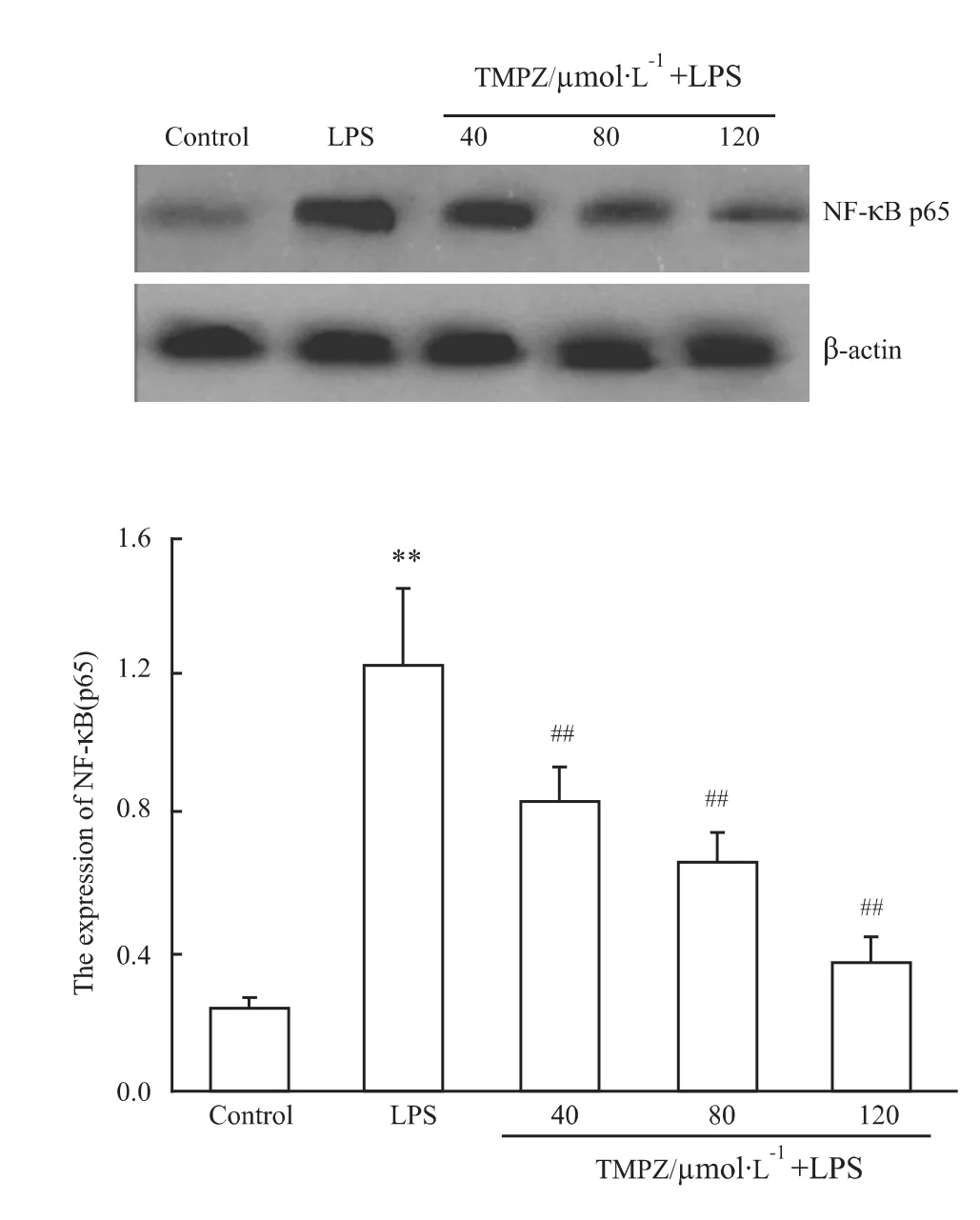
Fig 4 Effects of TMPZ on nuclear NF-κB p65 protein of cardiac cells subjected to LPS-induced injury by Western blot(±s,n=6)
TMPZ是中药川芎的主要有效成份之一,许多研究[7-8]均报道川芎嗪有心血管保护作用,并且这种保护作用与其抗氧化作用有关。我们在LPS损伤心肌细胞之前给予不同剂量的TMPZ预处理,发现有明显的保护作用,且这种保护作用呈剂量依赖性;进一步对TMPZ抗LPS损伤的机制进行研究,发现与抑制 NF-κB 激活有关。众所周知[9],NF-κB 信号传导通路被认为是LPS所介导的信号传导通路中最重要的下游通路。一般情况下,NF-κB为p50/p65异源二聚体,与抑制物IκBα结合成无活性的三聚体存在于细胞质中;一旦受到外界因素刺激时,如大量产生的 ROS,IκBα 磷酸化而迅速降解,NF-κB即被激活,p65由细胞质移位至细胞核,从而调控一系列基因表达[10]。在LPS诱导的心肌细胞损伤中,NF-κB的激活很有可能引起大量炎症因子如TNF-α、IL-1等的过度表达,从而造成细胞损伤。我们的实验结果表明,LPS能促进p65的核移位,使p65在核中的表达明显升高,而TMPZ则呈剂量依赖性抑制p65的核移位,从而起到对抗LPS致心肌细胞损伤的作用。因此,可以推断川芎嗪对LPS所致的心肌损伤有保护作用,其机制主要是通过减少ROS生成,从而抑制NF-κB的活化,阻止p65的核移位,减少炎症因子的表达,发挥心肌保护作用。
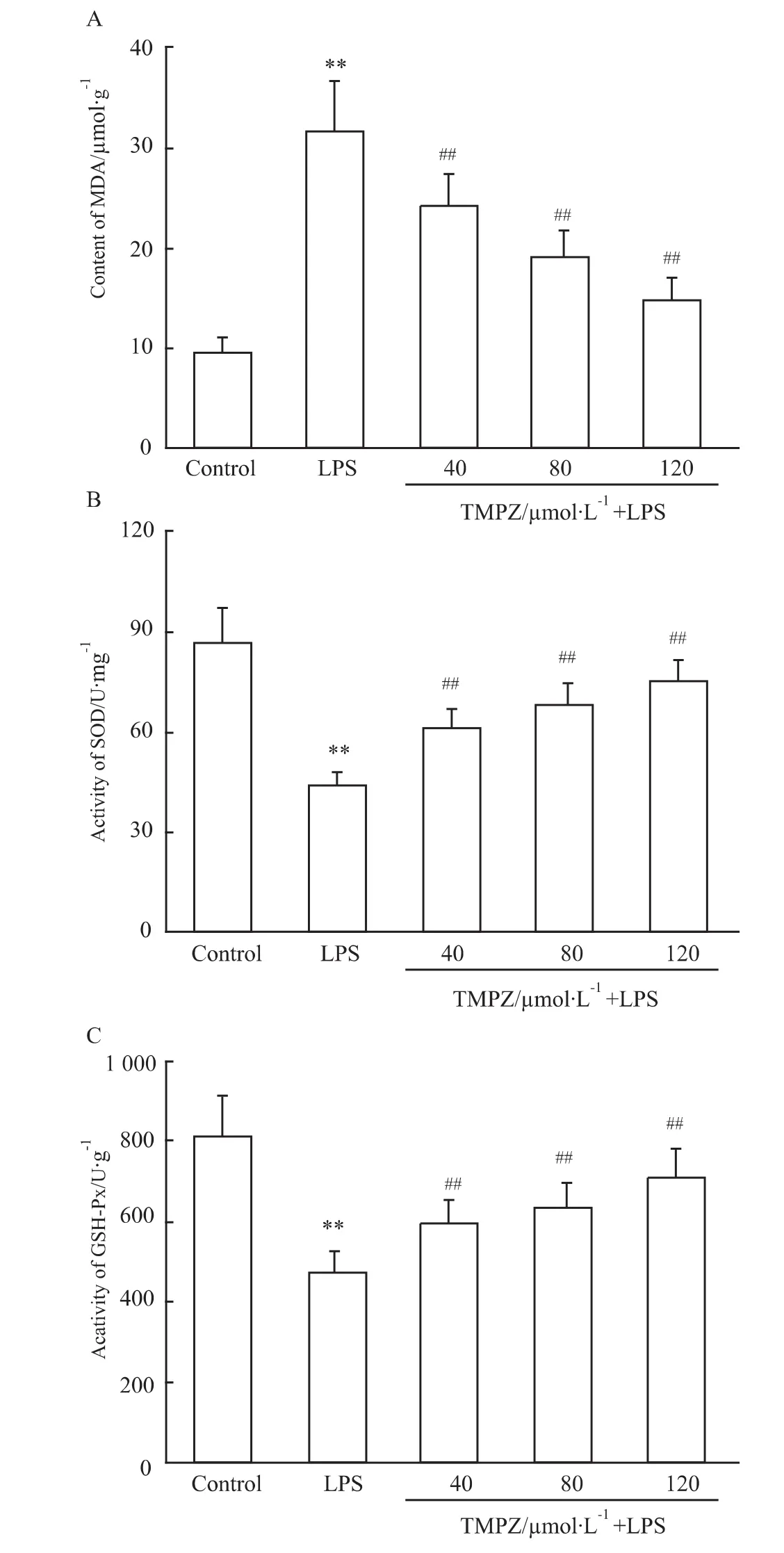
Fig 5 Effects of TMPZ on content of MDA,SOD and GSH-Px activities of cardiac cells subjected to LPS-induced injury(±s,n=6)
[1] Hintz K K,Ren J.Tetramethylpyrazine elicits disparate responses in cardiac contraction and intracellular Ca2+transients in isolated adult rat ventricular myocytes[J].Vascul Pharmacol,2003,40(4):213-7.
[2] Guo L,Wang A,Sun Y,Xu C.Evaluation of antioxidant and immunity function of tetramethylpyrazine phosphate tablets in vivo[J].Molecules,2012,17(5):5412 -21.
[3] Zhang Z H,Yu Y,Wei S G,et al.Centrally administered lipopolysaccharide elicits sympathetic excitation via NAD(P)H oxidasedependent mitogen-activated protein kinase signaling[J].J Hypertens,2010,28(4):806 -16.
[4] 刘 丹,何 明,易 波,等.Pim-3对抗心肌细胞缺氧复氧损伤的研究[J].中国药理学通报,2009,25(3):321-5.
[4] Liu D,He M,Yi B,et al.The research of Pim-3 protective effect on cardiomyocyte anoxia-reoxygenation injury[J].Chin Pharmacol Bull,2009,25(3):321 -5.
[5] Zeng L,Gu W,Zhang A Q,et al.A functional variant of lipopolysaccharide binding protein predisposes to sepsis and organ dysfunction in patients with major trauma[J].Ann Surg,2012,255(1):147-57.
[6] Peng T,Lu X,Feng Q.Pivotal role of gp91phox-containing NADH oxidase in lipopolysaccharide-induced tumor necrosis factoralpha expression and myocardial depression[J].Circulation,2005,111(13):1637-44.
[7] 王国峰,赵 霞,李 宁,等.川芎嗪对脂多糖诱导内皮细胞花生四烯酸通路炎症反应的影响[J].中国药理学通报,2012,28(4),253-7.
[7] Wang G F,Zhao X,Li N,et al.Antiatherosclerosis induced by ligustrazine against LPS through arachidonic acid signaling pathway[J].Chin Pharmacol Bull,2012,28(4),253 -7.
[8] Zhao H P,Lu D,Zhang W,et al.Protective action of tetramethylpyrazine phosphate against dilated cardiomyopathy in cTnT(R141W)transgenic mice[J].Acta Pharmacol Sin,2010,31(3):281-8.
[9] Li D Y,Xue M Y,Geng Z R,et al.The suppressive effects of Bursopentine(BP5)on oxidative stress and NF-κB activation in lipopolysaccharide-activated murine peritoneal macrophages[J].Cell Physiol Biochem,2012,29(1-2):9-20.
[10] Van der Heiden K,Cuhlmann S,Luong le A,et al.Role of nuclear factor kappaB in cardiovascular health and disease[J].Clin Sci(Lond),2010,118(10):593-605.
