通过石蜡包埋组织标本构建肝细胞癌基因组文库的研究①
2012-07-23肖建于倩范露丹姚利民卢川马韵曾丽霞李运千黄永秩黄小英黄炳臣姚金光黄照权龙喜带
肖建,于倩,范露丹,姚利民,卢川,马韵,曾丽霞,李运千,黄永秩,黄小英,黄炳臣,姚金光,黄照权,龙喜带②
(1.右江民族医学院2009级临床医学专业,广西 百色 533000 E-mail:xiaojianty@sina.cn;2.右江民族医学院2008级医学影像学专业,广西 百色 533000;3.广西医科大学附属肿瘤医院病理科,广西 南宁 530027;4.广西医科大学附属医院病理科,广西 南宁 530023;5.桂林医学院附属医院病理科,广西 桂林 541000;6.右江民族医学院附属医院,广西 百色 533000)
肝细胞癌(hepatocellular carcinoma,HCC)是我国一种多发的恶性肿瘤[1],如何有效地利用该肿瘤组织标本(尤其是石蜡包埋组织)构建HCC基因组DNA是HCC研究领域的一个重要课题。近年来,国内的一些研究者对于如何充分利用石蜡包埋组织做了一些有意义的探讨,但结果并不是很理想[2~5]。在本次研究中,笔者采用改良组织裂解法提取石蜡包埋HCC肿瘤组织的基因组DNA,构建了相应基因组DNA文库,具体如下。
1 材料与方法
1.1 实验设计 为保证文库构建的质量,本研究按图1所示路线开展相关研究工作。

图1 HCC肿瘤组织标本基因组DNA文库构建实验设计图
1.2 主要试剂与材料
1.2.1 主要试剂 TO型生物制片透明剂(TO,广西岑溪松香厂研制)、无水乙醇(上海生工)、组织裂解改良法DNA提取试剂盒(含组织裂解液、蛋白漂洗液Ⅰ和Ⅱ、蛋白酶K及DNA溶解液。委托康为世纪生物科技有限公司合成该试制,试剂盒编号:CW0547)。
1.2.2 主要仪器设备 SmartSpecTM核酸蛋白测量仪(BIORAD)、匀浆机(PRO Scientific Inc.)、台式高速离心机(Sigma)、实时定量PCR仪(BIO-RAD)、DYY-6C型电泳仪及Chemic-DocXRS成像系统(BIO-RAD)、DK-8D型电热恒温水槽(上海精宏实验设备有限公司)、移液枪(Eppendorf)、离心管(Axy-Gen)、96孔PCR反应板(AxyGen)、DNA保存管(AxyGen)及移液枪头(AxyGen)等。
1.3 研究标本入选标准的确定 根据构建基因组文库及开展HCC研究的基本要求,本研究标本的入选标准如下:①所有研究标本均经组织病理学检查确诊为HCC标本;②通过查阅病历或随访调查能获取完整的临床资料及生存资料;③能获取到足够的石蜡包埋肿瘤组织标本;④能获得病人本人或家属的知情同意。
1.4 基因组DNA的提取 采用组织裂解改良法提取HCC肿瘤组织标本基因组DNA,具体步骤如下:①取1cm×1cm大小的石蜡包埋HCC肿瘤组织标本厚约 40μ m,入TO型透明剂脱蜡3次,每次 30min;②将脱蜡后的组织入无水乙醇2次,每次20min;③挥干乙醇,将组织移入1.5ml的离心管;④加入280μl组织裂解液,经匀浆器充分匀浆;⑤加入 400μg蛋白酶 K,颠倒混匀后置 56℃水浴箱水浴 60min、随之 90℃水浴箱水浴60min;⑥水浴后加入 560μl DNA促沉液,颠倒混匀后移入DNA吸附管,经离心后弃废液;⑦向吸附管中加入500μl蛋白漂洗液Ⅰ,经离心弃废液后加入 500μl蛋白漂洗液Ⅱ,离心弃废液;⑧置室温自然风干吸附管中的残液后,加入DNA溶解液100μl,室温静置 2min,随之离心并收集漏液用于质量鉴定或置于-20℃保存用于构建文库。
1.5 质量的监控与鉴定
1.5.1 实验质量的监控 所有实验均设立阳性对照、阴性对照及空白对照以进行实验质量的监控;此外,为有效监控文库构建过程中的实验质量,我们设立了对照组(n=100),通过经典酚氯DNA提取法抽提所有对照人群的外周血白细胞基因组DNA,用于后续文库质量的鉴定。
1.5.2 DNA浓度及纯度的鉴定 通过SmartSpecTM核酸蛋白测量仪分析所获取的基因组DNA浓度及纯度,以DNA浓度≥0.1μg/μl合格浓度标本;以A260/A280比值介于 1.6~ 2.0为合格纯度标本。
1.5.3 DNA模板质量的鉴定 由于所提取的HCC组织基因组DNA文库主要用于HCC发病机制及临床预后的研究,因此应当对充当模板的质量进行鉴定,笔者通过PCR及琼脂糖凝胶电泳方法来鉴定这种质量。①PCR鉴定方法采用XPF基因作为实验基因,通过TaqMan-MGB-PCR技术来验证,具体实验方法参见我们发表在“Hepatology”的论文[6],实验合格判断方法如下:采用BIO-RAD随机软件IQ5分析,如果所获得的实时曲线为单一光滑曲线即表明DNA模板质量较好;②琼脂糖凝胶电泳鉴定方法采用2%琼脂糖凝胶进行鉴定,取PCR产物8μl在120V电流下电泳30min后通过Bio-Rad凝胶图像分析系统观察质量鉴定结果,合格判断方法如下:DNA条带单一并清晰,无明显拖尾现象。
2 结果
2.1 标本收集情况 根据构建HCC肿瘤组织标本基因组DNA文库的样本入选标准,我们从广西医科大学、桂林医学院及右江民族医学院三所医学院校的附属医院收集到组织标本共2245例,均是经组织病理诊断方法确诊为HCC的石蜡包埋肿瘤组织标本,组织标本质量好,标本面积及厚度符合要求;其中137例临床资料或生存随访资料不齐而被排除,因此本研究共收集到合格标本2108例。
2.2 基因组文库构建情况 通过组织裂解改良法对所有合格组织标本进行了基因组DNA的抽提,通过Microsoft excel 2003建立了相应HCC肿瘤组织基因组DNA文库,文库主要内容包括:文库对象姓名、性别、年龄、民族、籍贯、生活工作地、迁移史、烟酒史、家庭肿瘤史、肝炎病毒感染史、黄曲霉毒素B1暴露史、HCC临床病理特征、治疗史、生存情况等,所有标本在文库中均具有唯一序列号。
2.3 基因组文库质量评估情况 我们对所构建的基因组DNA文库中的DNA样本进行了浓度及纯度的检测,所提取的DNA浓度均大于或接近 0.1μg/μl,而反映 DNA纯度的OD260/280值都在1.6~2.0之间,提示本文库DNA的浓度及纯度均达到了组织基因组DNA文库的基本要求;为进一步分析DNA作为研究模板的质量,我们通过TaqMan-MGB-PCR方式对其进行了鉴定(见图2),PCR实时定量曲线结果显示波峰单一,曲线运行光滑(见图2A),基因分型结果显示分簇界线清楚(见图2B),t检验结果显示在文库基因组DNA与对照组DNA两者间的荧光定量差异无显著性(P>0.05);通过琼脂糖凝胶电泳方式鉴定发现DNA条带单一清晰,无明显拖尾现象(见图3),定量分析显示文库基因组DNA与对照组DNA两者间的差异无显著性(P>0.05),提示本文库DNA质量较好,可用于后续的研究工作。
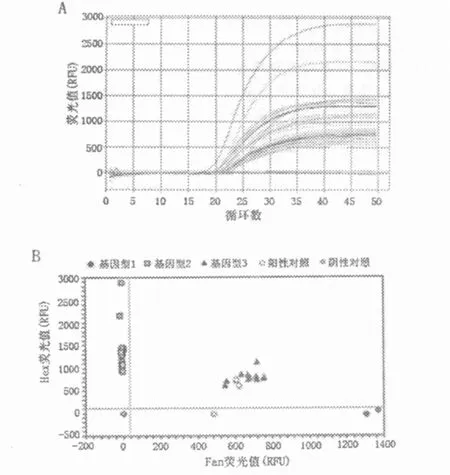
图2 TaqMan-MGB-PCR鉴定基因组DNA文库质量,实验基因为XPF,图A为PCR的实时定量曲线图,图B为XPF的基因分型图,其中“基因型1”、“基因型 2”及“基因型3”其对应的DNA模板来自文库DNA,阳性对照对应的DNA模板来自对照组DNA,阴性对照为缺乏DNA模板的监控对照。

图3 琼脂糖凝胶电泳鉴定基因组DNA文库质量,实验基因为XPF,图中“M”为电泳 DNA Marker,“1~ 4”来自基因组 DNA 文库 DNA,“5~ 8”来自对照组 DNA。
3 讨论
本实验的目的是通过分子生物学手段构建可用于HCC研究的肿瘤组织标本基因组DNA文库,通过实验,我们成功地构建了高质量的HCC肿瘤组织基因组DNA文库,其成果的主要经验如下:第一,我们进行了严格的实验设计,明确了基因组DNA文库构建的目的及用途;第二,研究人员进行有效的分组合作,严格按照实验设计的操作规程开展相关研究工作;第三,明确了研究标本的入选条件,我们对不符合入选条件的标本进行了剔除,从而有效地保证了实验的质量;第四,我们在酚氯抽提法提取基因组DNA的基础上,对石蜡包埋肿瘤组织的基因组DNA提取试剂进行了优化改进,用低毒性的TO型生物制片透明剂代替了毒性较高的二甲苯进行脱蜡[7],在脱蜡前将组织适当加热以促进彻底脱蜡;第五,对消化裂解步骤进行了有效的优化,鉴于肝肿瘤组织标本中纤维较少而肿瘤细胞较多的原因,根据组织的量适当增加了裂解液的浓度及使用量,并通过高速电动匀浆器对标本进行了彻底匀浆以利于蛋白酶K的消化作用;第六,为保证所提取的基因组DNA的纯度,主要是为防止蛋白的污染,我们一方面通过蛋白酶K的消化作用来裂解组织蛋白,另一方面通过含异丙醇的蛋白漂洗液对DNA标本进行清洗以利于去除蛋白污染;最后,科学地进行了实验质量的监控。在当前研究中,我们通过文库构建前的监控设计、文库构建中的控制对照及文库构建后的质量检测等三个环节有效地保证了实验质量。
总之,通过合理科学的设计、严格的实验及有效的质量监控可以利用石蜡包埋组织构建用于HCC研究的肿瘤组织基因组DNA文库。
[1]Long XD,Yao JG,Zeng Z,et al.DNA repair capacityrelated to genetic polymorphisms of DNA repair genes and aflatoxin B1-related hepatocellular carcinoma among Chinese population[M]//Kruman I.DNA Repair/Book 4.Rijeka:InTech Open Access Publisher,2011:1-20.
[2]张惠丹,任辉,王晓楠,等.一种从石蜡包埋组织中快速提取DNA的方法[J].临床与实验病理学杂志,2010,26(5):590-593.
[3]刘水平.从石蜡包埋组织中获取高质量基因组DNA的方法改进[J].生命科学研究,2009,13(4):343-365.
[4]张旭垠,易晓芳,丁景新,等.石蜡包埋组织中4种DNA提取方法的比较研究[J].中国妇幼健康研究,2007,18(4):291-293.
[5]陈启龙,聂刘旺,王洋,等.石蜡包埋肺癌组织DNA提取方法的改进[J].肿瘤防治杂志,2004,11(4):355-357.
[6]Long XD,Ma Y,Zhou YF,et al.Polymorphism in xeroderma pigmentosum complementation group C codon 939 and aflatoxin B1-related hepatocellular carcinoma in the Guangxi population[J].Hepatology,2010,52(4):1301-1309.
[7]高蓉梅,彭凤翔,李永春.TO型生物制片透明剂取代二甲苯在病理制片中的应用[J].诊断病理学杂志,2009,16(2):147.
