高电压镍锰酸锂动力电池正极材料研究进展
2012-06-29宋植彦郑春满
宋植彦,谢 凯,郑春满
(国防科技大学航天与材料工程学院,湖南 长沙 410073)
自日本索尼公司1990年以LiCoO2作为正极材料,石墨作为负极材料的锂离子电池面世以来,全世界锂离子电池产业迅猛发展。当前,全球能源问题日益突出,各国政府从提高未来国家汽车产业竞争力,保持经济、社会可持续发展的战略高度,积极推动以电动汽车为主的新能源汽车的发展。动力电池系统是电动汽车的重要组成部分,直接影响着电动汽车的起动、加速、行驶里程等多项性能,因此,锂离子电池作为动力能源电池正在受到广泛的关注。在动力能源领域的应用,要求锂离子电池具有较高的能量密度、较低的生产成本,最重要的是安全性[1-2]。尖晶石型LiMn2O4正极材料因其晶体结构中锂离子嵌入、脱嵌速率较快和无毒、成本较低等优点,成为目前动力电池研究开发的重点[3]。由于尖晶石LiMn2O4材料在使用过程中存在Jahn-Teller效应[4-5]、锰离子在电解液中歧化反应及溶解[6-7]等问题,导致材料的电化学循环性能比较的差。针对这个问题,目前研究较多的就是对其进行离子掺杂与表面包覆改性[8]。
由于动力电池的应用要求电池功率性能好,工作电压较高,因此,为了改善尖晶石锰酸锂正极材料循环稳定性较差的问题,以及提高材料的放电电压,目前的研究主要集中在金属离子掺入替代部分锰离子,制备新的尖晶石型正极材料。不同元素掺杂后尖晶石LiMxMn2-xO4(M=Ni,Co,Cr,Cu等)正极材料的电压变化会发生变化[9],掺入镍离子的尖晶石锰酸锂材料表现出较好的循环性能,镍离子掺杂研究中,LiNi0.5Mn1.5O4是目前尖晶石锰酸锂掺杂改性研究中最为广泛的。
本文以新能源电动汽车的发展需求为背景,首先简述了电动汽车对动力电池正极材料的要求、镍锰酸锂正极材料的结构与嵌脱锂机理,然后从研究的角度详细综述了镍锰酸锂的合成方法及研究进展,分析了镍锰酸锂体系正极材料存在的主要问题以及改进方法,展望了镍锰酸锂正极材料用于动力电池的发展趋势和应用前景。
1 LiNi0.5Mn1.5O4正极材料的结构与嵌脱锂机理
这种正极材料的工作电压在4.7 V左右,理论比容量147 mAh/g,通常会出现两种结构的尖晶石LiNi0.5Mn1.5O4:一种是无序尖晶石LiNi0.5Mn1.5O4-δ,属于面心立方,空间群(SG)为Fd3m,结构如图1(a)所示,该结构材料的晶格对称性高,锂分布在四面体间隙8a位置,而锰和镍随机分布在八面体间隙16d位置,氧位于32e位置;另一种是有序尖晶石LiNi0.5Mn1.5O4,属原始简单立方,空间群(SG)为P4332,结构如图1(b)所示,该结构材料的晶格对称性低,晶格常数小于前者,锂分布在四面体间隙8a位置,镍有序地取代了部分锰离子,16d位分为4b位和12d位,镍占据4b位,而锰占据12d位[10-11]。
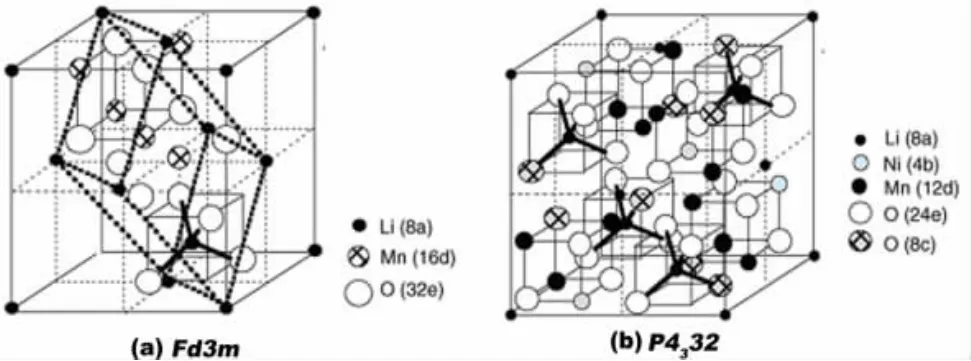
图1 两种尖晶石LiNi0.5Mn1.5O4的结构示意图
空间点群为Fd3m的晶体具有更高的电子电导率,这与有序结构的尖晶石缺少Mn3+有关,也导致具有P4332空间群的LiNi0.5Mn1.5O4比具有Fd3m空间群的LiNi0.5Mn1.5O4更低的倍率循环性能[12]。因为空间点群Fd3m的晶体同LiMn2O4的晶体结构相同,四面体晶格8a,48f和八面体晶格16c共面构成了互通的三维快速锂离子扩散通道,锂以完全离子化的形式存在,这有助于锂离子在晶格中发生快速的脱/嵌,充电过程中,8a位的锂离子经过8a-16c-8a通道从三维晶格中脱出,同时Ni2+和部分Mn3+失去电子被氧化为Ni4+和Mn4+,材料结构最终转变为Ni0.5Mn1.5O4,剩下稳定的尖晶石Ni0.5Mn1.5O4骨架;放电过程中,锂离子在静电力作用下经过8a-16c-8a通道嵌入势能较低的8a位,同时Ni4+和部分Mn4+得到电子被还原为Ni2+和Mn3+,结构最终转变为 LiNi0.5Mn1.5O4[13]。
2 LiNi0.5Mn1.5O4正极材料的合成方法
目前,制备尖晶石LiNi0.5Mn1.5O4正极材料的方法有多种,按照研究广泛性主要分为两类:(1)常规合成方法:主要包括固相法[14-15]、共沉淀法[16-17]和溶胶 -凝胶法[18-19];(2)非常规合成法:主要包括燃烧法[20]、超声喷雾热解法[21]、聚合物辅助法[22]等。
2.1 常规合成法
2.1.1 固相法
此种方法是粉体材料制备最常见方法,也是最有利于工业化生产的方法。反应原料经过处理后直接进行高温烧结。这种方法的优点主要是过程简单,易于控制,也最常用,但缺点是合成温度高、时间长、能耗大、生产效率低,合成材料的颗粒尺寸较大(几微米至几十微米)、均匀性差、化学计量比难以控制,同时,研究表明,烧结温度较高时容易产生杂质相LixNi1-xO[14]。
SUN Qiang 等 人[14]将 NiCl2·6 H2O、MnCl2·4 H2O 和(NH4)2C2O4·H2O先进行低温反应,得到前驱体NiC2O4·2 H2O和MnC2O4·2 H2O,再加入Li2CO3,进行高温固相烧结,得到最终产物。产物电化学性能较好,0.2C充放条件下,首次放电比容量达到136 mAh/g,30次充放循环后放电容量保持率为96%(图 2)。
2.1.2 共沉淀法
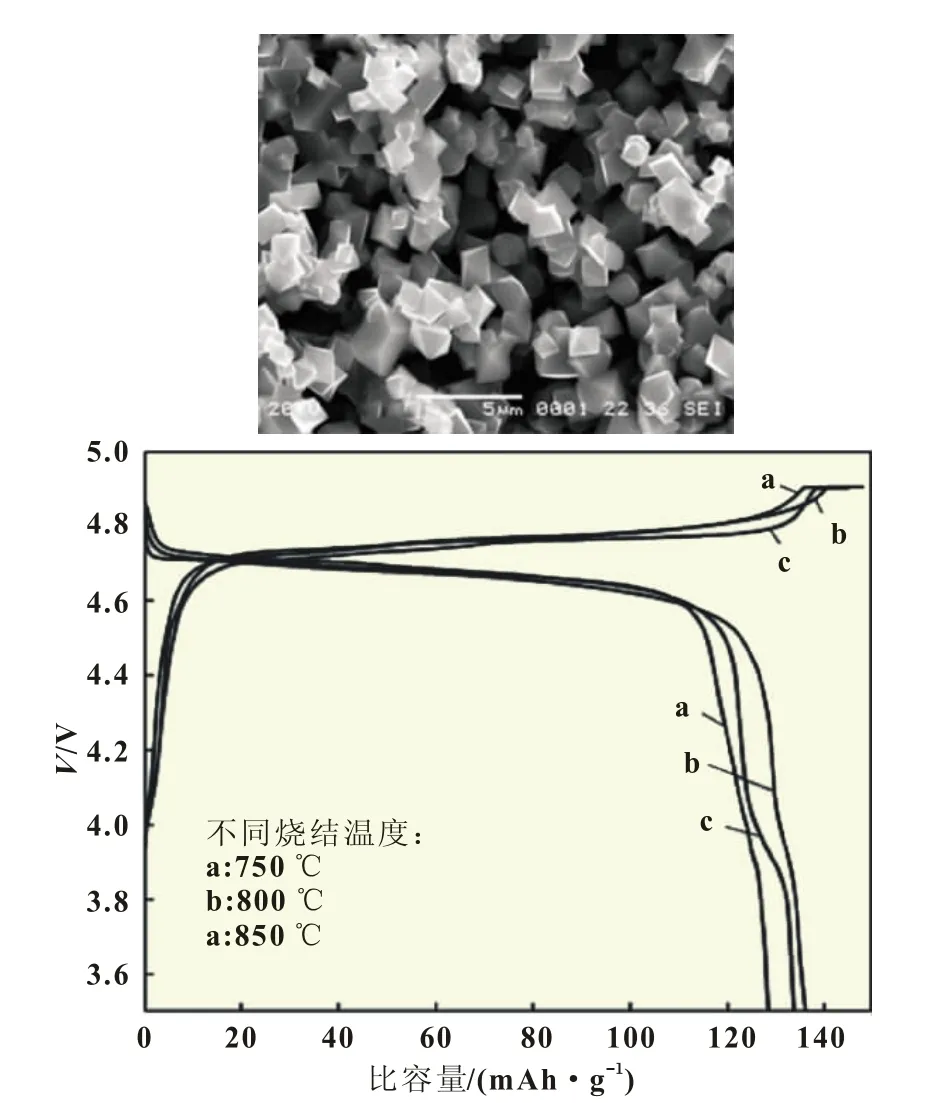
图2 SUN Qiang等人制备的LiNi0.5Mn1.5O4及其性能测试
此种方法比较简单,一般是在反应物的水溶液中加入沉淀剂,使锰离子和镍离子全部沉淀后得到前驱体,再与含锂离子的化合物混合后烧结得到产物。这种方法的优点主要是合成温度较低,产物颗粒尺寸小(几个微米)、成分均一,比表面积较大,但是存在不同元素的沉淀速率不同,难以精确控制产物的组成和反应速率等缺点。
Dongqiang Liu等人[17]将化学计量比的锰、锂、镍的醋酸盐溶于去离子水后加入草酸作为沉淀剂,共沉淀物干燥后得到前驱体,前驱体经高温烧结得到最终产物。在0.2C和3.5~4.9 V的充放条件下,材料首次放电比容量达到138 mAh/g,50次充放循环后材料的放电容量几乎没有变化(图3)。
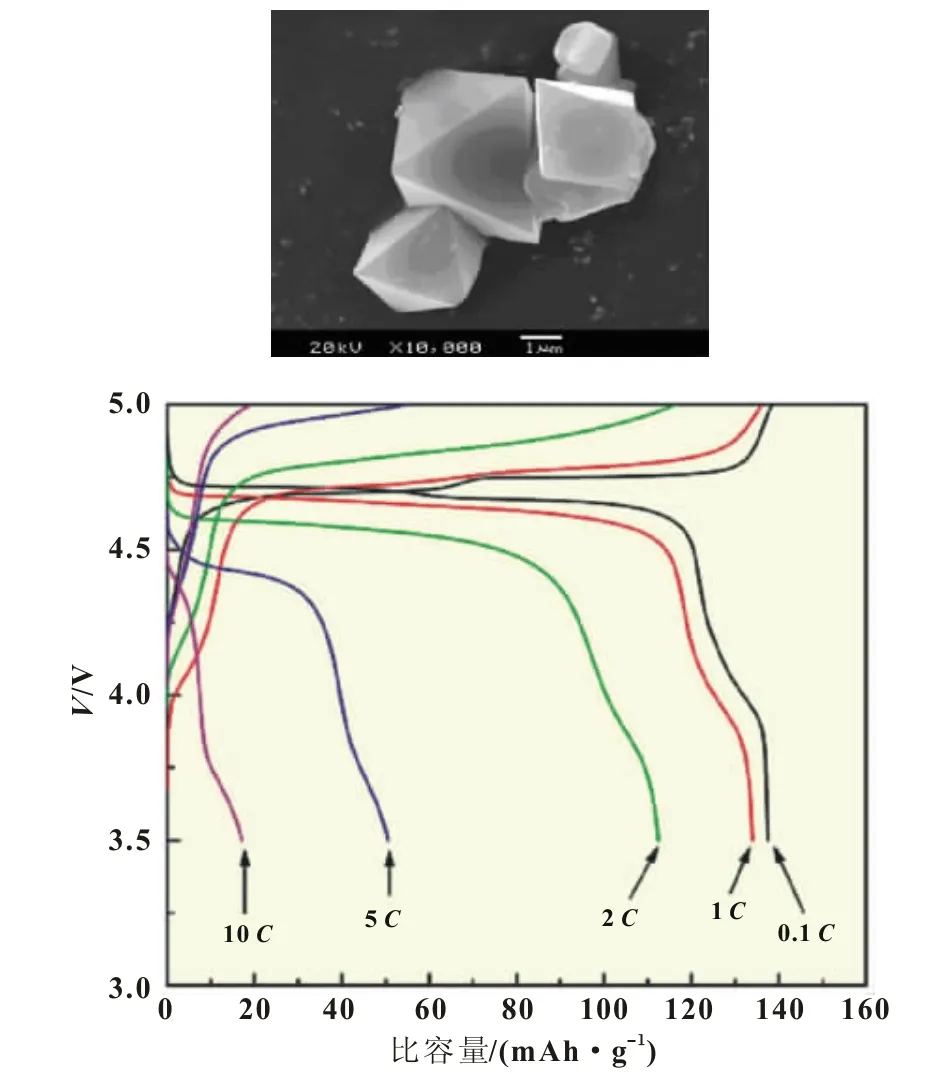
图3 Dongqiang Liu等人制备的LiNi0.5Mn1.5O4及其性能测试
2.1.3 溶胶-凝胶法
由于Ni2+和Mn2+不容易水解,所以很难采用传统的溶胶-凝胶方法制备这两种离子的水解型溶胶-凝胶,为了得到具有空间网络结构的凝胶,通常采用具有双齿或者多齿的螯合物作为络合剂制备这种材料的络合物型凝胶先驱体,先驱体经过干燥和烧结后得到产物,通常采用的螯合剂为柠檬酸,也有采用领苯二甲酸或者EDTA等作为螯合剂,或者采用含有络合基团的聚合物作为凝胶化添加物,比如聚丙烯酸等。这种方法的优点主要是可以实现反应物的原子级均匀混合、合成温度低,所以制备产物的粒径小(多为纳米级)、均一性好,比表面积大、形态和组成易于控制,但是制备工艺比较复杂,对溶胶-凝胶制备条件的控制要求比较高。先驱体烧结时温度比较低,合成的材料粉末颗粒粒径比较小,通常为纳米材料。
B.J.Hwang等[19]将化学计量比的锰、锂、镍的醋酸盐溶于水后滴加柠檬酸作为络合剂,并且采用氨水控制溶液pH值,搅拌下得到凝胶前驱体,前驱体烧结后得到预期产物。850℃高温处理的材料在0.1C充放条件下首次放电比容量达到132.6 mAh/g,25次循环后容量保持率为97.2%(图4)。
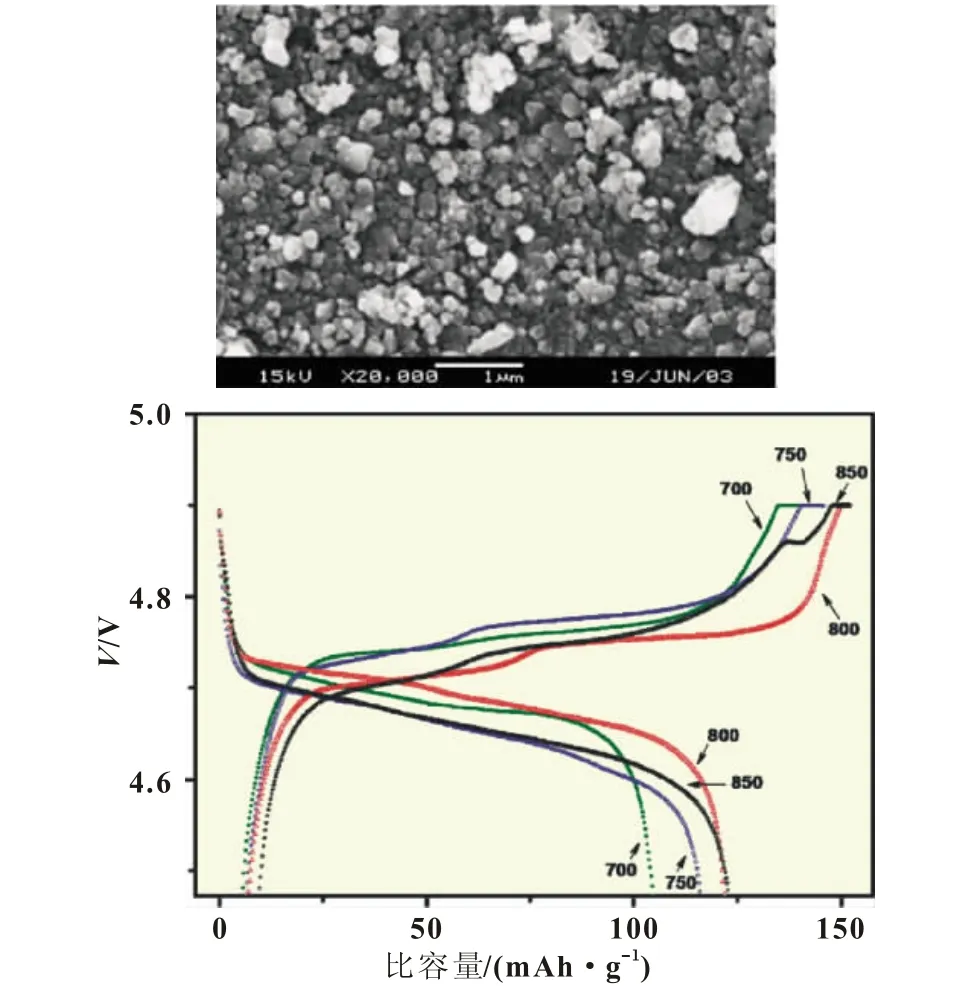
图4 B.J.Hwang等人制备的LiNi0.5Mn1.5O4及其性能测试
国防科技大学的陈颖超采用间苯二酚-甲醛以乙醇作为溶剂的聚合物辅助溶胶-凝胶方法合成了性能优良的纳米Li-Ni0.5Mn1.5O4材料[23]。间苯二酚和甲醛不仅组成了具有空间网络结构的凝胶,使Li+、Ni2+、Mn2+均匀分布于凝胶结构中,同时,由于酚羟基的络合作用,进一步稳定了凝胶体系。850℃处理的材料首次放电比容量达到134 mAh/g,100次循环后容量保持率为94.7%。
2.2 非常规合成方法
Li Zhang等[20]采用碳燃烧法制备了LiNi0.5Mn1.5O4材料,将Li2CO3,NiO和Mn3O4按化学计量比混合后加入单质C,在800℃燃烧后在900℃恒温处理,得到产物。材料首次放电比容量为131.7 mAh/g,20次循环后比容量为130.8 mAh/g,几乎没有变化。
Sang-Ho Park等[21]采用超声喷雾热解法合成了LiNi0.5-Mn1.5O4材料,将化学计量比的锂、镍、锰的硝酸盐配成水溶液,水溶液加入到柠檬酸溶液中并且将溶液保持振荡,混合溶液通过高频(1.7 MHz)喷雾器喷出,喷出的雾状溶液在500℃快速干燥,干燥产物在900℃进行晶化处理,得到产物。材料的首次放电比容量约140 mAh/g,55℃循环50次后放电容量保持在97%。
3 LiNi0.5Mn1.5O4正极材料的改进
和尖晶石LiMn2O4正极材料类似,LiNi0.5Mn1.5O4也存在循环稳定性不好的问题,因此,为了改善这种材料的循环性能,研究者们进行了大量的研究,这些研究主要集中在离子掺杂和表面包覆改性。
3.1 离子掺杂
LiNi0.5Mn1.5O4的离子掺杂包括金属离子的掺杂和非金属离子的掺杂,金属离子的掺杂主要是采用与O2-键合能力较强的离子取代部分Ni2+,某些金属离子的掺入可以提高电池的工作电压,比如掺入Cr3+和Co3+等[24]而非金属离子掺杂主要是采用电负性大的离子取代部分O2-[25]。
Mohamed Aklalouch等[26]采用燃烧法合成了LiCr0.2Ni0.4-Mn1.4O4正极材料粉末,将蔗糖与反应原料混合后燃烧得到初步产物,初步产物在不同温度下进行结晶化处理,制备颗粒尺寸大小不同的粉末材料。研究者重点研究了不同颗粒尺寸的材料在25、55℃下的电化学性能,研究表明,合成温度较低、颗粒尺寸小的粉末表现出较高的容量(0.5C充放电条件下比容量接近140 mAh/g),但是颗粒尺寸小的粉末表现出较差的循环稳定性,750℃条件下处理的材料在55℃下循环不到40次比容量降到80 mAh/g以下。
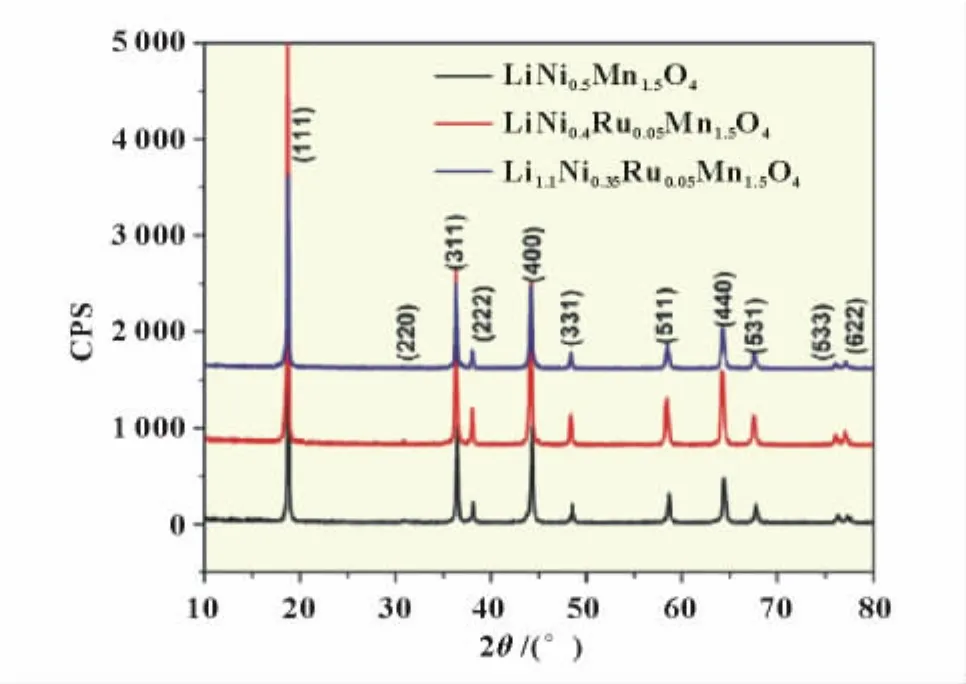
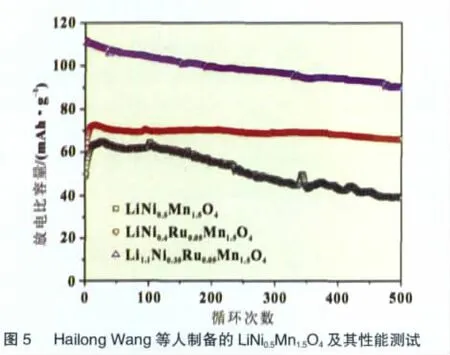
Hailong Wang等[27]采用高温固相法合成了掺入Ru4+的LiNi0.4Ru0.05Mn1.5O4和Li1.1Ni0.35Ru0.05Mn1.5O4正极材料,表现出了良好的性能,0.2C充放电条件下比容量都接近130 mAh/g,而10C充放循环下,LiNi0.4Ru0.05Mn1.5O4表现出更好的性能(图5)。
Guodong Du 等[25]将化学计量比的 Li(CH3COO)2·H2O,Ni-(CH3COO)2·4 H2O,Mn(CH3COO)2·4 H2O 和 LiF 溶于水后在70℃搅拌成前驱体,前驱体在不同温度下烧结得到产物。0.2 C充分条件下,合成的LiNi0.5Mn1.5O3.95F0.05材料首次放电比容量为122 mAh/g,100次循环后容量保持率为91%。
3.2 表面包覆改性
尖晶石LiNi0.5Mn1.5O4的电压平台较高(4.7 V),电解质在高压下不稳定,容易发生氧化分解产生HF。另外,电解液中残存的水分发生分解反应产生H+会取代部分Li+导致容量衰减,并加速锰的溶解[28]。为了抑制电解液分解产生的HF与正极材料的反应导致材料容量的衰减,众多研究集中在正极材料的表面包覆与HF反应的物质,从而起到保护作用,其中包覆层采用较多的是氧化物,比如:ZnO[29]、SiO2[30],也有采用BiOF[31]。
Yukai Fan等[30]先用柠檬酸络合溶胶-凝胶法制备了纯相的LiNi0.5Mn1.5O4粉末,将气相SiO2与乙醇混合后超声1 h后搅拌0.5 h制成胶状物,再将胶状物与纯相LiNi0.5Mn1.5O4粉末混合后超声0.5 h再搅拌2 h,产物在50℃下烘干,得到SiO2包覆的LiNi0.5Mn1.5O4正极材料。纯相LiNi0.5Mn1.5O4在循环100个循环之后容量保持率为59%,而3%(质量分数)包覆的复活正极材料循环100次的容量保持率为87%(图6)。
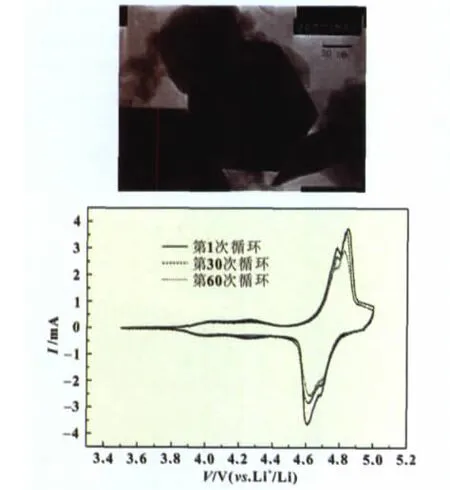
图6 Yukai Fan等人制备的LiNi0.5Mn1.5O4及其性能测试
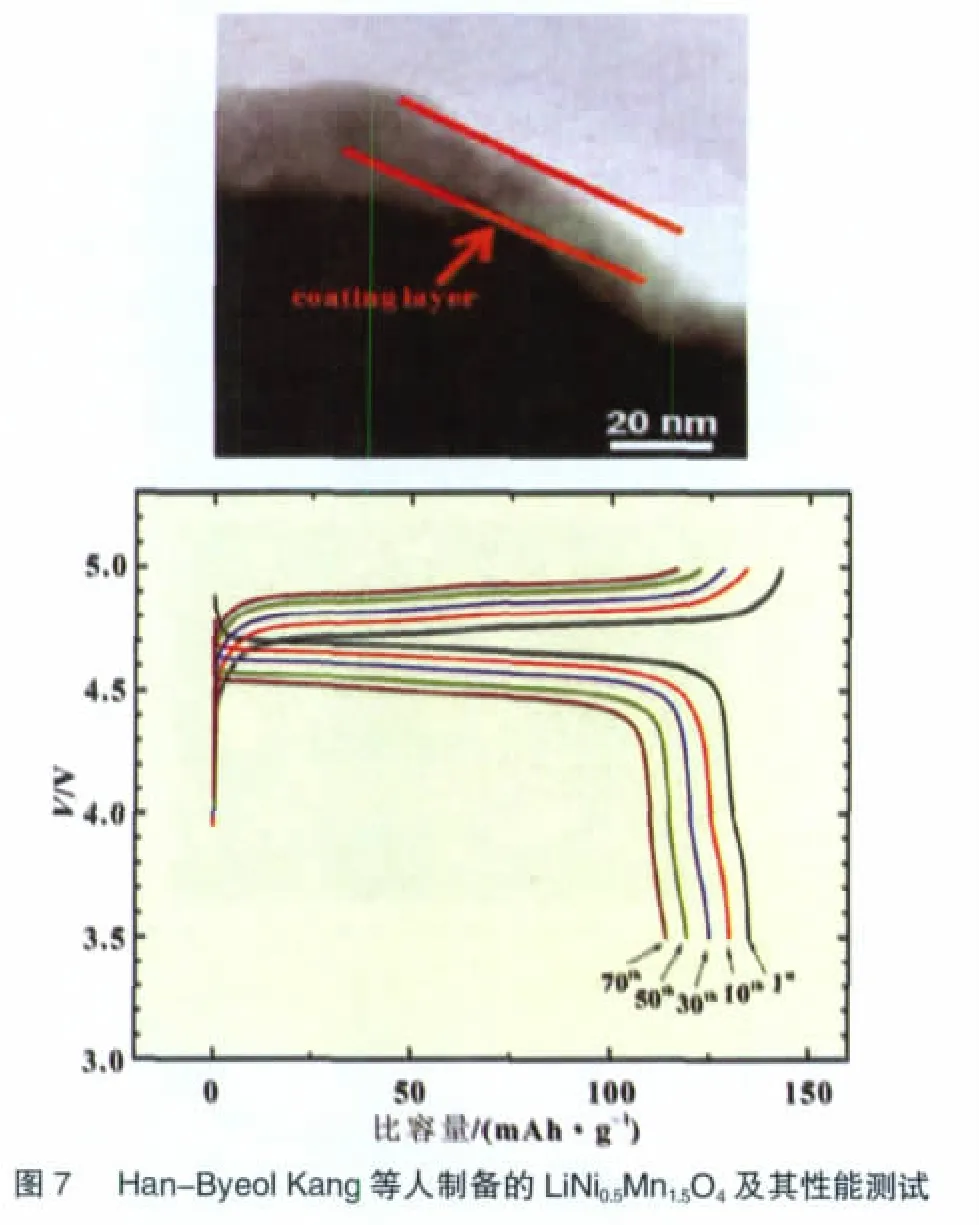
Han-Byeol Kang等[31]采用共沉淀法制备了纯相LiNi0.5-Mn1.5O4粉末,再将Bi(NO3)3·5 H2O溶于去离子水中,加入柠檬酸和NH4F,再用氨水调节pH,将溶胶与LiNi0.5Mn1.5O4粉末混合均匀后在110℃烘干,再在450℃下烧结5 h,得到BiOF包覆的LiNi0.5Mn1.5O4正极材料粉末。纯相LiNi0.5Mn1.5O4和BiOF包覆的LiNi0.5Mn1.5O4的首次放电比容量都在130 mAh/g左右,而循环70周期后,纯相LiNi0.5Mn1.5O4材料比容量衰减到41.4 mAh/g,而BiOF包覆的LiNi0.5Mn1.5O4的比容量保持在114 mAh/g(图 7)。
4 结束语
随着电动汽车发展,对于电极材料的要求越来越高,尤其是正极材料。尖晶石LiNi0.5Mn1.5O4具有较高电压平台(4.7 V),因此其作为动力电池正极材料具有广泛应用前景。但是,现阶段的商用锂离子电池中常见的碳酸酯类电解液分解电压较低、电化学窗口较窄和纯度不够高等问题,限制了尖晶石LiNi0.5Mn1.5O4的广泛应用,要实现镍锰酸锂正极材料在电动汽车中的大规模应用,必须进一步解决上述问题,同时降低制备成本,考虑工业化可行性。本文前述的各种提高和改善LiNi0.5-Mn1.5O4正极材料性能的方法,仅是从研究的角度探讨了其原理和工艺的可行性,为镍锰酸锂动力电池正极材料的发展提供新的思路。
前述的各种方法虽然在一定程度上提高或改善了LiNi0.5-Mn1.5O4正极材料的循环性能,但同时也存在着其不足之处,如金属离子掺杂的LiNi0.5Mn1.5O4正极材料制备工艺比较繁琐,同时对正极材料容量造成一定降低,不利于工业化生产和使用;带包覆层的正极材料虽然可以抑制容量的衰减,但对正极材料的倍率性能将会造成一定影响,不利于在动力电池中使用,同时,包覆工艺比较复杂,距离工业化仍存在一定的距离。
因此,在未来的研究中,从简化制备工艺、降低生产成本着手,实现上述的制备方法的工业化以及锂离子电池商用电解液和负极材料(比如钛酸锂)的同步发展是今后LiNi0.5Mn1.5O4正极材料研究和开发的重点。
[1]刘景,温兆银,吴梅梅,等.锂离子电池正极材料的研究进展[J].无机材料学报,2002,17(1):1-9.
[2]HUGGINS R A.Advanced Batteries:Materials Science Aspects[M].Berlin,Germany:Springer Science&Business Media,2009.
[3]FERGUS J W.Recent developments in cathode materials for lithium ion batteries[J].Journal of Power Sources,2010,195:939-954.
[4]陈立泉.锂离子电池正极材料的研究进展[J].电池,2002,32(1):6-8.
[5]THACKERY M M.Structural consideration of layered and spinel lithiated oxides for lithium ion batteries[J].J Electrochem Soc,1995,142(8):2558-2563.
[6]XIA Y Y,ZHOU Y H,YOSHIO M.Capacity fading on cycling of 4 V C/LiMn2O4Cells[J].J Electrochem Soc,1997,144(8):2593-2600.
[7]JANG D H,OH S M.Effects of carbon additives on spinel dissolution and carhodic capacity losses in 4 V Li/LixMn2O4rechargeable cells[J].Electrochim Acta,1998,43(9):1023-1029.
[8]梁英,饶睦敏,蔡宗平,等.锂离子电池正极材料LiMn2O4改性研究进展[J].电池工业,2009,14(1):69-72.
[9]OHZUKU T,TAKEDA S,IWANAGA M.Solid-state redox potentials for Li[Me1/2Mn3/2]O4(Me:3d-transition Metal)having spinelframework structures:A series of 5 volt materials for advanced lithium-ion batteries[J].J Power Sources,1999,81-82:90-94.
[10]AMDOUNI N,ZAGHIB K,GENDRON F,et al.Magnetic properties of LiNi0.5Mn1.5O4spinels prepared by wet chemical methods[J].J Magn Magn Mater,2007,309:100-105.
[11]AMDOUNI N,ZAGHIB K,GENDRON F,et al.Structure and insertion properties of disordered and ordered LiNi0.5Mn1.5O4spinels prepared by wet chemistry[J].Ionics,2006,12:117-126.
[12]MUHARREM K,JAFAR F A,GLENN G A.High-power nanostructured LiMn2-xNixO4high-voltage lithium-ion battery electrodematerials:electrochemical impact of electronic conductivity and morphology[J].Chem Mater,2006,18:3585-3592.
[13]ATANASOV M,BARRAS J L,BENCO L,et al.Electronic structure,chemical bonding,and vibronic coupling in MnIV/MnIII mixed valent LixMn2O4spinels and their Effect on the dynamics of intercalated Li:A cluster study using DFT[J].J Am Chem Soc,2000,122:4718-4728.
[14]SUN Qiang,LI Xin-hai,WANG Zhi-xing,et al.Synthesis and electrochemical performance of 5 V spinel LiNi0.5Mn1.5O4prepared by solid-state reaction[J].Trans Nonferrous Met Soc China,2009,19:176-181.
[15]CHEN Zhao-yong,ZHU Hua-li,JI Shan,et al.Performance of Li-Ni0.5Mn1.5O4prepared by solid-state reaction[J].Journal of Power Sources,2009,189:507-510.
[16]FANG X,Ding N,FENG X Y,et al.Study of LiNi0.5Mn1.5O4synthesized via a chloride-ammonia co-precipitation method:Electrochemical performance,diffusion coefficient and capacity loss mechanism[J].Electrochimica Acta,2009,54:7471-7475.
[17]LIU Dong-qiang,HAN Jian-tao,GOODENOUGH J B.Structure,morphology,and cathode performance of Li1-x[Ni0.5Mn1.5]O4prepared by coprecipitation with oxalic acid[J]. Journal of Power Sources,2010,195:2918-2923.
[18]HWANG B J,WU Y W,VENKATESWARLU M,et al.Influence of synthesis conditions on electrochemical properties of high-voltage Li1.02Ni0.5Mn1.5O4spinel cathode material[J].Journal of Power Sources,2009,193:828-833.
[19]XIAO Li-fen,ZHAO Yan-qiang,YANG Yan-yan,et al.Electrochemical properties of nano-crystalline LiNi0.5Mn1.5O4synthesized by polymer-pyrolysis method[J].J Solid State Electrochem,2008,12:687-691.
[20]ZHANG Li,LV Xiao-yan,WEN Yan-xuan,et al.Carbon combustion synthesis of LiNi0.5Mn1.5O4and it's use as a cathode material for lithium ion batteries[J].Journal of Alloys and Compounds,2009,480:802-805.
[21]PARK S H,SUN Y K.Synthesis and electrochemical properties of 5 V spinel LiNi0.5Mn1.5O4cathode materials prepared by ultrasonic spray pyrolysis method[J].Electrochimical Acta,2004,50:431-434.
[22]ARREBOLA J C,CABALLERO A,HERNAN L,et al.PMMA-assisted synthesis of Li1-xNi0.5Mn1.5O4for high-voltage lithium batteries with expanded rate capability at high cycling temperatures[J].Journal of Power Sources,2006,180:852-858.
[23]陈颖超.高功率型尖晶石锰酸锂正极材料的制备及掺杂改性研究[D].长沙:国防科技大学,2010:75-89.
[24]OH S H,CHUNG K Y,JEON S H,et al.Structural and electrochemical investigations on the LiNi0.5-xMn1.5-yMx+yO4(M=Cr,Al,Zr)compound for 5 V cathode material[J].Journal of Alloys and Compounds,2009,469:244-250.
[25]DU Guo-dong,NULI Yan-na,YANG Jun,et al.Fluorine-doped Li-Ni0.5Mn1.5O4for 5 V cathode materials of lithium-ion battery[J].Materials Research Bulletin,2008,43:3607-3613.
[26]AKLALOUCH M,ROJAS R M,MARÍ J,et al.The role of particle size on the electrochemical properties at 25 and at 55℃of the LiCr0.2Ni0.4Mn1.4O4spinel as 5 V-cathode materials for lithium-ion batteries[J].Electrochimica Acta,2009,54:7542-7550.
[27]WANG Hai-long,XIA Hui,LAI Man-on,et al.Enhancements of rate capability and cyclic performance of spinel LiNi0.5Mn1.5O4by trace Ru-doping[J].Electrochemistry Communications,2009,11:1539-1542.
[28]MATSUMMURA Y,WANG S,MONDORI J.Mechanism leading to irreversible capacity loss in ion rechargeable batteries[J].J Electrochem Soc,1995,142(9):2914-2918.
[29]SUN Y K,YOON C S,OH I H.Surface structural change of ZnO-coated LiNi0.5Mn1.5O4spinel as 5 V cathode materials at elevated temperatures[J].Electrochimica Acta,2003,48:503-506.
[30]FAN Yu-kai,WANG Jian-ming,TANG Zheng,et al.Effects of the nanostructured SiO2coating on the performance of LiNi0.5Mn1.5O4cathode materials for high-voltage Li-ion batteries[J].Electrochimica Acta,2007,52:3870-3875.
[31]KANG H B,MYUNG S T,AMINE K,et al.Improved electrochemical properties of BiOF-coated 5 V spinel Li[Ni0.5Mn1.5]O4for rechargeable lithium batteries[J].Journal of Power Sources,2010,195:2023-2028.
