MTT法测定甲壳低聚糖对肠道微生物生长的影响
2012-06-01肖凯军王兆梅
李 娜,肖凯军,庞 浩,王兆梅,*
(1.华南理工大学轻工与食品学院,广东 广州 510640;2.中国科学院 广州化学研究所纤维素化学重点实验室,广东 广州 510650)
MTT法测定甲壳低聚糖对肠道微生物生长的影响
李 娜1,肖凯军1,庞 浩2,王兆梅1,*
(1.华南理工大学轻工与食品学院,广东 广州 510640;2.中国科学院 广州化学研究所纤维素化学重点实验室,广东 广州 510650)
以肠道益生菌(保加利亚乳杆菌、嗜热链球菌)和肠道腐败菌(金黄色葡萄球菌、沙门氏菌)为研究对象,通过用MTT法来考察甲壳低聚糖对肠道微生物生长的影响。结果表明:在一定质量浓度(0.1~0.8g/100mL)范围内,甲壳低聚糖对肠道益生菌保加利亚乳杆菌、嗜热链球菌均有明显的增殖作用;随着菌体培养基糖(甲壳低聚糖)质量浓度的增大,甲壳低聚糖对肠道腐败菌金黄色葡萄球菌、沙门氏菌抑制效果增强;同时分子质量1kD的甲壳低聚糖比分子质量3kD的对微生物生长的影响更为显著。
MTT法;甲壳低聚糖;肠道微生物
甲壳低聚糖(chitosan oligosaccharide,COS)是甲壳素经脱乙酰基和降解生成的一类低聚合度、可溶于水的氨基糖类化合物[1],因其具有良好的水溶性、保湿型、抑菌抗菌等生物学活性从而被广泛应用于化妆品、食品及医药方面[2-3]。而这些生物活性的强弱与COS的分子质量和脱乙酰度大小有关[4-6]。彭益强等[7]研究发现在一定的分子质量范围内,随着分子质量和壳聚糖质量浓度的增加,壳聚糖对金黄色葡萄球菌,短小芽孢杆菌等阳性菌的抗菌作用效果增强。对大肠杆菌等阴性菌来说,壳聚糖还受到细菌表面性质影响,细菌亲水性越好,所带的负电荷越多,壳聚糖表现抑菌性能越好[8]。
在对低聚壳聚糖进行抑菌实验的过程中,细菌计数方法的选择至关重要。传统的计数方法有血球板计数法、浊度法、菌体干质量法、平板稀释法等,而平板稀释法过程繁琐、耗时长、重复性差,不能及时反映菌体生长情况,而其他几种方法不能区分细胞死活。而近年来发展起来的四甲基偶氮唑盐(MTT)比色法具有简单、快速、灵敏、稳定等特点被用于生物细胞的活性检测[9-11]。本实验选择两种肠道益生菌(保加利亚乳杆菌、嗜热链球菌)和两种肠道腐败菌(金黄色葡萄球菌、沙门氏菌),采用MTT法检测甲壳低聚糖和低聚果糖对其生长活性的影响,为低聚糖和益生菌临床配伍使用提供一定的理论基础。
1 材料与方法
1.1 菌种与培养基
保加利亚乳杆菌(Lactobecillus bulgaricus)、嗜热链球菌(Streptococcu themophilus)、金黄色葡萄球菌(Staphylococcus aureus)、沙门氏菌(Salmonella),由广东微生物种质资源库提供。
保加利亚乳杆菌和嗜热链球菌用固体MRS培养基培养,金黄色葡萄球菌和沙门氏菌用固体营养琼脂培养基培养。
1.2 试剂与仪器
甲壳低聚糖(脱乙酰度为72%,分子质量分别为1kD (COS1)和3kD(COS2))为粤式食品 实验室自制;低聚果糖(FOS,含量55%) 新金山生物科技有限公司;噻唑蓝(MTT)、二甲基亚砜(DMSO) 美国Sigma公司。
XSP-3CA型单目生物显微镜 日本Olympus公司;DG5032型酶联免疫检测仪 南京华东电子集团医疗装备有限责任公司;UV-2102PC型紫外-可见分光光度计 上海Unico公司;PYX-250G-B型光照培养箱 广东韶关科力实验仪器有限公司;LS-B35L-I型高压灭菌锅 广州永程实验仪器有限公司。
1.3 方法
1.3.1MTT比色实验[12-13]
将活化的细菌溶于灭菌的PBS溶液(pH7.0)[14],并倍比稀释成20~27共8个梯度,分别对不同浓度的菌液做MTT比色实验,同时做平板菌落计数。
用微量吸液器吸取不同浓度的菌液100μL,分别加入96孔酶标板中,每个浓度的样液做5个复孔,分别加入MTT溶液,放入37℃恒温培养箱中,20min后取出,向各孔分别加入一定量的DMSO,用全自动酶标仪于最大吸收波长570nm处测定OD值,测量前振动60s。
1.3.2 培养基糖质量浓度与菌株活菌数相关性的建立
用MTT法测定不同浓度菌液的光密度值(OD570nm),以不同浓度菌液的OD570nm(X)为横坐标,菌液浓度(Y)为纵坐标作图,得出不同菌株的OD570nm值-菌液浓度曲线及相关系数。同时采用平板菌落计数[12]测定糖甲壳低聚不同质量浓度条件下的活菌数,间接得出OD570nm值与菌株活菌数的曲线,从而得出不同分子质量的甲壳低聚糖对肠道益生菌和腐败菌生长的影响。
2 结果与分析
2.1 最优MTT法的建立
MTT法能够快速测定活菌数目,但是由于其精确度与细菌种类、细菌的生长状态及其代谢产物有关[15-16],因此为了达到较高的精确度,必须针对实验条件下的菌种建立最优的MTT法。通过对各种加入试剂的OD值测定得到表1。

表1 各种干扰试剂条件下的OD570nm值Table 1 Absorbance at 570 nm in the presence of various interference factors
由表1可知,各种液体介质都会对OD570nm值的测量结果造成干扰。其中菌体本身的干扰程度最大,菌体浓度过高,将导致误差的增大。
以灭活后的待测菌液代替活菌液为空白对照,待测菌液各100μL,以MTT溶液10μL或20μL和是否添加DMSO设置4种反应条件。经过测定4种菌分别在4种反应条件下的OD570nm值与菌液浓度曲线的参数(R2),得出最佳的实验方案,结果见表2。

表2 不同菌种的最佳实验方案Table 2 Optimal experimental designs for different strains
通过对稀释度为27的菌液做平板菌落计数,得到该浓度菌液所含的细菌浓度。结合表2得出不同菌种在最佳方案下,各个稀释度菌液对应的OD570nm值和菌液浓度。对OD570nm值-菌液浓度绘制曲线,可得各个细菌的工作曲线及菌液浓度测量范围及相关系数如表3。

表3 不同菌种的工作曲线方程Table 3 Working curves for different strains
由表3可知,在一定菌液浓度范围内,OD570nm值和菌液细菌浓度呈现良好的相关性,相关系数可以达到0.99以上,在该浓度范围内可以保证结果具有较高的精确度。
2.2 甲壳低聚糖对肠道益生菌生长的影响
2.2.1 甲壳低聚糖对保加利亚乳杆菌体外生长的影响
以低聚果糖作阳性对照,同时以质量浓度分别为0、0.2、0.4、0.6、0.8、1.0g/100mL的不同分子质量的甲壳低聚糖(COS1和COS2)为碳源,用MTT法测定OD570nm值进而得到低聚果糖质量浓度与活菌数量的关系曲线,如图1所示。
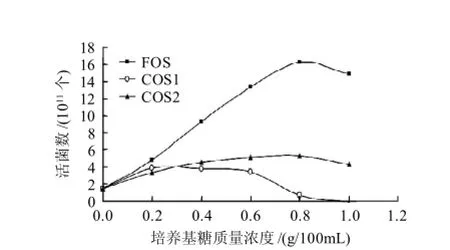
图1 培养基糖质量浓度对保加利亚乳杆菌生长的影响Fig.1 Effect of oligo-chitosan on the growth of Lactobecillus bulgaricus
由图1可知,在一定的质量浓度范围内,低聚果糖、COS1和COS2对保加利亚乳杆菌都有增殖作用,随着质量浓度的增大,增殖作用越显著。低聚果糖的最佳增殖质量浓度为0.8g/100mL,但COS2增殖作用没有低聚果糖显著。对COS1而言,在质量浓度为0.2g/100mL条件下达到了最佳的增殖效果,且在该质量浓度下增殖作用超过了COS2,略低于低聚果糖。随着COS1质量浓度的增加,增殖效果开始减弱,当质量浓度达到0.7g/100mL左右,相对增殖作用近似于0,质量浓度超过这一点后,则表现出对微生物生长的抑制作用,可能是因为高质量浓度的低聚糖在培养基中形成了高的渗透压,对细菌产生了一定的脱水作用,抑制了其生长,质量浓度过低促进作用又不明显[17]。
2.2.2 甲壳低聚糖对嗜热乳酸链球菌体外生长的影响
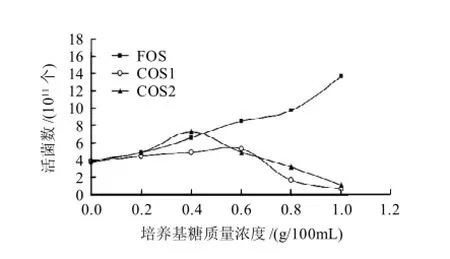
图2 培养基糖质量浓度对嗜热乳酸链球菌生长的影响Fig.2 Effect of oligo-chitosan on the growth of Streptococcu themophilus
由图2可知,低聚果糖在0~1.0g/100mL质量浓度范围内对嗜热乳酸链球菌都具有明显的增殖作用,增殖作用随着低聚果糖的质量浓度增加而增加。COS1在0~0.6g/100mL质量浓度范围内对嗜热乳酸链球菌有一定的增殖作用,但增殖作用不显著。相对COS1而言,COS2在低质量浓度0~0.4g/100mL之间,对嗜热乳酸链球菌有明显的增殖作用,其效果优于其他两种糖类,其最佳增殖质量浓度为0.4g/100mL。当质量浓度超过0.6g/100mL后,微生物已经无法完全利用甲壳低聚糖,过量的壳聚糖给细菌的生长带来阻碍,抑制了细菌的增殖,细菌数量锐减,低于无糖对照组。增殖作用机理可能与其氨基葡萄糖聚合物的性质有关,或者与其易溶于弱酸的特性有关。壳聚糖在酸性环境中溶解形成胶体[18],这种胶体性质促进了双歧杆菌、乳酸杆菌的繁殖,但其确切的作用机理,还有待进一步研究。
2.3 甲壳低聚糖对肠道腐败菌生长的影响
2.3.1 甲壳低聚糖对金黄色葡萄球菌生长的影响
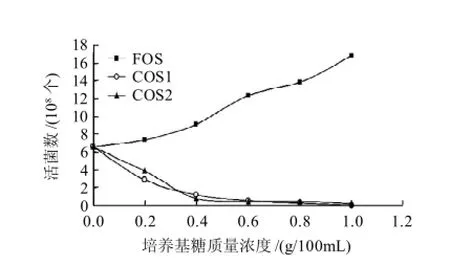
图3 培养基糖质量浓度对金黄色葡萄球菌生长的影响Fig.3 Effect of oligo-chitosan on the growth of Staphylococcus aureus
由图3可知,低聚果糖与甲壳低聚糖对金黄色葡萄球菌的生长影响呈现出两个极端。低聚果糖对金黄色葡萄球菌有显著的增殖作用,随着质量浓度的增加而不断加强。与此同时,COS1与COS2对金黄色葡萄球菌都表现强烈的抑制作用。两条曲线近乎重叠,0~0.4g/100mL质量浓度范围内,活菌数量急剧下降,质量浓度超过0.4g/100mL后,活细菌的数量已经很少,培养基中已经基本不生长细菌。由于金黄色葡萄球菌属于革兰氏阳性菌,细胞壁含有丰富的磷壁酸,壳聚糖不能通过静电作用吸附到细菌表面,因此,壳聚糖主要通过表面渗透进入细胞内,吸附细胞体内带有阴离子的细胞质,并发生絮凝作用,扰乱细胞正常的生理活动,导致壳聚糖诱导达到细菌细胞组分泄漏,从而抑制细菌生长[19]。
2.3.2 甲壳低聚糖对沙门氏菌生长的影响
由图4可知,低聚果糖对沙门氏菌有显著增殖的作用,曲线呈现上升趋势。两种甲壳低聚糖对沙门氏菌呈现抑制作用,其中COS1对沙门氏菌的抑菌作用显著高于COS2。沙门氏菌属于革兰氏阴性菌,细菌细胞壁排列比较疏散,因此壳聚糖分子进入细菌细胞内与细菌DNA结合, 干扰DNA结构,从而抑制细菌生长。壳聚糖分子质量越小,越容易进入细菌细胞内,所以抑菌效果随壳聚糖分子质量降低而增强[8]。
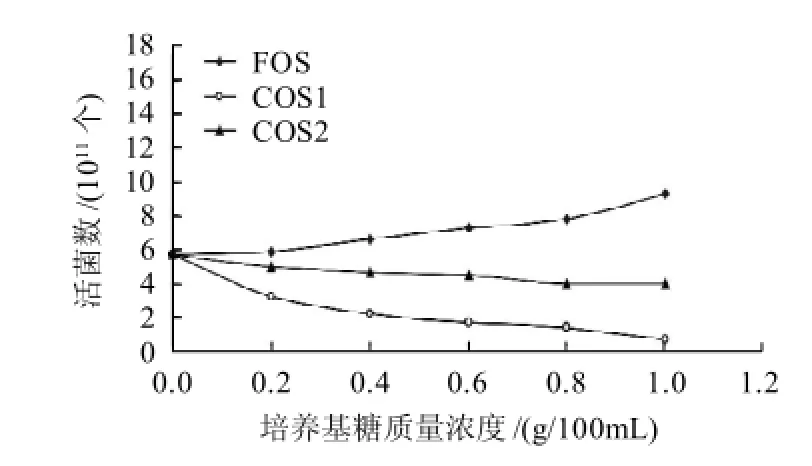
图4 培养基糖质量浓度对沙门氏菌生长的影响Fig.4 Effect of oligo-chitosan on the growth of Salmonella
3 结 论
本实验研究了两种不同分子质量的甲壳低聚糖(COS1和COS2)对肠道微生物体外益生菌和腐败菌生长的影响,结果发现:在一定质量浓度范围内(0.1~0.8g/100mL),COS1和COS2促进保加利亚乳杆菌和嗜热乳酸链球菌的生长。COS1和COS2对金黄色葡萄球菌和沙门氏菌都有较好的抑菌作用,抑菌作用随着质量浓度的增大而增强。同时低分子质量的甲壳低聚糖COS1对微生物生长的影响更为显著。与低聚果糖不同,甲壳低聚糖对微生物的生长具有选择性,即促进益生菌增殖、抑制腐败菌生长,为益生菌产品研发提供一定的参考价值,也为研究开发合生元产品提供技术支持。
[1]ENEL S, McCLURE S J. Potential applications of chitosan in veterinary medicine[J]. Advanced Drug Delivery Reviews, 2004, 56(10): 1467-1480.
[2]王军, 周本权, 杨许召, 等. 低聚壳聚糖的制备及应用研究进展[J].日用化学工业, 2010, 40(2): 124-127.
[3]MADY M M, DARWISH M M. Effect of chitosan coating on the characteristics of DPPC liposomes[J]. Journal of Advanced Research, 2010, 1(3): 187-191.
[4]SINGLA A K, CHAWLA M. Chitosan: some pharmaceutical and biological aspects: an update[J]. Journal of Pharmacy and Pharmacology, 2001, 53(8): 1047-1067.
[5]HUANG M, KHOR E, LIM L Y. Uptake and cytotoxicity of chitosan molecules and nanoparticles: effects of molecular weight and degree of deacetylation[J]. Pharmaceutical Research, 2004, 21(2): 344-353.
[6]邵荣, 许琦, 余晓红, 等. 壳聚糖抗菌性能的研究[J]. 食品科学, 2007, 28(9): 121-124.
[7]彭益强, 朱丽萍, 刘雯, 等. 可溶性低聚壳聚糖的制备与抗菌性能研究[J]. 食品科学, 2007, 28(2): 98-101.
[8]李小芳, 冯小强, 杨声. 壳聚糖对革兰氏阴性菌抑菌机理的初步研究[J]. 食品科学, 2010, 31(13): 148-153.
[9]杨翠云, 刘永定. MTT方法评价微生物细胞活性的探讨[J]. 水生生物学报, 2009, 33(4): 577-580.
[10]ARSECULERATNE S N, ATAPATTU D N. The assessment of the viability of the endospores of Rhinosporidium seeberi with MTT (3-[4, 5-dimethyl-2-thiazolyl]-2,5-diphenyl-2H-tetrazolium bromide)[J]. The British Mycological Society, 2004, 108(12): 1423-1430.
[11]王忠朝, 范丽苑, 蔡炜. MTT法用于检测伴放线菌嗜血菌的研究[J].现代医药卫生, 2010, 26(8): 1121-1123.
[12]魏鸿刚, 李元, 刘健. 一种快速的活菌计数新方法研究[J]. 微生物学通报, 2002, 29(2): 89-92.
[13]王栩, 邬于川, 夏世平, 等. MTT法进行活菌计数的方法学探讨[J].泸州医学院学报, 2002, 25(4): 291-293.
[14]黄立坤, 杜鹏, 霍贵成. MTT法测定乳酸菌活菌数的研究[J]. 食品工业, 2008(3): 62-65.
[15]赵承彦, 靖志安, 牛青霞. MTT显色反应实验条件分析[J]. 河南医学研究, 2000, 9(2): 107-116.
[16]YOUNG F M, PHUNGTAMDET W, SANDERSON B J S. Modification of MTT assay conditions to examine the cytotoxic effects of amitraz on the human lymphoblastoid cell line, WIL2NS[J]. Toxicology in Vitro, 2005, 19(8): 1051-1059.
[17]万荣峰, 王丽平, 江善祥. 两种低聚糖对乳酸菌体外增殖的影响[J].中国组织工程研究与临床康复, 2007, 11(19): 3768-3770.
[18]LEE H W, PARK Y S, JUNG J S, et al. Chitosan oligosaccharides, dp 2-8, have prebiotic effect on the Bifidobacterium bifidium and Lactobacillus sp.[J]. Food Microbiology, 2003, 8(6): 319-324.
[19]陈威, 吴清平, 张菊梅. 壳聚糖抑菌机制的初步研究[J]. 微生物学报, 2008, 48(2): 164-168.
Effect of Oligo-chitosan on the Growth of Intestinal Microorganisms as Determined by MTT Assay
LI Na1,XIAO Kai-jun1,PANG Hao2,WANG Zhao-mei1,*
(1. College of Light Industry and Food Science, South China University of Technology, Guangzhou 510640, China;2. Key Laboratory of Cellulose and Lignocellulosics Chemistry, Guangzhou Institute of Chemistry, Chinese Academy of Sciences, Guangzhou 510650, China)
The effect of oligo-chitosan on the growth of intestinal microorganisms was studied using MTT assays. The results indicated that oligo-chitosan could obviously accelerate the proliferation of Lactobecillus bulgaricus and Streptococcu themophilus at the concentration range of 0.1ˉ0.8 g/100 mL, while the antibacterial activity of oligo-chitosan against Staphylococcus aureus and Salmonella was strengthened with increasing oligo-chitosan concentration. The oligo-chitosan with molecular weight of 1 kD revealed more obvious impact on the growth of intestinal microorganisms than the oligo-chitosan with molecular weight of 3 kD. Key words:MTT assay;oligo-chitosan;intestinal microorganisms
TS252.1
A
1002-6630(2012)03-0101-04
2011-03-17
国家自然科学基金项目(31071505);华南理工大学中央高校基本科研业务费专项(2009ZM0187);华南理工大学广东省大学生创新实验项目(S1010561061)
李娜(1986—),女,硕士研究生,研究方向为糖质资源分离纯化及应用。E-mail:linadream1986@163.com
*通信作者:王兆梅(1974—),女,副教授,博士,研究方向为天然多糖生物活性及应用。E-mail:wangzm@scut.edu.cn
