耐有机溶剂脂肪酶产生菌的筛选及其粗酶酶学性质
2012-06-01李俊峰李红芳段效辉门晋名
李俊峰,李红芳,段效辉,门晋名,宿 烽
(1. 青岛科技大学化工学院,山东 青岛 266042;2. 烟台出入境检验检疫局,山东 烟台 264000)
耐有机溶剂脂肪酶产生菌的筛选及其粗酶酶学性质
李俊峰1,李红芳1,段效辉2,门晋名1,宿 烽1
(1. 青岛科技大学化工学院,山东 青岛 266042;2. 烟台出入境检验检疫局,山东 烟台 264000)
以体积分数2%苯为筛选压力,利用罗丹明B平板显色法和摇瓶发酵法,从采集的花生地土壤样品中分离筛选得到1株中度耐热、耐碱脂肪酶产生菌,编号为H2。通过形态观察、生理生化特性实验及其16S rDNA基因序列对菌种进行鉴定。结果表明,H2菌株与短小芽孢杆菌(Bacillus pumilus)的亲缘关系最紧密。通过研究得到该菌株的摇瓶发酵条件:产酶培养基为:蛋白胨3%、酵母膏1%、NaCl 0.5%、橄榄油1%,pH7.0,摇瓶发酵温度为28℃,摇床转速为180r/min,发酵周期为48~60h。所产脂肪酶在40℃、pH9.0时酶活性最高,对pH值和温度的适应范围较宽,pH6.0~10.0比较稳定,35~50℃具有较高酶活性。
耐有机溶剂;短小芽孢杆菌;脂肪酶;筛选
脂肪酶(EC3.1.1.3)是一类特殊的酰基水解酶,除能够催化甘油酯类化合物的水解和合成外,还能在油水界面上催化酯的水解和合成、酯交换、生物表面活性剂的合成、多肽合成、高聚合物合成和手性药物合成等有机合成反应,它可将甘油三酯分解成脂肪酸和甘油或进行其逆反应[1-3],在工业生产中有着广泛应用。目前,脂肪酶在工业生产中被广泛应用于食品与营养、轻工业、皮革、香料、化妆品、洗涤剂、有机合成、药物合成等领域[4-5]。脂肪酶催化的许多反应是在非水相中进行的,由于许多微生物和其分泌的酶在有机溶剂中会被破坏和失活,限制了生物转化在化学工业上的应用[6],因此从自然界中寻找耐有机溶剂、高活力的脂肪酶菌株,可为脂肪酶开发提供基础。
芽孢杆菌脂肪酶具有来源广泛、分子质量小、表达分泌能力强、非水相体系酶学性质突出、催化功能多、稳定性好和底物特异性多样化等优点,是当前脂肪酶研究领域的热点之一[7-10]。Hun等[11]利用苯与甲苯混合物作为碳源,成功筛选出耐有机溶剂的脂肪酶生产菌。Sameshima等[12]也从汽油污染的土壤中分离得到了耐苯菌株Rhodococcus opacus B-4,该菌株具有很好的有机溶剂耐受性,在有机溶剂中可存活5d并保持催化活性。本实验以苯为唯一碳源,从环境样品中筛选耐受有机溶剂脂肪酶活性较高的细菌,采用形态学特征、理化性质及16S rDNA基因序列鉴定其种属,并对其酶学性质进行初步研究,为其进一步应用提供理论依据。
1 材料与方法
1.1 材料与试剂
本实验采集的样品有:盐碱地土壤、花生地土壤、稻田土壤、金银滩土壤、油井边土壤、红树林根基土壤及红树林根部水样,共7个样本。
对硝基棕榈酸苯酯(p-NPP) 美国Sigma 公司;橄榄油 天津口维可国际贸易有限公司;罗丹明B 上海试剂三厂;聚乙烯醇(PVA) 天津市巴斯夫化工有限公司;酚酞天津市大茂化学试剂厂;其他化学试剂均为国产分析纯。
1.2 培养基
初筛培养基(g/L):Na2HPO43.5、KH2PO41.5、MgSO4·7H2O 0.5、NaCl 0.5,pH7.5,121℃高压蒸汽灭菌20min,无菌条件下加入体积分数2.0%苯(0.22μm过滤除菌);富集培养基(g/L):Na2HPO43.5、KH2PO41.5、MgSO4·7H2O 0.5、NaCl 0.5、酵母粉 0.2,pH7.5,再加乳化橄榄油(将4g聚乙烯醇加热溶于100mL蒸馏水中,然后与橄榄油以体积比3:1的比例混合,超声搅拌乳化2min),121℃高压蒸汽灭菌20min;油脂同化平板培养基(g/L):Na2HPO43.5、KH2PO41.5、MgSO4·7H2O 0.5、NaCl 0.5、琼脂20,橄榄油乳化液体积分数12%、调至pH7.5,121℃高压蒸汽灭菌20min,冷却至45℃左右加罗丹明B,倒平板备用;LB平板培养基(g/L):蛋白胨10、酵母膏5、NaCl 5、琼脂15、pH7.0,121℃高压蒸汽灭菌20min,倒平板备用。
产脂肪酶发酵培养基(g/L):M1:可溶性淀粉25、橄榄油乳化液2.5、蛋白胨15,pH8.5;M2:胰蛋白胨20、豆油3.0、NaNO31、K2HPO41、MgSO45,pH8.0;M3:豆饼粉20、牛肉粉20、可溶性淀粉10、K2HPO45、NaNO35,pH7.0;M4:可溶性淀粉10、豆饼粉20、K2HP4O 5、NaNO32,pH8.5;M5:蛋白胨40、(NH4)2SO41、MgSO4·7H2O 1、K2HPO41,pH 8.0;M6:蛋白胨20、蔗糖10、橄榄油乳化液10、(NH4)2SO45、MgSO45、K2HPO42,pH8.0;M7:蛋白胨30、酵母膏10、NaCl 5、橄榄油10,pH7.0;M8:蛋白胨10、酵母膏5、NaCl 5,pH7.0。
1.3 酶活力测定
采用棕榈酸-对硝基苯酯法测定[13]。
1.4 菌株的筛选
1.4.1 耐有机溶剂菌株的筛选
称取样品5g放入95mL无菌水中小火加热至沸腾,维持1min,杀灭不产芽孢的细菌,静置5min,取上清液5mL,加入初筛培养基中28℃、180r/min振荡培养2d。观察培养基浑浊度的变化。
1.4.2 产脂肪酶菌株的筛选
取上述浑浊度较大的培养液适量接种到富集培养基中,富集后取少量菌液涂布到油脂同化平板培养基,培养48h后在350nm紫外光照射下观察菌落周围荧光圈直径的大小和变化,选取荧光圈较大的菌落,LB平板培养基划线进行纯培养,温度28℃。
1.5 粗酶液酶学性质研究
M7培养基接种所筛选的H2菌株,28℃、180r/min振荡培养2d,发酵液于4℃低温10000×g离心20min,取上清液,用棕榈酸-对硝基苯酯法测定脂肪酶酶活力,进行酶学性质研究。
1.5.1 有机溶剂耐受性能考察
在粗酶液中添加终体积分数为25%不同极性常数(logP)的有机溶剂,40℃、180r/min振荡2h后,测定酶活力。以不加有机溶剂的原酶液为对照计算相对酶活力。
1.5.2 酶作用最适pH值及其pH值稳定性
分别用0.1mol/L HCl或0.1mol/L NaOH溶液调粗酶液pH值为6.0~10.0,40℃反应10min,测定酶活力,以确定该酶的最适pH值。用0.1mol/L HCl或0.1mol/L调粗酶液为不同pH值,4℃处理粗酶液12h,回调至9.0,40℃保温10min,测定酶活力,以研究该酶的pH值稳定性。以最高酶活力作为100%计算相对酶活力,每组重复3次,结果取平均值。
1.5.3 酶作用最适温度及其热稳定性
取粗酶液,调pH9.0,分别于25~65℃水浴中反应10min,测定酶活力,以确定该酶的最适温度。在不同温度(40~80℃)条件下进行酶的热稳定性研究,期间每隔10min测定酶活力,酶促反应条件同上,持续1h。以最高酶活力作为100%计算相对酶活力,每组重复3次,结果取平均值。
1.6 菌株的鉴定
形态学特征观察和生理生化性质实验参考文献[14]方法,根据曾晓希等[15]的方法提取基因组DNA,以其为模板,采用16S rDNA通用引物,通过PCR扩增其16S rDNA基因序列,将扩增片段送上海生工生物工程技术服务有限公司测序,结果在NCBI中检索比对,获得有关种的公认标准序列数据后采用Clustal X 1.8软件比对,使用MEGA 4.0进行序列同源性分析并绘制系统发育树,算法为Neighbor-Joining。
2 结果与分析
2.1 耐有机溶剂菌株的筛选

表1 培养液浑浊度的变化Table 1 Change in culture turbidity during incubation of strains from different sources
培养液浑浊度变化见表1,结果显示,稻田土壤和花生地土壤样品在培养初期就变得浑浊,在第3天变得非常浑浊,表明这两种样品培养液中的微生物可以有效利用苯,并迅速生长,其他样品中微生物利用苯效率较低。因此,选择来自稻田地土壤和花生地土壤的微生物培养液进行脂肪酶产生菌的筛选。
在2017年结束之前,我们去了很多不同的火锅店消费,评头论足着每一家的优缺点,顺便摄影。虽然离住家很近,不知不觉路过的机会也很高,而我再三犹豫,还是毅然决然的,放弃走入西瓜甜点涮涮锅店内消费。
2.2 产脂肪酶菌株的筛选

表2 各菌株的产脂肪酶活力比较Table 2 Comparison of lipase activities produced by strains from different sources
采用油脂同化平板培养基筛选得到6株纯培养菌株,分别命名为D1、D2、D3、H1、H2、H3。分别把6株菌接种于LB发酵培养基中,28℃、180r/min的摇床上培养48h后,取上清液测定酶活力。由表2可知,酶活力最高的是来自花生地土壤的菌株H2,选择该菌株做进一步研究。
2.3 发酵培养基的选择
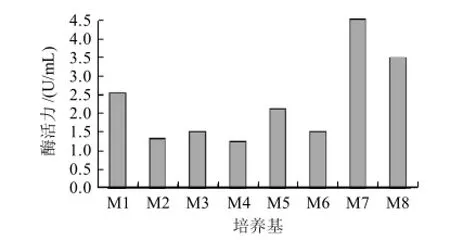
图1 不同培养基对H2菌株所产脂肪酶的影响Fig.1 Effect of different culture media on lipase production by strain H2

表3 菌株H2粗酶对不同有机溶剂的耐受能力Table 3 Effect of organic solvents on the stability of crude lipase from strain H2
将H2菌株分别接种到发酵培养基M1、M2、M3、M4、M5、M6、M7和M8中,于28℃、180r/min振荡培养48h,测定其粗酶液的酶活力。由图1可知,以M7为发酵培养基时,脂肪酶酶活力最高,达到4.53U/mL,以下实验均选择M7作为发酵培养基。
2.4 发酵周期考察

图2 不同发酵时间对H2菌株所产脂肪酶的影响Fig.2 Effect of fermentation time on lipase production by strain H2
取不同发酵时间的粗酶液进行酶活力测定,由图2可知,发酵48h之前,酶活力上升趋势比较明显,发酵48h之后,酶活力变化趋于稳定,到72h酶活力开始略有下降。因此发酵时间选择48~60h为宜。
2.5 摇床转速和培养温度对H2产脂肪酶的影响

图3 摇床转速和培养温度对H2菌株产脂肪酶的影响Fig.3 Effect of rotational speed and temperature on lipase production by strain H2
2.6 酶学性质初步研究
2.6.1H2菌株粗酶液有机溶剂耐受性能
由表3可知,总体而言,随着有机溶剂logP值的增加,对酶活性影响逐渐减小,说明菌株对有机溶剂的耐受性越好。粗酶对25%苯和甲苯的耐受性较差,苯是筛选H2菌株的压力条件,说明菌株和其分泌的酶对有机溶剂的耐受性可以有所不同。细菌细胞有细胞壁和细胞膜作为屏障,阻碍了有机溶剂与胞内酶的直接接触,而释放到胞外的酶直接同有机溶剂作用,酶活力可能受到影响,如果酶的耐受性不够,其活性会降低甚至丧失。
2.6.2H2菌株粗酶最适反应pH值及其pH值稳定性

图4 pH值对H2菌株所产脂肪酶粗酶活性的影响Fig.4 Effect of pH on the activity of crude lipase from strain H2

图5 pH值对H2菌株所产脂肪酶粗酶稳定性的影响Fig.5 Effect of pH on the stability of crude lipase from strain H2
由图4可见,相对酶活力最高峰出现在pH 9.0处,表明H2菌株所产脂肪酶在pH值为9.0时酶活性最高。由图5可见,H2菌株所产脂肪酶在pH 6.0~10.0范围内比较稳定,当pH值低于5.0时,酶活性受到比较大的影响。
2.6.3 H2菌株粗酶最适反应温度及热稳定性

图6 温度对H2菌株所产脂肪酶粗酶活性的影响Fig.6 Effect of temperature on the activity of crude lipase from strain H2
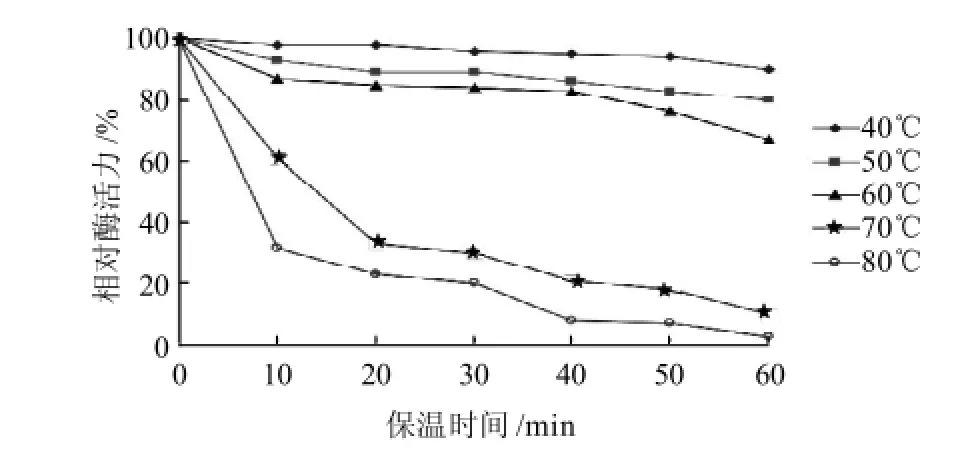
图7 温度对H2菌株所产脂肪酶粗酶稳定性的影响Fig.7 Effect of temperature on the stability of crude lipase from strain H2
由图6 可见,相对酶活力在25~40℃之间随着温度的升高而增大,在40℃时达到最大,50℃以上相对酶活力逐渐降低。由图7可见,H2菌株所产脂肪酶在60℃条件下保温40min稳定性较好,70℃条件下保温相对酶活力急剧下降,保温20min相对酶活力仅为30%;而在80℃条件下仅保温10min,酶活力就下降了70%,40min后相对酶活力几乎为0,表明该酶在35~50℃之间具有较高的酶活性,H2菌株所产脂肪酶属于中度耐热脂肪酶。
2.7 H2菌株鉴定结果
2.7.1 主要生理生化特性
H2菌株在LB平板培养基上菌落呈圆形,白色,边缘不整齐,表面粗糙,不透明;经革兰氏染色,确定为革兰氏阳性菌,菌体杆状,好氧,中生芽孢(图8);可利用D-葡萄糖、L-阿拉伯糖、D-甘露糖、蔗糖产酸;不消化琼脂,水解明胶,不利用淀粉;利用柠檬酸盐,硝酸盐还原反应阴性,并可在含7%以下NaCl的LB培养基上生长;最适生长温度28℃;接触酶阳性;V-P实验反应阳性。参照《伯杰细菌鉴定手册》[14]初步鉴定为短小芽孢杆菌。

图8 H2菌株菌落形态(a)和菌体形态(b)(×1600)Fig.8 Colony morphology of strain H2(×1600)
2.7.2 16S rDNA 的扩增
按1.5节方法对菌株H2的16S rRNA 序列扩增,琼脂糖凝胶电泳后,在1000~2000bp之间可看到一条清晰条带,约1500bp(图9)。割胶回收目的片段进行测序。

图9 H2菌株16S rRNA序列的PCR电泳图Fig.9 Agarose gel electrophoresis of 16S rRNA sequence of strain H2
2.7.316 S rDNA序列同源性分析及系统进化树的建立
经上海生工生物工程技术服务有限公司测序得到较完整的16S rDNA序列,与NCB1上已有序列进行Blast同源性检索,发现其16S rDNA 和多数Bacillus pumilus的同源性达99%以上,对该序列构建系统进化树,结果见图10。发现进化树上H2菌株和Bacillus pumilus属于同一簇,遗传距离几乎为0,因此可初步判断H2菌株的分类地位属于Bacillus pumilus。同属于Bacillus属的枯草芽孢杆菌集中在另外一簇,而其他一些芽孢杆菌菌株则属于独立分支。
3 讨 论
从花生地土壤分离筛选得到耐有机溶剂脂肪酶产生菌H2,经产酶发酵条件的初步研究,确定适宜的发酵培养基为M7,培养温度为28℃,摇床转速为180r/min,摇瓶发酵周期为48~60h。酶学性质初步研究结果表明:该脂肪酶在40℃,pH 9.0时酶活性最高,可见H2菌株所产脂肪酶属于中度耐热、耐碱脂肪酶;稳定性研究表明:该酶在pH 6.0~10.0范围内比较稳定,在35~50℃之间具有较高的酶活性,说明此酶对温度和pH值适应的范围较宽,为其广泛应用于食品工业提供了有利条件。脂肪酶在油脂加工、洗涤剂、皮革、造纸、食品、医药、化妆品、纺织等领域都有十分广泛的应用。在食品工业中的应用主要集中在食用油脂改性、改善食品风味、改进食品质量及保健食品生产等方面。由于H2菌株所产脂肪酶可耐受部分有机溶剂,因此,在有机溶液中催化酯交换作用来改变低价脂肪性能,生产一些重要的多不饱和脂肪酸,利用菜子油生产生物柴油,在玉米油、葵花油、花生油、橄榄油和大豆油的生产等方面都具有潜在的应用价值。
通过分析H2菌株的16S rDNA基因序列,发现H2菌株与Bacillus pumilus具有最紧密的亲缘关系。从形态学、生理生化特性及分子生物学水平上的鉴定结果可确定H2菌株为Bacillus pumilus。H2菌株作为工业生产菌所具有的优势有:能形成抗性内生孢子——芽孢,有利于菌种的保藏,因其属于常温菌,所以可降低工业化成本,如发酵条件和设备要求等。因此,H2菌株具有开发耐热、耐碱脂肪酶的潜在价值。该菌株的产酶能力还不能满足工业生产要求,有必要通过诱变和遗传育种的手段对H2菌株作进一步研究。
[1]彭立凤, 赵汝淇, 谭天伟. 微生物脂肪酶的应用[J]. 食品与发酵工业, 2000, 26(3): 72-76.
[2]REETZ M T. Lipases as practical biocatalysts[J]. Curr Opin Chem Biol, 2002, 6(2): 145-150.
[3]PABLO D M, JOSE V S, TSAI S W, et al. Carica papaya lipase (CPL): an emerging and versatile biocatalyst[J]. Biotechnol Adv, 2006, 24: 493-499.
[4]UWE T B, COMELIUS B, RAMISETTI S, et al. Optimizing lipases and related enzymes for efficient application[J]. Trends Biotechnol, 2002, 20(10): 433-437.
[5]谈重芳, 王雁萍, 陈林海, 等. 微生物脂肪酶在工业中的应用及研究进展[J]. 食品工业科技, 2006, 27(7): 193-195.
[6]詹喜, 王庆利, 邹慧熙, 等. 有机溶剂中固定化酵母细胞催化香叶醇还原生物转化的研究[J]. 浙江大学学报: 农业与生命科学版, 2006, 32(4): 391-395.
[7]ZHANG Jinhong, GUAN Rong, TAN Zhilei, et a1. Purification and properties of lipases/esterases from a Bacillus strain for enantioselective resolution of (S)-ketoprofen[J]. Artificial Cells Blood Substitutes and Biotechnology, 2005, 33(4): 435-445.
[8]DANDAVATE V, JINJALA J, KEHARIA H, et al. Production, partial purification and characterization of organic solvent tolerant lipase from Burkholderia multivorans V2 and its application for ester synthesis[J]. Bioresource Technology, 2009, 100: 3374-3381.
[9]van POUDEROYEN G, EGGERT T, JAEGER K E, et al. The crystal structure of Bacillus subtilis lipase: a minimal α/β hydrolase fold enzyme[J]. Journal of Molecular Biology, 2001, 309: 215-226.
[10]温建新, 施碧红, 吴伟斌, 等. 脂肪酶产生菌Bacillus subtilis FS321的分离鉴定及其产酶条件的初步优化[J]. 食品与发酵工业, 2008, 32(2): 37-41.
[11]HUN C J, RAHMAN R N Z A, SALLEH A B, et al. A newly isolated organic solvent tolerant Bacillus sphaericus 205y producing organic-solvent stable lipase[J]. Biochemical Engineering Journal, 2003, 15(2): 147-151.
[12]SAMESHIMA Y, HONDA K, KATO J, et al. Expression of Rhodococcus opacus alkB genes in anhydrous organic solvents[J]. Journal of Bioscience and Bioengineering, 2008, 106(2): 199-203.
[13]李俊, 王刚, 吕熹, 等. 响应面法优化耐有机溶剂脂肪酶营养条件[J].生物技术, 2010, 20(4): 66-69.
[14]希坎南R E, 吉本斯N E. 伯杰细菌鉴定手册[M]. 中国科学院微生物研究所《伯杰细菌鉴定手册》翻译组, 译. 北京: 科学出版社, 1989: 23-46.
[15]曾晓希, 周洪波, 刘飞飞, 等. 一株胶质芽孢杆菌的筛选和鉴定[J].湖南农业大学学报: 自然科学版, 2006, 32(3): 269-272.
Screening of Organic Solvent Tolerant Lipase-Producing Bacteria and Enzymatic Properties of Crude Lipase
LI Jun-feng1,LI Hong-fang1,DUAN Xiao-hui2,MEN Jin-ming1,SU Feng1
(1. College of Chemical Engineering, Qingdao University of Science and Technology, Qingdao 266042, China;2. Yantai Entry-Exit Inspection and Quarantine Bureau, Yantai 264000, China)
A moderately thermostable and alkali-resistant lipase-producing strain named as H2 was isolated from peanut plantation soil using 2% benzene by Rhodamine B plate assay and shake flask fermentation. It was preliminarily identified based on morphological and physiological characteristics. Meanwhile, the 16S rDNA gene of the strain was cloned and sequenced. The physiological and biochemical characterization and phylogenetic tree based on the 16S rDNA sequence showed that the strain was highly homologous to Bacillus pumilus. The optimal culture medium for lipase production by the strain was composed of 3% peptone, 1% yeast extract, 0.5% NaCl, 1% olive oil, pH 7.0, and the optimal fermentation conditions of temperature, rotational speed and time were 28 ℃, 180 r/min and 48ˉ60 h, respectively. The lipase produced under these conditions revealed the highest activity at 40 ℃ and pH 9.0. The lipase was stable over a broad range of pH (6.0ˉ10.0) and temperature (35ˉ50 ℃).
organic solvent tolerant;Bacillus pumilus;lipase;screening
Q939.96
A
1002-6630(2012)03-0116-05
2011-01-07
中国烟草总公司山东省公司科技计划项目(KN172);国家质量监督检验检疫总局科研基金项目(2007IK154)
李俊峰(1971—),男,讲师,博士,研究方向为微生物代谢产物。E-mail:lijf1999@qust.edu.cn
