发酵豆制品中高产转氨酶菌株筛选及固态菌剂制备
2012-06-01秦礼康
伍 玲,秦礼康*
(贵州大学生命科学学院,贵州 贵阳 550025)
发酵豆制品中高产转氨酶菌株筛选及固态菌剂制备
伍 玲,秦礼康*
(贵州大学生命科学学院,贵州 贵阳 550025)
为缩短传统大豆发酵制品后熟期,基于转氨反应这一主要风味形成途径,现从贵州各地采集风味良好的豆豉、腐乳等发酵样品,经稀释涂布平板法分离得到150株细菌。通过支链氨基酸转氨酶活力测定,从中筛选出WDH-8菌株具有最高酶活力,菌种鉴定后确定其为地衣芽孢杆菌,属安全益酵菌株,其支链氨基酸转氨酶活力达36.53U/mL。为便于生产应用,对该菌株进行固态菌剂培养基配方实验,以转氨酶活力为指标,培养基最佳配方为:黄豆粉25g、水料比1:1(V/m)、氯化钠添加量5%、葡萄糖添加量3%,其酶活力达到37.965U/mL。
大豆发酵;转氨酶;菌剂;地衣芽孢杆菌
发酵豆制品因其独特的风味,成为广受喜爱的食品之一。它除了含有大豆本身的营养成分如大豆异黄酮外,在发酵过程中还产生了类黑精等二次活性成分,因此它的营养价值也越来越受到重视[1],随着需求量逐渐增加,使得高质高产的工业化生产工艺成为今后的必然趋势。然而,传统的大豆发酵制品多采用传统生产技术手段,它必须经过一个较长的后发酵期后才能形成大豆发酵制品独特饱满的风味。例如,传统腐乳发酵周期需要经过8~12个月,腐乳的色、香、味才能达到国家质量标准要求[2]。所以发酵豆制品当前存在的问题之一就是要通过开发新工艺,解决后熟期长的主要矛盾[3]。目前,对加快发酵豆制品后熟方法的研究已取得的成果有:刘会勇等[4]通过调整温度、添加增香酵母和复合酶来实现缩短腐乳的发酵周期;刘超兰等[5]应用乳酸菌和酵母共培养技术缩短郫县豆瓣酱陈酿周期等。而基于氨基酸代谢的研究方法还未见相关报道。
研究表明,在形成大豆发酵制品特征风味物质的众多生化途径中,以蛋白质降解及其氨基酸代谢最为关键[6]。因为蛋白质网络结构破裂所引起的质构改变,有利于滋香味化合物的释放,降解产生的短肽和游离氨基酸,不仅直接赋予产品滋味[7],而且还可作为挥发性化合物的前体,经氨基酸水解酶、转氨酶等催化进行次生代谢或者与还原糖进行Maillard反应,形成大量的挥发性风味物质[8-9]。如源于苯丙氨酸(Phe)等芳香族氨基酸(ArAAs)的苯乙醇等;源于亮氨酸(Leu)等支链氨基酸(BcAAs)的异戊酸等[10-12]。因此,本研究以氨基酸的代谢为切入点,通过从贵州各地的发酵豆制品的原始发酵菌群中筛选出具有较高氨基酸水解酶活性菌株,将其扩大培养后制成菌剂,在传统的工艺基础上进行强化发酵,对加快后熟有一定的意义。
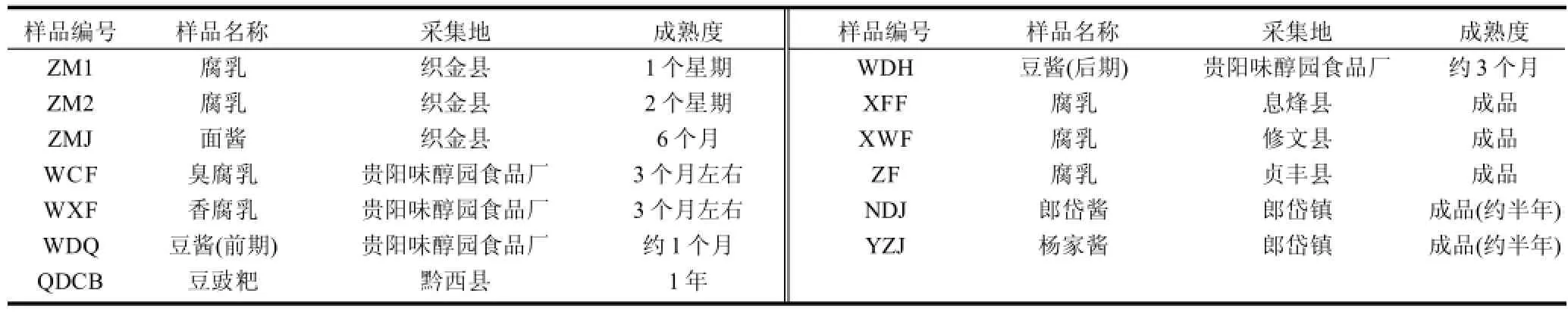
表1 供试菌株来源及编号Table 1 Details of strains tested in this study
1 材料与方法
1.1 菌株与培养基
实验菌株:于贵州各地采集到的发酵豆制品中分离到150株细菌实验室斜面保存,菌株来源及详情见表1。
基础培养基:牛肉膏蛋白胨培养基;种子培养基:25g玉米粉溶于1000mL水中煮沸后6层纱布过滤,然后按葡萄糖20g/L、蛋白胨10g/L、KH2PO41g/L、MgSO4·7H2O 0.5g/L加入过滤后的玉米汁中;发酵培养基:配方同种子培养基。
1.2 试剂与仪器
丙酮酸、5’-磷酸吡哆醛、十六烷基三甲基溴化铵 上海生工生物工程有限公司;L-亮氨酸、丙氨酸、重蒸馏苯酚 北京索莱宝科技有限公司;2,4-二硝基苯肼 天津市科密欧化学试剂有限公司;其他试剂均为分析纯。
TGL20M台式高速冷冻离心机 长沙迈佳森仪器设备有限公司;UV-7502 PC紫外-可见分光光度计 上海欣茂仪器有限公司;HH.B11.420S型电热恒温培养箱 上海跃进医疗器械厂。
1.3 方法
1.3.1 菌种复壮活化
将所有保存菌株平板划线,观察菌落形态是否一致;再将菌株细胞染色后于油镜下观察其形态特征是否单一。确定菌种为纯种没有污染杂菌后,菌株接种牛肉膏蛋白胨斜面培养基传代2~3次,恢复其良好的生长能力。
1.3.2 菌株筛选
1.3.2.1 初筛[13]
活化后菌株接种于种子培养基中,于37℃振荡培养箱中160r/min培养16h。转接发酵培养基,每株菌平行接种3次,于37℃、160r/min培养24h。取10mL培养液经4000r/min冷冻离心20min后收集菌体,将5mL转氨底物溶液加入收集到的菌体中,37℃振荡反应6h后利用纸层析法检测丙氨酸,选取3次平行实验分离斑颜色均较深者为阳性菌株。
1.3.2.2 酶活力检测
阳性菌株接种发酵培养基经37℃、160r/min发酵培养24h后,按文献[13]的方法:取5mL发酵液加入5mL底物溶液,0.5mL 2%的十六烷基三甲基溴化铵溶液,37℃振荡反应1h后,加入0.5mL 10%三氯乙酸终止反应。利用紫外分光光度法检测丙酮酸,根据丙酮酸的减少量来计算转氨酶的酶活力。在37℃振荡反应条件下,将每小时每毫升菌液转化丙酮酸的量(μmol)定义为1个酶活力单位(U)。
1.3.2.3 丙酮酸测定
采用紫外分光光度法[14]测定。
1.4 菌株鉴定
1.4.1 形态学观察
筛选得到的目标菌株按文献[15]方法抹片、革兰氏染色后在油镜下观察其属于革兰氏阳性还是阴性,同时观察细胞形态。再经芽孢染色油镜观察是否产芽孢及芽孢生长位置。菌种接牛肉膏蛋白胨琼脂平板培养基,培养48h后观察菌落形态。
1.4.2 生理生化鉴定[16]
根据形态观察结果,按照《伯杰氏细菌鉴定手册》第八版对菌株进行相应的生理生化实验鉴定。
1.4.316 S rDNA提取测序
采用通用引物:正向27F:5'-AGAGTTTGATCCTG GCTCAG-3';反向1492R:5'-TACCTTGTTACGACTT-3'。PCR扩增程序为:94℃ 4min;94℃ 50s,60℃ 90s,72℃ 60s,25个循环;72℃ 10min。PCR产物送南京金斯瑞生物科技有限公司测序。将测序所得的序列在NCBI上进行序列比对,下载相似度98%以上的序列,用MEGA5.05软件进行系统发育树创建分析。
1.5 菌剂的制备
1.5.1 培养基配方单因素试验
大豆磨成粉状经40目过筛,称取25g分装300mL三角瓶。取25g大豆粉,选取水料比(V/m)3:5、1:1、7:5、9:5;葡糖糖添加量分别为5%、10%、15%、20%,氯化钠添加量分别为5%、10%、15%、20%,进行单因素试验,灭菌后接种菌株,37℃培养3d。无菌操作将培养物装入灭菌纸袋内,放入40℃烘箱中鼓风干燥(因考虑到温度过高会杀死细菌,减少活菌数;同时温度过低又会延长后期烘干时间,所以选择40℃为烘干温度)。干燥3d后培养物中水分已基本蒸发,能够研钵磨成粉状。最后称取1g培养物按1.3.2.2节方法检测酶活力。
1.5.2 正交试验优化
在单因素试验的基础上,根据水料比、葡糖糖添加量和氯化钠添加量对菌株产转氨酶酶活力的影响,设计L9(33)正交试验,因素水平设计见表2。

表2 正交试验因素水平设计表Table 2 Factor and levels in orthogonal array design
2 结果与分析
2.1 菌株筛选
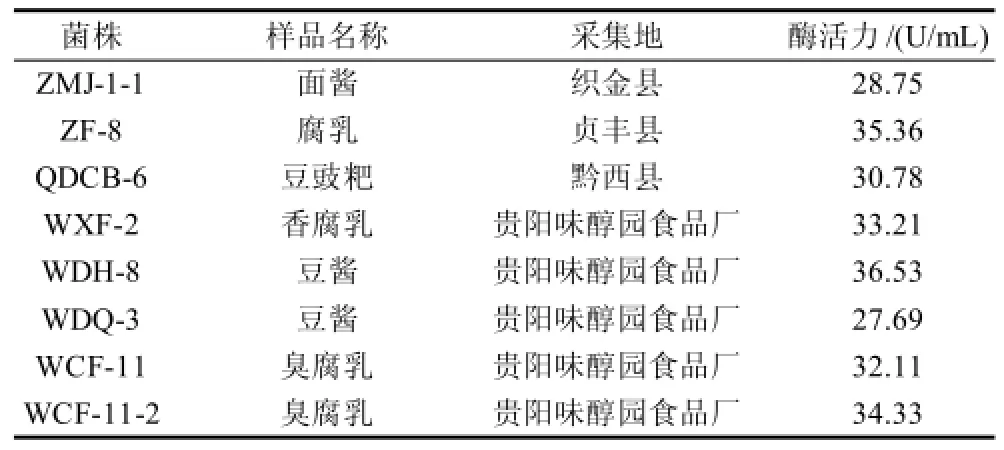
表3 高转氨酶菌株的来源及酶活力Table 3 Sources and activities of aminotransferase-producing strains
经过初筛,从分离到的150株细菌中选出8株产支链氨基酸转氨酶的菌株作为出发菌株。测定酶活力后,其中8株具有转氨酶活性的菌株详情见表3。菌株WDH-8酶活力最高,为36.53U/mL。酶活力越高表明菌株本身具有较强的产酶能力,在发酵过程中催化转氨基反应能力越强,越能加快氨基酸分解为小分子风味物质或转化为其他产生风味的氨基酸,因此选取其作为制备大豆制品后熟菌剂的出发菌株。
2.2 菌株鉴定
经过稀释平板法观察到菌株菌落乳白色,表面湿润不光滑,边缘呈发射分支状。经牛肉膏蛋白胨液体培养后,菌液澄清,表面形成菌膜。油镜观察细胞形态,菌株革兰氏阳性,细胞呈短杆状单生,芽孢端生。可初步判定菌株为芽孢杆菌。其他生理生化结果见表4。
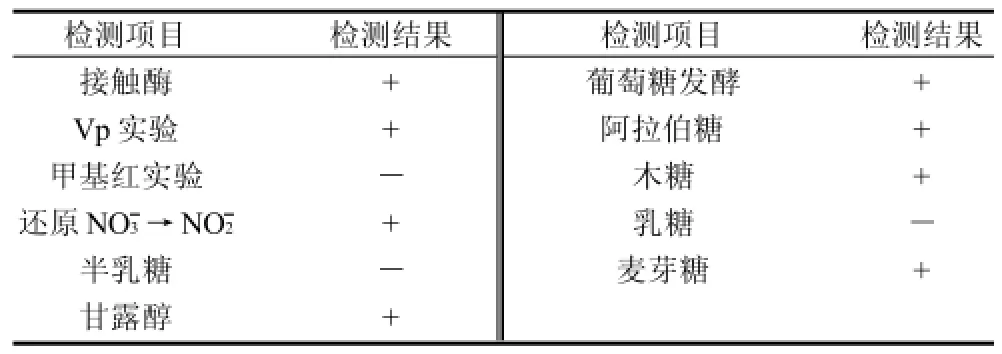
表4 生理生化鉴定结果Table 4 Physiological and biochemical properties of strain WDH-8
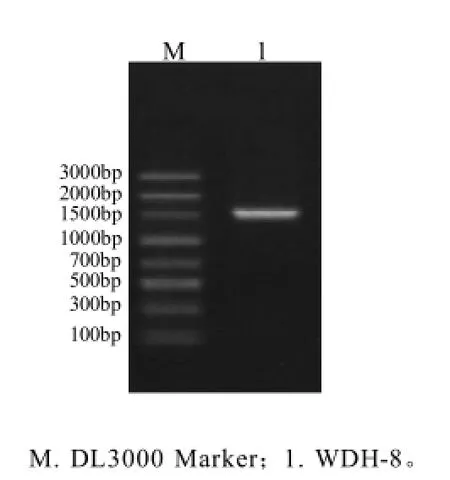
图1 菌株WDH-8电泳图Fig.1 Agarose gel electrophoresis of strain WDH-8
对菌株WDH-8的16S rDNA序列进行扩增,经琼脂糖凝胶电泳后结果见图1,扩增条带清晰,大小约为1500bp,没有其他扩增条带,因此可判定其为菌株WDH-8 16S rDNA的扩增条带。经测序后得知菌株扩增片段大小为1505bp,将序列与NCBI数据库BLAST中现有的数据进行序列比对,结果显示它与地衣芽孢杆菌的序列相似度达到99%。下载GenBank数据库中相似性98%以上的序列,利用Clusta W软件进行多序列比对并进行人工校正,按照邻接法聚类,经自举法1000次重复进行检验,得到系统发育树(图2)。在进化树中,菌株WDH-8同GenBank中的Bacillus licheniformis类聚于同一分支,步长为100,序列同源性为99%。结合形态学特征和生理生化鉴定结果,将菌株WDH-8鉴定为地衣芽孢杆菌。

图2 基于16S rDNA序列的系统发育树Fig.2 Phylogenetic tree based on 16S rDNA sequences of selected strains
2.3 菌株WDH-8培养条件优化
2.3.1 单因素试验
2.3.1.1 水料比对酶活力的影响
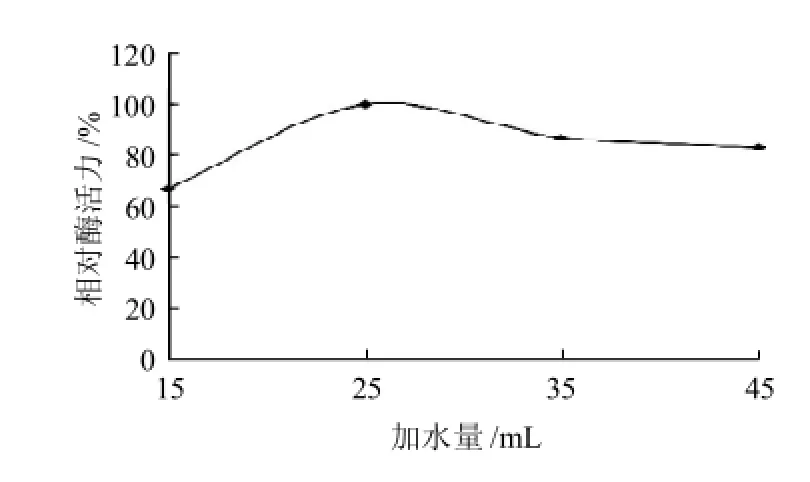
图3 25g大豆粉加水量对菌株WDH-8产酶酶活力的影响Fig.3 Effect of material-to-water ratio on aminotransferase production
将最高酶活定义为100%,水料比对菌株产酶的影响如图3所示。当以25g大豆粉为标准发酵底物,加水量25mL(即水料比为1:1)时,酶活力达到最高,加水量15mL(水料比为3:5)时的酶活力明显低于最高酶活力,而当加水量大于25mL后,酶活力大小差异未十分明显。结合考虑水料比对后期烘干时间有直接的影响(水分越多烘干时间越长),选择水分含量适中,且酶活力较高的培养条件,所以将水料比设在3:5~7:5之间。
2.3.1.2 氯化钠添加量对酶活力的影响
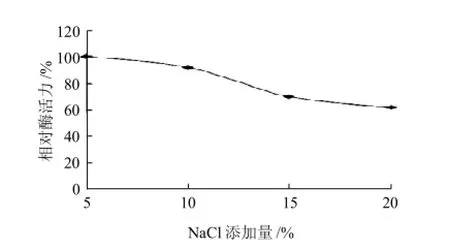
图4 氯化钠添加量对菌株WDH-8产酶酶活力的影响Fig. 4 Effect of sodium chloride concentration on aminotransferase production
由图4可知,氯化钠添加量为5%、10%时,根据感官,其发酵物颜色呈深棕褐色,酱香味浓郁,且酶活较为接近;此后,随着氯化钠添加量的逐渐增加,发酵物颜色变浅香味变淡,酶活也随着降低。可推断,过量的氯化钠对菌株的生长具有抑制作用,所以将氯化钠添加量设为3%~8%。
2.3.1.3 葡萄糖添加量对酶活力的影响
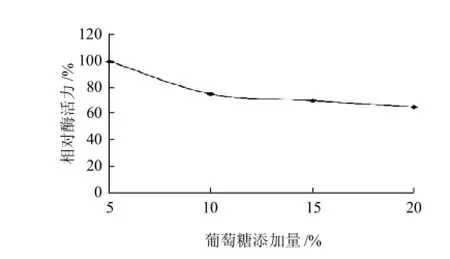
图5 葡萄糖添加量对菌株WDH-8产酶酶活力的影响Fig.5 Effect of glucose concentration on aminotransferase production
由图5可知,当葡萄糖添加量为5%时,发酵物呈棕褐色,酱香味较浓,酶活力较高。之后当葡萄糖添加量逐渐增加,发酵物颜色变浅、香味变淡且与添加量5%时差异大,酶活力明显下降,说明葡萄糖添加量过多,菌株生长势能较弱,所以将葡萄糖添加量设为1%~5%。
2.3.2 正交试验结果分析
由表5可见,影响菌株产酶活的因素主次关系是氯化钠添加量>葡萄糖添加量>水料比。最佳配方为A2B2C2,即以25g大豆粉为固定底物时,水料比1:1、氯化钠添加量5%、葡萄糖添加量3%。最后根据最佳配方配制培养基,进行3组平行验证实验,其菌株WDH-8酶活力平均值达到37.965U/mL,较9组试验组高,证明通过正交试验得到的最佳配方有效。方差分析结果见表6。
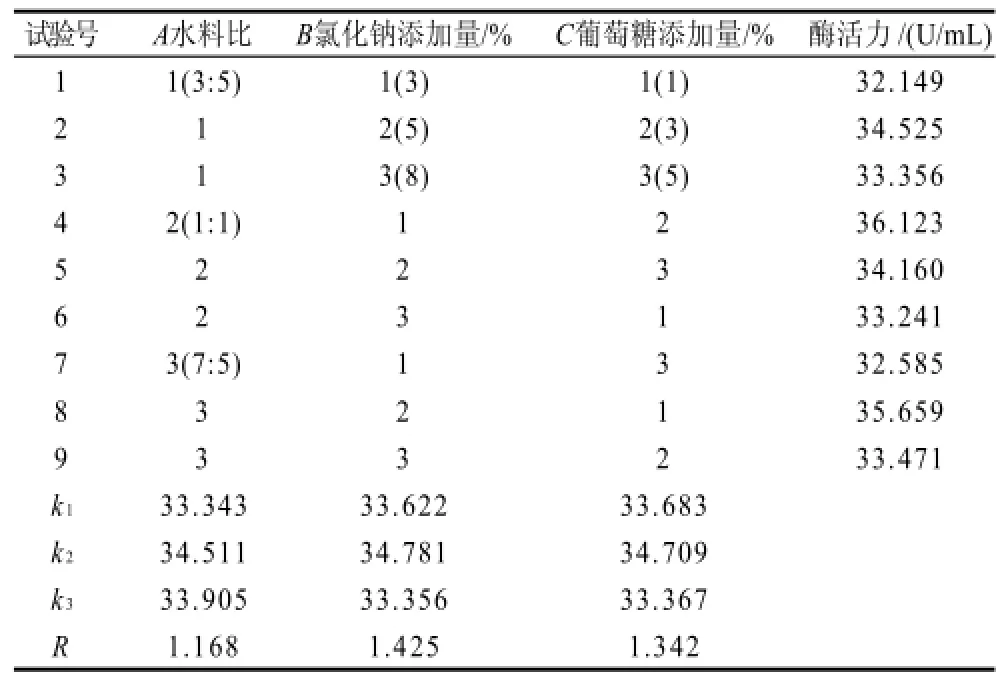
表5 正交试验结果Table 5 Orthogonal array design and results
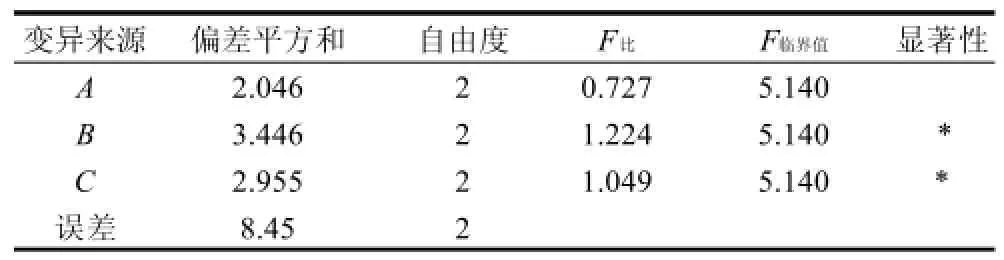
表6 方差分析表Table 6 Variance analysis for the experimental results of orthogonal array design
3 结论与讨论
3.1 从贵州各地风味较好的发酵豆制品中筛选出一株支链氨基转氨酶活性较高的菌株。经鉴定为地衣芽孢杆菌,可作为发酵豆制品的强化发酵菌株。
3.2 对该菌进行固态菌剂制备的培养基配方研究,确定最佳配方为大豆粉25g、水料比1:1、葡萄糖添加量3%、氯化钠添加量5%。目前国内外对干酪促熟方法的研究较为成熟,其中发酵剂在奶酪的后熟研究中应用较多,在成熟过程中,发酵剂的微生物细胞破裂,所含的多种蛋白酶及肽酶便释放出来,蛋白酶、肽酶可使蛋白质分解成长短各异的肽链,然后进一步降解成更短的小肽和多种氨基酸,其中的一些小肽和氨基酸是特定风味物质的前体,或直接形成了牛奶干酪的风味[17]。所以,本研究利用制备发酵剂的方法对分离得到的高产氨基酸水解酶菌株进行扩大培养,能够快速、大量的培养出目的菌株。并且在扩大培养及保存菌种的整个过程中,条件要求低,能够确保不提高生产成本。同时,首次利用大豆粉作为发酵豆制品益酵菌株的载体,由于它与发酵产品的原料基质一致,以至于在强化发酵时添加发酵剂后,它不会因加入额外成分而影响发酵产品的风味,对加快发酵食品后熟周期的研究具有一定的意义。
3.3 由于大豆发酵食品,发酵过程中化学反应复杂,产生的氨基酸种类多,本实验仅作了其中支链氨基酸的水解酶菌株研究,而具有其他氨基酸水解酶活性的菌株有待筛选和研究。
[1]秦礼康. 陈窖豆豉粑益酵菌、风味物及黑色物质研究[D]. 无锡: 江南大学, 2006.
[2]李娟. 低盐腐乳的研究[J]. 农产品加工, 2008(5): 212-221.
[3]彭湘屏, 卢红梅. 腐乳研究新进展[J]. 中国调味品, 2010, 35(2): 31-34. [4]刘会勇, 杨立苹, 刘瑞钦, 等. 缩短腐乳发酵周期的研究[J]. 中国调味品, 2003, 28(1): 13-14.
[5]刘超兰, 黄著, 彭熙敏, 等. 乳酸菌和酵母共培养技术缩短郫县豆瓣酱陈酿期的应用研究[J]. 中国酿造, 2009(3): 105-108.
[6]杨荣华, 林家莲, 周霄. 酱油豆酱中褐色色素的生理功能[J]. 中国调味品, 2000, 25(5): 21-22.
[7]阚建全, 陈宗道, 石轶松, 等. 豆豉非透析类黑精抗氧化和抑制亚硝胺合成的研究[J]. 营养学报, 1999, 21(3): 349-352.
[8]李江伟, 冉国侠, 陈新梅. 豆豉溶栓酶的分离纯化及其体外溶栓作用[J]. 中国生化药物杂志, 1999, 20(3): 148-150.
[9]向梅, 杨金树, 吴思方. 豆豉纤溶酶的研究进展[J]. 武汉工业学院学报, 2002(4): 23-26.
[10]PRIETO B, FRANCO I, FRESNO J M, et al. Effect of ripening time and type of rennet (farmhouse rennet from kid or commercial calf) on proteolysis during the ripening of León cow milk cheese[J]. Food Chemistry, 2004, 85(3): 389-398.
[11]SOUSA M J, ARDO Y, McSWEENEY P L H. Advances in the study of proteolysis during cheese ripening[J]. International Dairy Journal, 2001, 11(6): 327-345.
[12]YVON M, RIJNEN L. Cheese flavour formation by amino acid catabolism [J]. International Dairy Journal, 2001, 11(4/7): 185-201.
[13]王晶, 李江华, 房峻, 等. 转氨酶产生菌的筛选鉴定及其摇瓶发酵条件的优化[J]. 微生物学通报, 2008, 35(9): 1341-1347.
[14]楼良旺, 高年发. 紫外分光光度法测定丙酮酸[J]. 分析试验室, 2005 (4): 11-13.
[15]周德庆. 微生物学实验教程[M]. 2版. 北京: 高等教育出版社, 2006: 79-81.
[16]BUCHANAN R, GIBBONS N. 伯杰氏细菌鉴定手册[M]. 中国科学院微生物研究所翻译组. 8版. 北京: 科学出版社, 1984.
[17]黄永, 崔旭海, 褚福娟. 干酪成熟过程发酵剂的作用及快速成熟的研究进展[J]. 食品研究与开发, 2006, 25(5): 172-176.
Screening and Identification of Aminotransferase-producing Strain from Fermented Soybean Products and Preparation of Its Solid Starter Culture
WU Ling,QIN Li-kang*
(College of Life Sciences, Guizhou University, Guiyang 550025, China)
In order to shorten the fermentation period of fermented soybean products, a total of 150 strains were isolated from top-quality fermented foods in Guizhou. Among these strains, strain WDH-8 was found to have the highest branched-chain aminotransferase activity. The strain was identified as Bacillus licheniformis that was a safe prebiotic yeast strain with a branchedchain aminotransferase activity of 36.53 U/mL. In order to facilitate practical applications, the preparation of its solid starter culture was investigated, and the optimal culture medium for achieving the highest branched-chain aminotransferase activity, 37.965 U/mL, was determined to be composed of soybean power 25 g, material-to-water ratio 1:1, sodium chloride 5% and glucose 3%.
soybean fermenting;aminotransferase;starter cultures;Bacillus licheniformis
TS214.2
A
1002-6630(2012)03-0105-05
2011-09-21
贵州省科学技术基金项目(黔科合J字[2007]2033号);贵州省科技重大专项
伍玲(1986—),女,硕士研究生,研究方向为食品营养与安全。E-mail:yaling5050@126.com
*通信作者:秦礼康(1965—),男,教授,博士,研究方向为食品科学及营养与安全。E-mail:likangqin@126.com
