可溶型非融合血管生长抑制因子Kringle 5基因工程菌发酵培养和诱导表达条件的优化
2012-05-07马晓娟边六交
马晓娟,蔚 萍,妙 亮,边六交
(西北大学生命科学学院,陕西 西安 710069)
肿瘤的发生和发展依赖于新血管的不断形成,因此抑制新血管形成(Angiogenesis)进而抑制肿瘤的生成已成为治疗肿瘤的一个重要靶点[1]。1994年,O′Reilly等[2,3]发现内源性血管生成抑制剂Angiostatin是由纤溶酶原前4个饼环区组成;1997年,Cao等[4]发现纤溶酶原N端的第5个饼环区(Plasminogen kringle 5)同样具有抑制血管内皮细胞增殖和肿瘤生长的能力,而且抑制能力比Angiostatin更强。
血管生长抑制因子Kringle 5是目前发现的抑制血管内皮细胞增殖和肿瘤生长活性最强的纤溶酶原片段,在肿瘤治疗方面具有潜在的应用价值和广阔的市场前景。由于Kringle 5的来源有限,因此利用基因工程技术发酵生产重组Kringle 5具有重要的研究和应用价值。边六交等[5]对融合型血管生长抑制因子Kringle 5的发酵条件进行了优化;2011年,妙亮等[6]对可溶型非融合血管生长抑制因子Kringle 5进行了克隆表达、分离纯化和活性测定。
作者在上述研究的基础上,通过单因子实验对已经构建的表达可溶型非融合血管生长抑制因子Kringle 5的基因工程菌E.coliBL21(DE3) pET15b/K5分别进行发酵培养基和诱导表达条件的优化,拟为Kringle 5的进一步放大生产和临床应用奠定基础。
1 实验
1.1 菌种和质粒
宿主菌为大肠杆菌BL21(DE3);表达质粒为携带血管生长抑制因子Kringle 5基因的重组质粒pET15b/K5;表达可溶型非融合血管生长抑制因子Kringle 5的基因工程菌E.coliBL21(DE3) pET15b/K5(所表达Kringle 5的分子量约为28.0 kD,以三聚体形式存在)为自行构建,保存于-70 ℃ 的15%甘油中。
1.2 试剂
蛋白胨、酵母粉,英国OXOID 公司;异丙基硫代-2-β-D-半乳糖苷(IPTG)、氨苄青霉素(Amp),美国Amresco公司;丙烯酰胺、甲叉双丙烯酰胺、考马斯亮蓝R250,Fluka公司;葡萄糖、NaH2PO4、Na2HPO4、NH4Cl,分析纯,西安润德生物试剂有限公司。
1.3 LB培养基
胰蛋白胨10.0 g·L-1,酵母提取物5.0 g·L-1,NaCl 10.0 g·L-1,调pH值为7.0。
1.4 菌体干重的测定
取1.5 mL的离心管置于80 ℃恒温箱中烘干至恒重并称重(W1);取1 mL菌液加入已烘干至恒重的离心管中,10 000 r·min-1离心1 min,去上清;再加入1 mL蒸馏水,吹吸混匀洗涤菌体,于10 000 r·min-1离心1 min,去上清;置于恒温箱中烘干至恒重并称重(W2)。平行测定3次,取平均值。按下式计算菌体干重(DCW):
式中:V为菌液体积。
1.5 Kringle 5重组蛋白表达量和菌体总蛋白的测定
用常规SDS-PAGE凝胶电泳检测、考马斯亮蓝染色后由RS-232C型蛋白核酸分析仪测定Kringle 5表达水平(表达量占菌体总蛋白的百分比)。菌体总蛋白采用Bradford 法[7]测定。
2 结果与讨论
2.1 培养基组成的优化
以LB基础培养基中添加了葡萄糖、NH4Cl、NaH2PO4和Na2HPO4的半合成培养基作为发酵培养基,对半合成培养基中的葡萄糖、NH4Cl、NaH2PO4和Na2HPO4浓度进行优化。
2.1.1 葡萄糖浓度
取已灭菌的试管编号,分别加入10 mL LB基础培养基,再添加终浓度(g·L-1)分别为3.0、6.0、8.0、10.0、12.0、15.0的葡萄糖,按1%的接种量在37 ℃、220 r·min-1下摇瓶培养10 h,测定菌体干重,结果见图1。
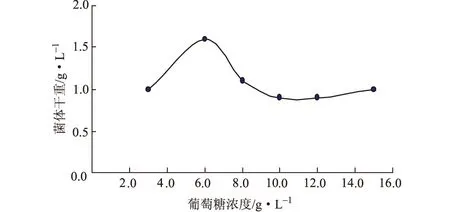
图1 葡萄糖浓度对菌体生长的影响
由图1可以看出,随着葡萄糖浓度的增大,菌体干重先上升后下降;葡萄糖浓度为6.0 g·L-1时,菌体干重达到最大。这可能是因为,一方面培养基中的碳源浓度较高时,细菌的生长速度可能会因细胞脱水而下降;另一方面葡萄糖的代谢会产生乙酸,影响菌体生长[8],同时,葡萄糖的分解代谢产物可能阻遏某些基因的转录,所以高浓度的葡萄糖会影响目的蛋白的表达[9]。因此,确定最佳的葡萄糖浓度为6.0 g·L-1。
2.1.2 NH4Cl浓度[10]
分别向10 mL LB基础培养基中加入终浓度(g·L-1)为1.0、1.4、2.0、2.6、3.0的NH4Cl,按1%的接种量在37 ℃、220 r·min-1下摇瓶培养10 h,测定菌体干重,结果见图2。
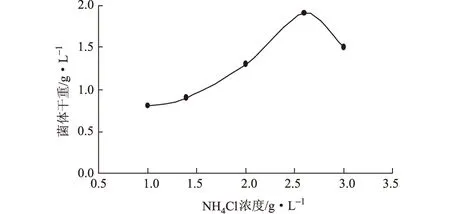
图2 NH4Cl浓度对菌体生长的影响
由图2可以看出,随着NH4Cl浓度的增大,菌体干重先上升后下降;NH4Cl浓度为2.6 g·L-1时,菌体干重最大。这是因为,过高的盐离子浓度可能会导致渗透压的变化,从而影响菌体细胞的生长。因此,确定最佳的NH4Cl浓度为2.6 g·L-1。
2.1.3 NaH2PO4浓度[11]
分别在上述优化的LB基础培养基中加入终浓度(g·L-1)为1.0、2.0、3.0、4.0、5.0、6.0的NaH2PO4,按1%的接种量在37 ℃、220 r·min-1下摇瓶培养10 h,测定菌体干重,结果见图3。
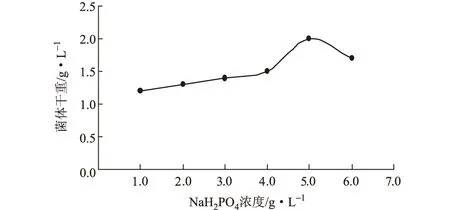
图3 NaH2PO4浓度对菌体生长的影响
由图3可以看出,NaH2PO4浓度为5.0 g·L-1时,菌体干重达到最大。因此,选择最佳的NaH2PO4浓度为5.0 g·L-1。
2.1.4 Na2HPO4浓度
分别在上述优化的LB基础培养基中加入终浓度(g·L-1)为2.0、3.0、4.0、5.0、6.0、7.0的Na2HPO4,按1%的接种量在37 ℃、220 r·min-1下摇瓶培养10 h,测定菌体干重,结果见图4。
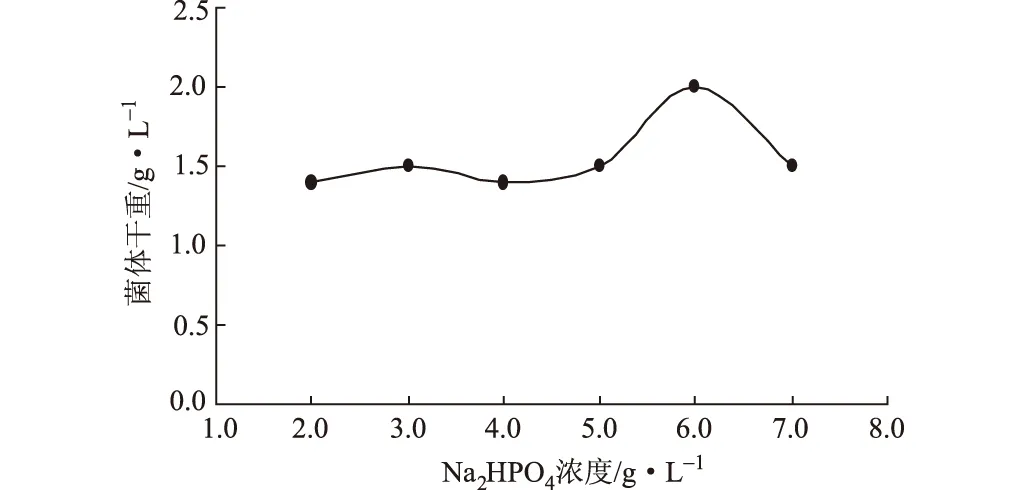
图4 Na2HPO4浓度对菌体生长的影响
由图4可以看出,Na2HPO4浓度为6.0 g·L-1时,菌体干重达到最大。因此,选择最佳的Na2HPO4浓度为6.0 g·L-1。
综合以上结果,确定优化培养基的成分为:胰蛋白胨10.0 g·L-1,酵母提取物5.0 g·L-1,NaCl 10.0 g·L-1,葡萄糖6.0 g·L-1,NH4Cl 2.6 g·L-1,NaH2PO45.0 g·L-1,Na2HPO46.0 g·L-1。
2.2 生长曲线的测定
采用优化后的培养基,将种子液接入装液量12 mL的试管中进行培养,每小时取样一次,以基础LB培养基为对照,测定菌体干重,确定基因工程菌的对数生长期,结果见图5。

图5 基因工程菌在优化培养基与LB基础培养基中的生长曲线对比
由图5可以看出,优化培养基中菌体的生长速率和生物量都有了很大的提高,明显比LB基础培养基更适合基因工程菌的生长;对数生长后期在4 h左右。因此,确定诱导剂添加时间为接种后4 h。
2.3 诱导表达条件的优化
在优化培养基中,按1%的接种量进行摇瓶发酵,在接种后4 h添加诱导剂,优化诱导表达条件。
2.3.1 诱导剂浓度
分别添加终浓度(mmol·L-1)为0.0001、0.001、0.01、0.1、0.5、1.0、2.0的IPTG,在37 ℃、220 r·min-1下诱导培养5 h后,各取1 mL菌体离心,去上清,用SDS-PAGE电泳测定Kringle 5表达水平;再各取1 mL菌体离心,去上清,测定菌体干重。结果见图6。

1.蛋白Marker 2.未诱导对照 3~9.IPTG浓度(mmol·L-1):0.0001,0.001,0.01,0.1,0.5,1.0,2.0

图6 诱导剂浓度对菌体生长和Kringle 5表达的影响
由图6可以看出,当IPTG浓度为0.01 mmol·L-1时,菌体生物量达到最大,目的蛋白表达水平也最高,为20%;之后再增大诱导剂浓度,目的蛋白的表达水平不再升高。因此,确定IPTG浓度为0.01 mmol·L-1。
2.3.2 诱导时间
加入0.01 mmol·L-1诱导剂后,分别在37 ℃、220 r·min-1下诱导1 h、2 h、4 h、6 h、8 h和10 h,取1 mL菌体离心,去上清,用SDS-PAGE电泳测定Kringle 5表达水平;再各取1 mL菌体离心,去上清,测定菌体干重。结果见图7。
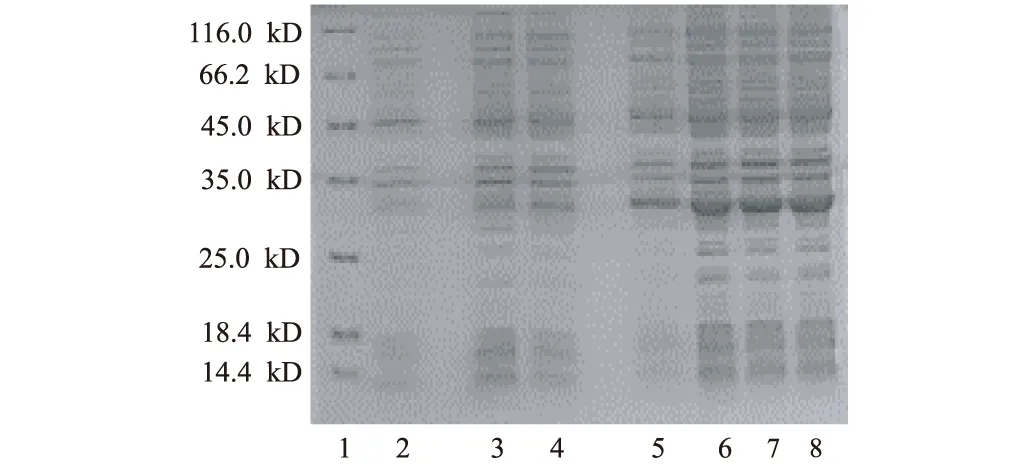
1.蛋白Marker 2.未诱导对照 3~8.诱导时间(h):1,2,4,6,8,10

图7 诱导时间对菌体生长和Kringle 5表达的影响
由图7可以看出,诱导4~6 h后,目的蛋白的表达水平已趋于稳定,约为20%;诱导6 h后,菌体干重也趋于稳定。因此,确定诱导时间为6 h。
2.3.3 诱导温度
加入0.01 mmol·L-1诱导剂,分别在15 ℃、25 ℃、30 ℃和37 ℃下于220 r·min-1诱导6 h,诱导结束后各取1 mL菌体离心,去上清,用SDS-PAGE电泳测定Kringle 5表达水平;再各取1 mL菌体离心,去上清,测定菌体干重。结果见图8。
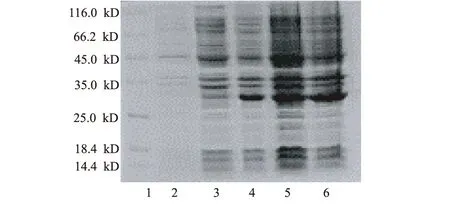
1.蛋白Marker 2.未诱导对照 3~6.诱导温度(℃):15,25,30,37
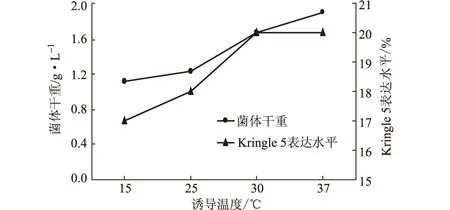
图8 诱导温度对菌体生长和Kringle 5表达的影响
由图8可以看出,在30 ℃和37 ℃下目的蛋白表达水平已趋于稳定,约为20%;而37 ℃时更有利于菌体生长。因此,确定诱导温度为37 ℃。
2.3.4 摇床转速
加入0.01 mmol·L-1诱导剂,分别在转速180 r·min-1、220 r·min-1、260 r·min-1下于37 ℃诱导培养6 h,诱导结束后各取1 mL菌体离心,去上清,用SDS-PAGE电泳测定Kringle 5表达水平;再各取1 mL菌体离心,去上清,测定菌体干重。结果见图9。

1.蛋白Marker 2.未诱导对照 3~5.摇床转速(r·min-1):180,220,260
由图9可以看出,目的蛋白Kringle 5的表达水平稳定在20%左右,摇床转速对其影响不大;摇床转速为180 r·min-1时,菌体生物量较低,单位体积培养液得到的目的蛋白表达总量会处于较低的水平;而当摇床转速为260 r·min-1时,菌体干重和表达水平的提高均不明显,同时,摇床运转的动力成本和此过程中的不利产热均使其不宜作为最优条件。因此,确定摇床转速为220 r·min-1。
2.4 优化培养基与LB基础培养中目的蛋白表达量的比较
将基因工程菌E.coliBL21(DE3)pET15b/K5分别置于优化培养基和LB基础培养基中于优化发酵条件下摇床培养,2种培养基中Kringle 5表达的SDS-PAGE分析和比较见图10、表1。
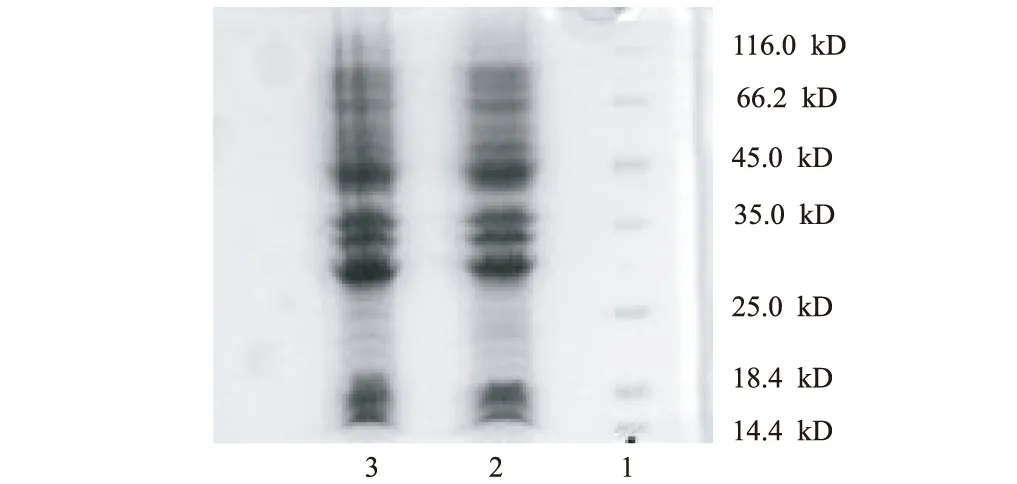
1.蛋白Marker 2.LB基础培养基 3.优化培养基

表1 优化培养基和LB基础培养基中Kringle 5表达的比较
由图10、表1可以看出,优化培养基与LB基础培养基相比,生物量和Kringle 5表达量都获得了很大提高,其中表达量提高了1.18倍。
3 结论
对基因工程菌E.coliBL21(DE3) pET15b/K5发酵产可溶型非融合血管生长抑制因子Kringle 5的培养基和诱导表达条件进行了优化,确定最佳培养基(g·L-1)为:胰蛋白胨10.0,酵母提取物5.0,NaCl 10.0,葡
萄糖6.0,NH4Cl 2.6,NaH2PO45.0,Na2HPO46.0;确定最佳诱导表达条件为:诱导剂浓度0.01 mmol·L-1,诱导时间6 h,诱导温度37 ℃,摇床转速220 r·min-1。在此条件下,菌体干重为1.8 g·L-1,Kringle 5表达量为360 mg·L-1,占菌体总蛋白的20%,与LB基础培养基相比,Kringle 5表达量提高了1.18倍。
参考文献:
[1] Folkman J.What is the evidence that tumors are angiogenesis dep-endent?[J].J Natl Cancer Inst,1989,82(1):4-6.
[2] O′Reilly M S,Boehm T,Shing Y,et al.Endostatin:An endogenous inhibitor of angiogenesis and tumor growth[J].Cell,1997,88(2):277-285.
[3] O′Reilly M S,Hohngren L,Shing Y,et al.Angiostatin:A novel angiogenesis inhibitor that mediates the suppression of metastases by a Lewis lung carcinoma[J].Cell,1994,79(2):315-328.
[4] Cao Y,Ji R W,Davidson D,et al.Kringle domains of human angiostatin:Characterization of the anti-proliferative activity on endothelial cells[J].J Biol Chem,1996,271(46):29461-29467.
[5] 边六交,党红艳,杨晓燕.原核表达融合型血管生成抑制剂Kringle 5发酵条件的优化和初步纯化[J].高校化学工程学报,2006,20(5):775-780.
[6] 妙亮,徐立华,冀胥,等.可溶型三聚体血管生长抑制因子 Kringle 5的克隆,表达,纯化及活性研究[J].中国生物工程杂志,2011,31(3):18-22.
[7] 黎燕,冯健男,张纪岩.分子免疫学实验指南[M].北京:化学工业出版社,2008:1-2.
[8] 元英进,赵广荣,孙铁民.制药工艺学[M].北京:化学工业出版社,2007:141-144.
[9] 屠发志,符策奕,张添元,等.以甘油为碳源发酵Pichiapastoris组成型表达人血管生成抑制素[J].生物工程学报,2007,23(5):902-906.
[10] 周涟,罗进贤,张添元.血管生成抑制素基因工程大肠杆菌的高密度发酵研究[J].微生物学报,2003,43(2):228-235.
[11] 陶兴无.发酵产品工艺学[M].北京:化学工业出版社,2008:104-106.
