水稻逆境响应基因OsMsr11的克隆与分析
2012-04-17胡叶平崔延春徐国云王曼玲李落叶夏新界
胡叶平,崔延春,徐国云,王曼玲,李落叶,夏新界
水稻是世界上最重要的粮食作物之一,世界上60%的人口以其为主食[1],在我国水稻也是第一大粮食作物,但是水稻在生产过程中常常遭遇季节性,区域性的干旱、高温、低温等逆境胁迫,严重影响我国水稻的产量和品质。由于全球气候变化和全球沙漠化进程的加速,非生物胁迫将会加剧,因此,研究水稻对逆境的适应机理,发掘新的水稻耐逆基因,应用现代生物技术培育出能适应暂时不利条件或者能生活在严酷条件下的水稻品种已成为当今水稻分子育种家聚焦的重点之一。
植物在遭受低温、高温、干旱等逆境胁迫时,会引起许多相关基因表达的变化,导致一系列形态学、生理代谢功能、生物化学以及分子上的改变,这些变化直接或间接影响植物自身的生长和产量。首先,植物为了适应环境,在长期演化过程中形成了一系列对环境胁迫的抵抗或忍耐能力,即植物的耐逆性;其次,植物在逆境胁迫时,会引起耐逆相关基因表达的变化,一类是直接参与代谢与生理变化的效应基因,它们通过控制代谢酶或蛋白的表达影响代谢与生理过程,这些酶或蛋白对维持细胞膜系统在逆境下的稳定性以及防止原生质过度脱水等有重要作用;另一类是调节基因[2],它们通过控制其下游许多逆境诱导基因的表达而间接影响代谢与生理过程。研究表明某些信号转导途径也参与逆境反应,但是目前有关非生物逆境信号转导中受体的信息是非常有限的[3]。例如,反向遗传学研究表明AHK1/ATHK1(拟南芥跨膜组氨酸激酶)在酵母细胞中是一个渗透反应受体[4,5],但是其下游信号传导机制大部分都未知,这还需要科学家的进一步研究。
由于分子生物学技术和方法在植物学中的应用,许多耐逆相关基因已经从各种植物中分离出来,功能也逐渐清楚。例如,Goel等[6]发现的细菌codA基因在转基因番茄中表达可以诱导甜菜碱的合成并能提高植株对盐胁迫和水分胁迫的抵抗力;Lee等[7]报道的胡椒CaAMP1基因在拟南芥中过量表达能够增加转基因植株的耐盐、耐旱性。基因OsMsr2[8]在苗期叶片和孕穗期穗在低温胁迫下,表达水平分别上调约52.3倍和68.2倍,研究表明该基因编码钙结合蛋白,在拟南芥中过量表达此基因增强了转基因拟南芥的耐盐性、耐旱性,还增加了对外源ABA的敏感性。所有这些耐逆基因的编码产物直接保护植物细胞免受逆境胁迫或者调控其他基因的表达而提高植物对逆境的忍受能力[9,10]。虽然许多耐逆基因已被分离,但鉴于众多基因参与逆境反应和众多耐逆基因的存在,克隆更多新的植物耐逆基因并了解它们的功能,无论是对研究植物耐逆性分子机理还是对作物的遗传改良都具有重要的理论和实际意义。本文是在分析水稻全基因组耐逆反应基因芯片数据的基础上,筛选出的其中一个耐逆相关基因,为研究其在耐逆反应中的作用,对该基因进行了序列分析和克隆、构建了过量表达载体、采用农杆菌侵染法进行了水稻的遗传转化,并对转基因水稻进行了初步的功能分析。
1 材料与方法
1.1 实验材料
材料为超级稻(Oryza sativa L.ssp.Indica)两优培九母本培矮64S(种子由湖南省农业科学院水稻研究所提供)和父本9311(种子由湖南师范大学生命科学学院徐孟亮研究员提供)。
1.2 试剂
DNA Polymerase(TaKaRa LA Taq)、克隆载体 pMD18-T连接试剂盒、限制性内切酶购于宝生物工程(大连)有限公司,dNTP、DNALadder Marker购于天根生化科技(北京)有限公司,PCR引物由Invitrogen公司合成,其他试剂均为分析纯。大肠杆菌感受态细胞DH10B为本实验室制备并于-80℃保存。
1.3 试验处理与取材
种子用0.1%HgCl2消毒10 min,自来水冲洗3遍,25℃浸种3 d,每天换水1次,37℃催芽2 d-3 d,分批播于中国科学院亚热带农业生态研究所网室盆中,当秧苗生长至5叶期时,一部分作为苗期实验材料;另一部分移栽至其他盆中,每盆栽5株,继续置网室自然条件下生长发育,常规水肥管理与病虫防治,作为孕穗期与抽穗开花期的实验材料。
干旱胁迫处理:倒去盆中水层,置旱棚逐干,当叶片开始卷曲16 h后取材,对照也置旱棚,但盆中保持水层。高温胁迫处理:将盆中泥水温调至45℃,置于美国Percival公司生产的PGC1515人工气候箱中用45℃处理2 h后取材;对照置于另一PGC1515人工气候箱中,温度为28℃。处理与对照均为黑暗条件。低温胁迫处理:将材料置于PGC1515人工气候箱中,苗期4℃处理12 h后取材,孕穗期与抽穗开花期12℃处理16 h后取材,对照置于另一PGC1515人工气候箱中,温度为28℃。处理与对照均为黑暗条件。
每个处理与对照材料取4-5片倒二叶、4-5个未抽出的幼穗或已抽出的开花穗中部,剪碎,用液氮磨成干粉状,立即分装入5-6个事先装有1.0 ml TRIzol提取液(Invitrogen)的1.5 ml离心管中,每管中约装100 mg粉状样品,编号,盖紧,摇动,使样品与TRIzol提取液充分混合,置-80℃保存备用。
1.4 总RNA提取
采用TRIzol试剂提取法。将-80℃保存备用的样品取出,解冻后,加200μL氯仿,振荡混匀,4℃,12,000 rpm离心15 min,小心吸出上层水相,转入另一离心管,加500μL异丙醇,沉淀、离心分离出RNA,再经75%酒精洗涤,室温微干后,加适当体积的RNase-free水,充分溶解,测量RNA浓度。
1.5 基因芯片分析
按Affymetrix基因芯片系统中国经销商上海晶泰生物技术有限公司(GeneTech Biotechnology Limited Company)提供的Affymetrix表达芯片实验操作手册操作(2005年版)。主要步骤包括:①总RNA的提取和纯化;②cDNA的合成和纯化;③体外转录合成cRNA和cRNA的纯化;④cRNA片段化、配制杂交液;⑤芯片杂交;⑥洗脱芯片;⑦扫描芯片;⑧数据分析。
1.6 过量表达载体的构建和水稻的遗传转化
从GenBank中搜索到OsMsr11的同源序列,应用Vector NTI 11软件分析设计该基因的PCR引物,上游引物5'端设有Sma I酶切位点,上游引物OsMsr11-F序列为:5'-CCCGGG GTGTGTTCTTCATCATCGCC-3',下游引物OsMsr11-R序列为5'-CCTATAAGTGGGTTCGGTTC-3',引物由Invitrogen合成,以培矮64SDNA为模板进行PCR扩增;扩增程序为:95℃预变性4 min,94℃变性30 s,50℃退火40 s,72℃延伸1 min,共35个循环,最后在72℃下延伸10 min。扩增、回收目的片段并连接到pMD18-T载体,筛选含有目的片段的阳性克隆,送Invitrogen公司测序。将测序正确的pMD18-T载体用SmaⅠ进行单酶切后连入pCOsAc(来自pCAMBIA1301含有水稻ACTINI基因的启动子和Nos终止子),同时用pmacⅠ酶切表达载体PCOsAc质粒并对切开的PCOsAc载体片段去磷酸化处理从而构建成pCOsAc-OsMSR11表达载体。将构建好的表达载体利用农杆菌介导法导入超级稻父本9311愈伤组织中,通过共培养、潮霉素筛选获得再生植株。
1.7 转基因株系阳性鉴定
从水稻新鲜叶片中提取基因组DNA,根据表达载体上跨终止子序列设计引物,Primer-F:5′-GGTGTGTTCTTCATCAT CGCC-3′,Primer-R:5′-ATTCCCGATCTAGTAACATAGATGA CA-3′,PCR反应参数为:94℃预变性5 min;94℃变性30 s,60℃退火45 s,72℃延伸90 s,循环35次;72℃后延伸10 min。PCR扩增产物经1.0%琼脂糖凝胶电泳分离。预期PCR产物片段长为662 bp。
1.8 转基因株系的逆境处理
转基因植株T1代种子耐盐性实验:将转基因种子与9311野生型种子分别播放在铺有2层滤纸的培养皿中,每皿10粒,重复3次。NaCl浓度分别0 mM,150 mM,每皿分别加10 ml,对照培养皿中加入10 ml水,培养在室温条件下,3d后统计萌发情况(胚芽露出),统计后让其继续在原来的条件下生长12d,观察生长情况并统计数据。
转基因植株T1代种子ABA敏感性实验:将转基因种子与野生型对照种子分别在加有0μM、2μM、4μM、6μMABA的1/2 MS培养基中萌发(转基因种子和野生型种子处于同一条件下,分别10粒),重复3次,培养在温室中,两周后观察生长情况。
2 结果分析
2.1 OsMsr11是一多逆境胁迫诱导表达的基因
为了发掘新的耐逆功能基因,采用Affymetrix基因芯片系统,分析了超级稻两优培九母本培矮64S(含51279个转录本)在苗期、孕穗期、抽穗开花期的叶片与穗在高温、干旱、低温逆境胁迫下的基因表达水平,筛选出一批显著上调或下调的基因,OsMsr11是一个在低温、干旱、高温条件下均诱导表达的基因(图1)。在低温处理的幼穗中,表达水平上调幅度达126.2倍,在干旱条件下最高上调幅度为2倍,在高温条件下最高上调幅度为11.27倍。相比之下此基因对低温最为敏感。

图1 水稻培矮64S不同生育时期不同组织器官中OsMsr11基因在不同逆境与正常条件下的表达水平
2.2 OsMsr11基因的克隆与序列分析
为了进一步研究OsMsr11在水稻耐逆过程中的作用,从GenBank中搜索到此基因在日本晴第8号染色体上的同源DNA序列(AP004460.2,19434-20130 bp之间),根据此同源序列设计基因特异性引物,因在日本晴第8号染色体上的同源基因没有内含子,本实验用培矮64S基因组DNA为模板进行PCR扩增,得到含完整开放阅读框架(open reading frame,ORF)的OsMsr11基因DNA片段(图2),然后连接到pMD18-T载体上,测序后对其序列进行分析发现,该DNA序列包含366个碱基(含有ORF),基因序列的ORF位于碱基48bp-282bp之间(图3),其序列与GenBank中公布的日本晴基因组序列AP004460.2和超级杂交稻亲本9311序列CM000133.1相对应的碱基相比,不存在碱基差异。该基因与日本晴基因NM_001188461.1(NP_001175390蛋白)103bp-346bp之间的碱基序列同源性为91%,与高粱基因XM_002443838.1(XP_002443883蛋白)112bp-260bp之间碱基同源性为88%,与高粱基因XM_002443840.1(XP_002443885蛋白)100bp-298bp之间的碱基同源性为78%,与大豆基因BT092720.1(ACU17030蛋白)同源性为41.5%,与北美云杉基因EF081477.1(ABK20880蛋白)168bp-255bp之间的碱基序列同源性为72%。
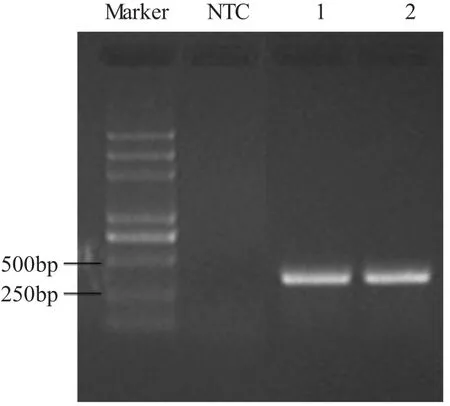
图2 OsMsr11 PCR扩增产物琼脂糖凝胶电泳

图3 OsMsr11基因序列、推测的编码蛋白序列及预测的启动子区域顺式作用元件
根据该基因所对应的日本晴相应基因组DNA序列(AP004460.2,Range:19539-19770)可能的启动子区域(AP004460.2,Range:19500-18001)进行在线PlantCARE软件分析(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/),在启动子TATA-box上游,发现了5类与逆境相关的顺式作用元件(图3),它们可能参与此基因对逆境胁迫的响应。
2.3 OsMsr11基因编码蛋白质序列及比对分析
采用Vector NTIAdvance 11.0软件对此序列进行分析,OsMsr11完整的ORF长度为234 bp,编码77个氨基酸残基的蛋白,预测分子量为8.38 KD,pI约为8.79。蛋白质相似性比对 (图4)分析显示,OsMsr11全长蛋白序列与籼稻9311第8号染色体上OsI_27861基因编码的蛋白序列(EAZ05643.1,hypothetical protein)、日本晴第8号染色体上OsJ_26087基因编码的蛋白序列(EAZ41563.1,hypothetical protein)完全一致。OsMsr11全长序列与Os08g0156033基因编码的蛋白序列(BAH94118.1,Conserved hypothetical protein)相似性为 87%,与高粱第7号染色体上SORBIDRAFT_07g003730基因编码的蛋白序列 (XP_002443883.1,hypothetical protein)相似性为69%。OsMsr11蛋白1-51间位氨基酸序列与高粱SORBIDRAFT_07g003745基因编码的蛋白序列(XP_002443885.1,hypothetical protein)的6-56位间的相似性为75%,OsMsr11蛋白4-55位氨基酸序列与大豆ACU17030.1蛋白序列的3-54位间相似性为52%,4-77位氨基酸序列与北美云杉ABK20880.1蛋白序列的3-64位间的相似性为41%,4-50位氨基酸序列与葡萄XP_002274232.1蛋白序列的3-49位间相似性为55%,9-50位间氨基酸序列与蓖麻XP_002528939蛋白序列的8-49位间相似性为57%,4-53位氨基酸序列与拟南芥EFH43878.1蛋白序列的3-52位间相似性为48%。以上与OsMsr11基因编码蛋白相似的预测蛋白全为功能未知蛋白。

图4 OsMsr11编码蛋白与其他类似蛋白的比对分析注:右侧数字代表每行最后1个氨基酸的序号,进行比对的植物蛋白质包括BAG88611.1(OsMsr11)、NP_001061023.1、NP_001175390.1、XP_002443883.1、XP_002443885.1、ACU17030.1、ABK20880.1、XP_002274232.1、XP_002528939.1、XP_00286761。“*”代表高度保守的氨基酸残基,“:”代表保守性极高的位点,“.”代表保守性稍低的残基位点,“-”代表序列间无一致性位点。
利用ProtParam工具(http://us.expasy.org/tools/protparam.html)分析OsMsr11蛋白的20种氨基酸中Ala所占比例最高,达到13%,而没有Trp,此蛋白的不稳定指数为36.05,脂肪指数为71.04,总平均亲水性为-0.481,消光系数在280 nm处为5960,根据此工具分析说明此蛋白稳定。使用ProtSca(http://www.expasy.org/cgi-bin/protscale.pl)对此蛋白序列进行疏水性分析显示:OsMsr11蛋白1-21位氨基酸之间为疏水区域,22-77位氨基酸之间为亲水区域(图5),这与ProtParam中总平均亲水性预测结果一致。利用SignalP3.0 server对OsMsr11 N端进行信号肽预测表明此蛋白有信号肽序列,最可能的剪切位点在21-22之间,其功能蛋白为一亲水性蛋白。基于HMM算法的预测结果可知,此蛋白存在信号肽的可能性为0.822,综合NN算法和HMM两种算法可知,OsMsr11基因编码蛋白含有信号肽序列,此蛋白可能为分泌性蛋白,可能在信号识别中起作用。使用TargetP1.1对OsMsr11的亚细胞定位进行预测,结果表明可能是分泌通路信号肽,分泌到细胞周质中,预测剪切位点的序列为21个氨基酸,与SignalP3.0 server预测结果一致。
2.4 转OsMsr11基因水稻的鉴定与耐逆性分析
对获得的再生植株用表达载体跨终止子特异性引物进行PCR检查,进一步筛选转基因植株,结果显示有9株植株扩增出662 bp的目的基因片段(图6),表明目的基因已成功整合到这些水稻的基因组中。

图5 OsMsr11蛋白疏水性预测分析
为了分析过量表达OsMsr11是否改变转基因水稻的耐盐性与对ABA的敏感性,从中筛选出3株进行盐胁迫处理与ABA敏感性实验,结果均表现出不同程度的耐盐性提高与对ABA敏感性的降低,其中H7株系最为明显(图7,8)。在正常条件下,转基因和野生型植株的萌发率、茎长和根长没有差异,在150 mMNaCl条件下,转基因植株的萌发率、茎长和根长明显高于野生型,且差异显著(表1、2)。在对ABA敏感性的分析中,发现在0μM和2μMABA的培养基中转基因植株和野生型植株的茎长差异不显著,在4μM和6μM ABA的培养条件下,转基因植株的茎长明显高于野生型且差异显著(图8,表3),上述获得的结果表明:OsMsr11的过量表达提高了水稻的耐盐能力,同时降低了对ABA的敏感性;OsMsr11基因的过量表达在水稻中可能是通过参与了不依赖ABA信号传导途径来调节对盐的耐受力,可能编码一个植物应答ABA的信号传导途径中的一个负调控因子参与调控水稻幼苗茎的生长发育,具体的作用机制还需进一步研究验证。

图6 PCR分析鉴定转基因水稻植株

图7 过量表达OsMsr11基因水稻和野生型水稻对盐胁迫的耐受力
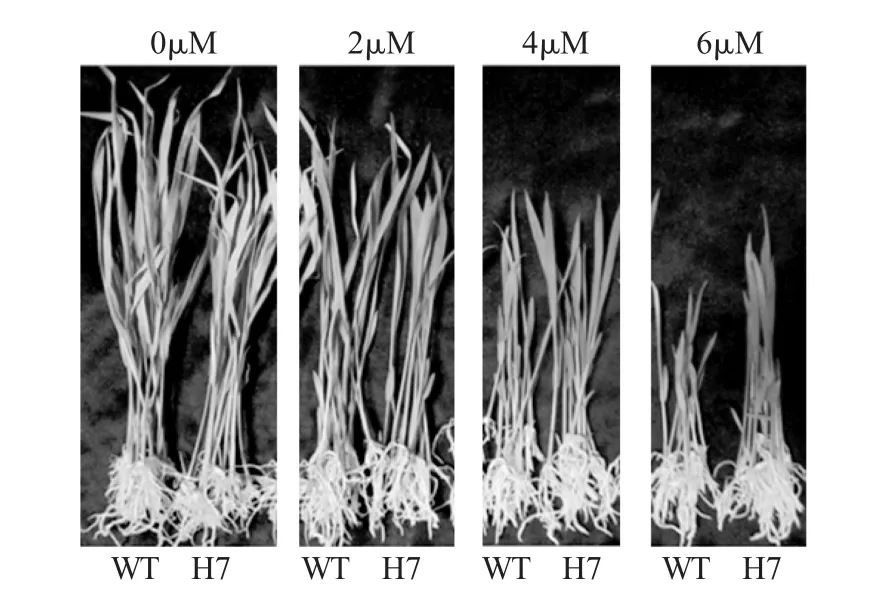
图8 转基因和野生型植株在不同ABA浓度下幼苗生长情况

表1 过量表达OsMsr11基因水稻在盐胁迫下的萌发率统计

表2 过量表达OsMsr11基因水稻在150 mM NaCl胁迫下的根长、茎长统计

表3 过量表达OsMsr11基因水稻在不同ABA浓度下的茎长
3 结论与讨论
3.1 结论
OsMsr11基因是通过基因芯片技术筛选到的一个逆境条件下表达水平上调的基因。通过对该基因的序列分析发现,该基因无内含子,启动子区域含有5个逆境相关的顺式作用元件;对蛋白序列分析发现其亲水性较强,无典型的保守结构域,含有信号肽序列,预测其为分泌性蛋白质。通过对转基因水稻的耐逆性分析得出如下结论:
(1)OsMsr11基因是一个受逆境诱导的基因。
(2)水稻中过量表达OsMsr11基因降低了转基因植株对外源ABA的敏感性。因此OsMsr11基因可能编码一个应答ABA信号传导途径中的负调控因子。
(3)水稻中过量表达OsMsr11基因提高了转基因植株的耐盐性。
3.2 讨论
OsMsr11基因是一个受高温、低温、干旱诱导表达水平上调的基因。在低温条件下,孕穗期穗和抽穗开花期的表达水平较高,特别是在低温条件下孕穗期穗中的表达水平上调最为显著,说明此基因对低温比较敏感。另有报道证实OsMsr11基因在受亚砷酸盐(AsIII)和砷酸盐(AsV)胁迫时其表达水平也上调[11],表明此基因有可能参与水稻对砷胁迫的响应。OsMsr11基因编码的蛋白质亲水性比较强,在逆境中可能具有一定的脱水保护剂的作用。Wise等[12]报道的LEA蛋白具有较高的亲水性,在逆境条件下能够保护细胞或膜结构,恢复变性蛋白的活性等从而增加植物的耐逆性。植物参与耐逆性的功能基因大致可分为两大类:一类是控制代谢酶或蛋白质活性的效应基因,它们直接参与代谢与生理变化过程,通过调节渗透势,维护膜稳定性以及蛋白质构象与稳定,调节和加强植物自身代谢生理保护机制;另一类是调控其下游特异靶基因表达的调节基因[2],它们间接影响代谢与生理过程,使植物获得抵御胁迫的能力。OsMsr11基因编码蛋白N端信号肽的预测表明此蛋白可能属于分泌性蛋白质,其可能是逆境相关基因的第一类即控制代谢酶或蛋白质活性的效应基因。这类基因调控合成渗透调节物质的酶类基因,调节某些渗透调节物质的合成,从而提高了植物的耐逆性,例如,P5CS1是控制脯氨酸合成的关键限速酶,在植物抗逆中发挥重要作用[13]。
真核生物基因转录水平调控,特别是转录因子直接与顺式作用元件结合来调控靶基因,这种调控方式在逆境胁迫下基因表达调控中较为普遍[14],植物基因启动子区域发现了多种与逆境相关的顺式作用元件,在转录水平上参与调控下游相应基因的表达,从而使植物应对不同的外界环境胁迫[15]。本研究在OsMsr11基因上游的可能启动子区域发现了ABRE/G-box、ARE、CGTCA-motif、GARE-motif这 5 类顺式作用元件,以往的研究证明这些顺式作用元件以及与其相互作用的转录因子在ABA响应及植物耐逆过程中发挥重要的作用[16]。在OsMsr11基因上游的顺式作用元件中,其中3类是激素相关顺式作用元件,表明它们可能与信号传导途径有关,而激素信号传导途径与植物的耐逆性相关[17],这些顺式作用元件的存在进一步说明其可能参与植物的耐逆响应过程。
本研究对OsMsr11转基因水稻进行了初步的功能分析,表明OsMsr11基因的过量表达降低了对外源ABA的敏感性,增强了转基因水稻的耐盐性,说明OsMsr11可能编码一个植物应答ABA的信号传导途径中的一个负调控因子。但是大多数研究结果表明,对ABA高敏感的植物是通过调节气孔关闭和ABA相关基因的表达从而提高植物对高盐、干旱的耐受力[18]。Jung等[19]报道AtMYB44基因的过量表达增加了拟南芥植株对ABA的敏感性,降低叶片失水率,明显增加了转基因拟南芥的耐旱性和耐盐性;Xu等[8]报道的OsMsr2基因在拟南芥中过量表达增强了转基因拟南芥的耐盐、耐旱性,同时也增加了对外源ABA的敏感性。而本文报道的OsMsr11基因的过量表达降低了对ABA的敏感性,却增加了对盐的耐受力,这与以往大多数研究结果不同,但是也有与本文实验结果类似的报道。Lee等[7]发现拟南芥中过量表达胡椒CaAMP1基因能够增加转基因植株的耐盐、耐旱性,但同时降低了对ABA的敏感性。转基因水稻中实验结果显示OsMsr11基因的过量表达提高耐逆性,这一过程有可能是通过一种未知的负调控机制来调控ABA抗逆信号途径实现的,从而使转基因水稻具有抗逆性。到目前为止有关此基因的功能研究在本文中为首次报道,更深入的耐逆性方面研究正在进行中。参考文献:
[1] Akhtar M R.Impact of conservation technologies for sustainability of agriculture[J].J.Agric.Res,2006,44(3):239-257.
[2] Chinnusamy V,Ohta M,Kanrar S,et al.ICE1:A regulator of cold-induced transcriptomeand freezingtolerancein Arabidopsis[J].Gene Dev,2003(17):1043-1054.
[3] Hirayama T,Shinozaki K.Research on plant abiotic stress responses in thepost-genomeera:past,presentand future[J].The Plant Journal,2010,61(6):1041-1052.
[4]Tran LSP,Urao T,Qin F,et al.Functional analysis of AHK1/ATHK1 and cytokinin receptor histidine kinases in response to abscisic acid,drought,and saltstressin Arabidopsis[J].Proc.Nati.Acad.Sci.USA,2007,104(51):20623-20628.
[5]Wohlbach D J,Quirino B F,Sussman M R.Analysis of the Arabidopsis histidine kinase ATHK1 reveals a connection between vegetativeosmotic stresssensingand seed maturation[J].Plant Cell,2008,20(4):1101-1117.
[6]Goel D,Singh A K,Yadav V,et al.Transformation of tomato with a bacterial codA gene enhances tolerance to salt and water stresses[J].Journal of Plant Physiology,2011,168(11):1286-1294.
[7] Lee SC,Hwang B K.Functional roles of the pepper antimicrobial protein gene,CaAMP1,in abscisic acid signaling,and salt and drought tolerancein Arabidopsis[J].Planta,2009,229(2):383-391.
[8] Xu G Y,Pedro R,Wang M L,et al.A novel rice calmodulin-like gene,OsMSR2,enhances drought and salt tolerance and increases ABA sensitivity in Arabidopsis[J].Planta,2011,234(1):47-59.
[9]Huang X B,Tang Y,Xiong L.Over-expression of a LEA gene in rice improvesdroughtresistanceunder thefield conditions[J].Theor.Appl.Genet.,2007,115(1):35-46.
[10] Martínez-Atienza J,Jiang X Y,Garciadeblas B,et al.Conservation ofthesaltoverlysensitivepathwayinrice[J].Plant Physiol,2007,143(2):1001-1012.
[11]Chakrabarty D,Trivedi PK,Misra P,et al.Comparativetranscriptome analysis of arsenate and arsenite stresses in rice seedlings[J].Chemosphere,2009,74(5):688-702.
[12]Wise M J,Tunnacliffe A.POPPthequestion:what do LEA proteins do?[J].Trendsin plantscience,2004,9(1):13-17.
[13]YoshibaY,NanjoT,MiuraS,etal.Stress-Responsiveand Developmental Regulation ofΔ1-Pyrroline-5-carboxylate Synthetase 1(P5CS1)Gene Expression in Arabidopsis thaliana[J].Biochem Biophys Res Commun,1999,261(3):766-772.
[14] Zhu J K.Salt and drought stress signal transduction in plants[J].Annu Rev Plant Biol,2002(53):247-273.
[15] 聂丽娜,夏兰琴,徐兆师,等.植物基因启动子的克隆及其功能研究进展[J].植物遗传资源学报,2008,9(3):385-391.
[16] Yamaguchi-Shinozaki K,Shinozaki K.Organization of cis-acting regulatory elements in osmotic and cold-stress-responsive promoters[J].Trends Plant Sci,2005,10(2):88-94.
[17] Ye H Y,Du H,Tang N,et al.Identification and expression profiling analysis of TIFY family genes involved in stress and phytohormone responsesin rice[J].Plant Mol Biol,2009,71(3):291-305.
[18] Chandler PM,Robertson M.Gene expression regulated by abscisic acidanditsrelationtostresstolerance[J].Annu Rev Plant Physiol Plant Mol Biol,1994(45):113-141.
[19]Jung C,Jun S S,Han S W,et al.Overexpression of AtMYB44 enhances stomatal clousure to confer abiotic stress tolerance in transgenic Arabidopsis[J].Plant Physiol,2008,146(2):623-635.
