不同质量浓度氟对大鼠切牙成釉细胞转化生长因子-β1表达的影响
2012-03-24张雪莉张颖席淑华程广岩郭晓英
张雪莉 张颖 席淑华 程广岩 郭晓英
(1.中国医科大学口腔医学院 口腔预防教研室,沈阳110002;2.中国医科大学公共卫生学院 地球化学性疾病研究室,沈阳110001)
牙胚发育是由牙源性上皮与颅神经嵴来源的外胚间充质之间相互诱导、相互作用的复杂过程。研究[1-2]表明:转化生长因子-β1(transforming growth factor-β1,TGF-β1)在这一过程中起着重要作用。氟斑牙是牙齿在发育过程中,机体摄入过量的氟而造成的釉质发育和矿化异常,其病因虽已明确,也有一些治疗措施[3],但发病机制尚不清楚。本实验通过建立大鼠氟斑牙模型,观察不同质量浓度的氟对大鼠切牙成釉细胞中TGF-β1表达的影响,为进一步探讨氟斑牙形成的机制提供依据。
1 材料和方法
1.1 材料
1.1.1 实验动物 4周龄Wistar大鼠40只(中国医科大学实验动物中心提供),体重60~70 g,雌雄各半。
1.1.2 主要试剂及设备 TGF-β1多克隆抗体、SABC免疫组织化学试剂盒及DAB显色剂(武汉博士德生物工程有限公司);YG-180B1型冷冻包埋机、YG-280KX型摊片烤片机(南昌阳光神奇医疗器械有限公司),Leitz 1512型切片机(Leitz公司,德国)。
1.2 方法
1.2.1 大鼠氟斑牙动物模型的建立 将40只Wistar大鼠应用随机数字表法随机分为3组:对照组(14只)、低剂量氟组(13只)和高剂量氟组(13只)。对照组大鼠自由饮用蒸馏水,低剂量氟组自由饮用由蒸馏水配制的氟化钠溶液(F-质量浓度60 mg·L-1),高剂量氟组自由饮用由蒸馏水配制的氟化钠溶液(F-质量浓度120 mg·L-1)。饲养室温度保持在22~25 ℃,各组均给予常规饲料饲养,自由饮食,喂养10周。
1.2.2 标本处理 喂养10周后,乙醚麻醉处死动物,完整剥离双侧下颌骨,修整组织,余留部分为下颌切牙及包绕在切牙周围的部分颌骨。标本用0.01%的PBS溶液冲洗后,置入4%的多聚甲醛溶液中,4 ℃固定30 h;然后置于10%的乙二胺四乙酸二钠溶液中脱钙,4 ℃保存,每3 d更换1次脱钙液。6周后,制作切片。梯度乙醇脱水,二甲苯透明,石蜡定向包埋,沿牙体纵向长轴做近远中向连续切片,片厚6 μm,以多聚赖氨酸处理的载玻片捞片,65 ℃烤片3 h,标记备用。
1.2.3 苏木精-伊红(hematoxylin-eosin,HE)染色 常规HE染色,光镜下观察大鼠切牙发育中成釉细胞的形态。
1.2.4 免疫组织化学染色 采用常规免疫组织化学染色。室温下石蜡切片脱蜡和水化后,蒸馏水洗3次,每次2 min。3%过氧化氢室温孵育10 min,以消除内源性过氧化物酶的活性,蒸馏水冲洗3次,每次2 min。采用枸橼酸缓冲液微波修复抗原,冷却至室温,PBS冲洗2次,每次3 min。滴加正常小牛血清封闭液,室温孵育20 min,甩去多余液体。滴加一抗,4 ℃过夜。PBS冲洗3次,每次2 min,滴加生物素化二抗,37 ℃温箱孵育25 min,PBS冲洗3次,每次2 min。滴加SABC试剂,37 ℃温箱孵育25 min,PBS冲洗4次,每次5 min。DAB镜下控制显色,蒸馏水冲洗,苏木精复染2 min,1%盐酸乙醇分化,返蓝,脱水、透明、中性树胶封片。以PBS代替一抗工作液作为空白对照,阳性反应呈棕黄色颗粒。
1.3 统计学分析
采用MetaMorph显微图像分析系统对免疫组织化学染色结果进行图像采集,将阳性表达的强度转化为数字信号,对阳性区域的染色强度进行半定量分析。每张切片随机选择同一层细胞不重叠的5个视野进行TGF-β1阳性表达分析,通过染色强弱对比进行相对评价。检测染色阳性细胞的平均光密度(optical density,OD)值。OD值越小,组织中TGF-β1含量越少;OD值越大,组织中含量越多。采用SPSS 12.0统计软件进行统计分析,统计方法采用方差分析,检验水准为双侧α=0.05。
2 结果
2.1 一般状态观察
3组动物的一般状态见图1。

图1 对照组与实验组大鼠切牙的肉眼观察Fig 1 Overview of control and experimental groups
由图1可见:对照组大鼠切牙发育良好,牙面为棕黄色,表面光滑,半透明;低剂量氟组切牙的牙面有部分不透光区,牙面略显粗糙,釉质表面有规则、细小的棕白色相间横纹;高剂量氟组的牙面粗糙明显,有白垩色改变,棕白相间条纹更加明显。后两组均呈现典型氟斑牙症状,未见明显的实质性缺损。
2.2 HE染色结果
HE染色结果见图2。对照组:成釉细胞排列均匀,形态正常,细胞核远离基底膜,釉基质釉柱结构清晰可见。低剂量氟组:成釉细胞呈不规则排列,原有高柱状结构变矮,少量细胞发生扭曲,成釉细胞之间可见有空泡性变。高剂量氟组:成釉细胞排列紊乱,呈灶性堆积,细胞排列成多层。

图2 对照组和实验组的组织学观察 HE×400Fig 2 Histological observation of control and experimental groups HE×400
2.3 免疫组织化学染色结果
免疫组织化学染色结果见图3:TGF-β1在星网状层、中间层均为阳性表达,在分泌期和成熟期成釉细胞均为强阳性表达,在新形成的釉基质中呈阳性表达。TGF-β1在3组的表达强度见表1:TGF-β1在低剂量氟组和高剂量氟组成釉细胞中的表达强度均明显低于对照组(P<0.01),但低剂量氟组和高剂量氟组之间的差异无统计学意义(P>0.05)。
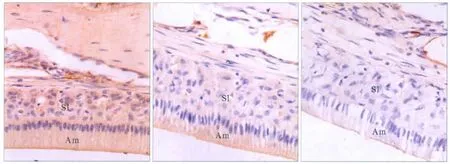
图3 TGF-β1在大鼠切牙成釉细胞的表达 SABC×400Fig 3 The expression of TGF-β1 in incisor ameloblasts of rats SABC×400

表1 TGF-β1在大鼠切牙成釉细胞的表达强度Tab 1 The expression intensity of TGF-β1 in incisor ameloblasts of rats
3 讨论
大鼠切牙为无根牙,可终身不断地产生釉质,故可以在同一时间观察到不同发育阶段成釉细胞的形态,因此大鼠是研究牙齿发育的理想的动物模型。鼠类能耐受的氟的质量浓度约为人类的20倍以上。对大鼠来说,25~30 mg·L-1氟相当于人类适宜的饮水氟的质量浓度(1 mg·L-1),在此范围内不出现氟斑牙;给予50~60 mg·L-1氟的大鼠饲养30 d多数会出现氟斑牙[4]。本文选用F-质量浓度60、120 mg·L-1的氟化钠水溶液研究不同质量浓度氟对大鼠切牙成釉细胞的影响。
转化生长因子-β(transforming growth factor-β,TGF-β)家族是一族具有多种生物学功能的细胞因子,在细胞的形态发生、增殖和分化,细胞外基质的形成,胚胎发育,骨的形成和重建等方面起着重要作用[5],同时也参与了牙胚的发生、发展和成熟的过程[6]。TGF-β家族成员通过与Ⅰ型和Ⅱ型丝氨酸/苏氨酸激酶型受体结合而发挥作用。TGF-β与细胞膜表面的Ⅱ型丝氨酸/苏氨酸激酶型受体结合,磷酸化并激活Ⅰ型受体,活化后的Ⅰ型受体作用于下游信号分子smad2、smad3使其活化,随后smad2、smad3与smad4结合形成异源寡聚物由细胞质转导进入细胞核内,与其他转录因子共同调节相关基因的表达[7]。
牙胚发育中,成釉细胞和成牙本质细胞的分化以及牙齿硬组织的形成是一个典型的由上皮—外胚间充质相互诱导、相互作用的过程。TGF-β家族成员作为信号分子,在这一过程中起重要作用。Bègue-Kirn等[8]研究发现:TGF-β1能促进牙胚成釉细胞合成细胞外基质,并诱导细胞分化。Coin等[9]将分离的成釉器在体外进行单独培养,未观察到前成釉细胞的极化和功能性成釉细胞的特性,加入TGF-β1后成釉细胞才发生了功能性分化。有研究[10]证实:在大鼠牙齿发育的钟状期,TGF-β与碱性磷酸酶、纤维结合素、Ⅰ型及Ⅱ型胶原等与基质形成有关的蛋白质的表达位置一致,提示TGF-β与基质合成有关。Zhu等[11]用原位杂交法分析TGF-β1 mRNA在鼠牙齿发育过程中的时空表达及定位,发现其表达呈时空依赖性,在蕾状期、帽状期牙齿上皮中局部有表达,在钟状期成釉细胞层和牙乳头细胞中大量表达,随着成牙本质细胞层和成釉细胞层细胞的分化,TGFβ1的表达增加;因此认为TGF-β1在牙生成过程中可能起重要作用,并且是通过旁分泌和自分泌方式起作用的。Fan等[12]也发现中间层细胞可以合成TGFβ1,可能是以旁分泌方式调控成釉细胞分化的开始。王大勇等[13]通过研究鼠氟斑牙动物模型发现:在钟状期,TGF-β1主要分布在中间层细胞、星网状层细胞及成釉细胞层,牙乳头及成牙本质细胞也有表达。由此推测,TGF-β1通过旁分泌和自分泌方式参与了成釉细胞的终末分化。张莹等[14]从受体水平上亦证明了TGF-β参与了牙胚发育的过程。
本实验观察到:TGF-β1在大鼠切牙星网状层细胞、中间层细胞均为阳性表达,表明TGF-β1在牙胚发育早期参与了牙齿早期形态的形成与细胞分化;在分泌期及成熟期成釉细胞均为强阳性表达,在新形成的釉基质中呈阳性表达,说明TGF-β1可能与成釉细胞及成牙本质细胞的分化及基质的形成有密切关系。这与苏凌云等[15]观察到的结果相一致。程敏等[16]研究显示:TGF-β1在钟状早期,内釉细胞、釉结、中间层及牙板中呈强阳性表达,在外釉细胞呈阳性表达;在钟状期,前成釉细胞、成釉细胞、前牙本质细胞、成牙本质细胞中呈强阳性表达。Tsuchiya等[17]研究发现:在成熟期成釉器中,TGF-β1的表达明显高于早期成釉器,TGF-β1表达增高使早期成釉器中相应的应激反应因子表达也增加,抑制凋亡的细胞因子表达减少,从而认为TGF-β1可能在釉质发育成熟期的成釉细胞凋亡过程中起着重要作用。
氟能抑制成釉细胞的分化、基质合成及分泌,但对其作用机制尚缺乏进一步研究。TGF-β1在诱导成釉细胞、成牙本质细胞的分化,以及细胞外基质合成等方面具有重要作用。那么,在氟斑牙的形成过程中,过量氟是否通过影响TGF-β1进而导致其形成呢? 王颖等[18]通过研究发现:低质量浓度(F-质量浓度20 mg·L-1)和中质量浓度(F-质量浓度50 mg·L-1)的氟显著抑制TGF-β1的表达。王大勇等[13]发现:慢性氟中毒条件下,小鼠切牙成釉器中TGF-β1的表达受到抑制。本实验通过免疫组织化学方法研究氟对大鼠切牙成釉细胞TGF-β1表达的影响,来探讨氟斑牙的发生机制,结果发现:实验组TGF-β1的表达明显低于对照组。TGF-β1的表达减弱,说明给氟后TGFβ1的表达受抑制,提示氟可能通过抑制TGF-β1的表达而干扰了成釉细胞的分化和基质分泌,造成釉质发育障碍。
[1]Ruch JV,Lesot H,Bègue-Kirn C.Odontoblast differentiation[J].Int J Dev Biol,1995,39(1):51-68.
[2]Thesleff I,Vaahtokari A,Kettunen P,et al.Epithelial-mesenchymal signaling during tooth development[J].Connect Tissue Res,1995,32(1/2/3/4):9-15.
[3]陈晖,康媛媛,张英.Beyond冷光美白结合祛氟剂治疗氟斑牙临床疗效观察[J].中国实用口腔科杂志,2009,2(1):39-41.
Chen Hui,Kang Yuanyuan,Zhang Ying.The effect of Beyond cold light whitening combined with fluoride-removing material on bleaching dental fluorosis[J].Chin J Pract Stomatol,2009,2(1):39-41.
[4]邓转云,黄瑞哲,郭永利.诱导大鼠下切牙氟斑牙模型所需饮水氟浓度及时间的筛选[J].实验动物科学,2008,25(4):12-15.
Deng Zhuanyun,Huang Ruizhe,Guo Yongli.Different doses of sodium fluoride in drinking water induced dental fluorosis oflower incisors in SD rats[J].Laboratory Animal Science,2008,25(4):12-15.
[5]孙玉鹏,胡蕴玉.β转化生长因子研究进展[J].中华骨科杂志,1994,14(8):505-507.
Su Yupeng,Hu Yunyu.Progress of transforming growth factor β[J].Chin J Orthopaedics,1994,14(8):505-507.
[6]Martín A,Unda FJ,Bègue-Kirn C,et al.Effects of aFGF,bFGF,TGFbeta1 and IGF-Ⅰon odontoblast differentiation in vitro[J].Eur J Oral Sci,1998,106(Suppl 1):117-121.
[7]Shi Y,Massagué J.Mechanisms of TGF-beta signaling from cell membrane to the nucleus[J].Cell,2003,113(6):685-700.
[8]Bègue-Kirn C,Smith AJ,Ruch JV,et al.Effects of dentin proteins,transforming growth factor beta 1(TGF beta 1)and bone morphogenetic protein 2(BMP2)on the differentiation of odontoblast in vitro[J].Int J Dev Biol,1992,36(4):491-503.
[9]Coin R,Haïkel Y,Ruch JV.Effects of apatite,transforming growth factor beta-1,bone morphogenetic protein-2 and interleukin-7 on ameloblast differentiation in vitro[J].Eur J Oral Sci,1999,107(6):487-495.
[10]Smith AJ,Matthews JB,Hall RC.Transforming growth factor-beta1(TGF-beta1)in dentine matrix.Ligand activation and receptor expression[J].Eur J Oral Sci,1998,106(Suppl 1):179-184.
[11]Zhu Q,Fan M,Bian Z,et al.In situ hybridization analysis of transforming growth factor-beta 1 RNA expression during mouse tooth development[J].Chin J Dent Res,2000,3(2):21-25.
[12]Fan MW,Bian Z,Gao YG.Immunohistochemistry and in situ hybridization investigation of transforming growth factor-beta:During odontoblast and ameloblast differentiation[J].Chin J Dent Res,1998,1(2):17-21.
[13]王大勇,侯铁舟,王强,等.慢性氟中毒对小鼠切牙胚内釉上皮TGF-beta1表达的影响[J].陕西医学杂志,2004,33(11):963-964,979.
Wang Dayong,Hou Tiezhou,Wang Qiang,et al.Influence of chronic fluorine poisoning on the expression of TGF-beta1 in inner enamel epithelium of mouse incisor[J].Shanxi Medical J,2004,33(11):963-964,979.
[14]张莹,张郁,金岩.转化生长因子β受体在牙胚发育过程中的表达和意义[J].牙体牙髓牙周病学杂志,1999,9(1):11-13.
Zhang Ying,Zhang Yu,Jin Yan.The expression and effect of TGF-β receptors in tooth development[J].Chin J Conserv Dent,1999,9(1):11-13.
[15]苏凌云,吴补领,史俊南.TGF-β1、TGF-β2、TGF-β3蛋白在人牙胚表达的免疫组化研究[J].牙体牙髓牙周病学杂志,2000,10(6):307-309.
Su Lingyun,Wu Buling,Shi Junnan.Immunohistochemical study of TGF-β1,TGF-β2and TGF-β3protein expressions in human tooth germs[J].Chin J Conserv Dent,2000,10(6):307-309.
[16]程敏,苗雷英,刘玉艳,等.转化生长因子β1和E-钙黏附分子在人牙胚发育过程中的表达及意义[J].吉林大学学报:医学版,2007,33(6):1054-1057.
Cheng Min,Miao Leiying,Liu Yuyan,et al.Expressions of TGFβ1 and E-cadherin in human tooth germ development and their significances[J].J Jilin University:Medicine Edition,2007,33(6):1054-1057.
[17]Tsuchiya M,Sharma R,Tye CE,et al.Transforming growth factorbeta1 expression is up-regulated in maturation-stage enamel organ and may induce ameloblast apoptosis[J].Eur J Oral Sci,2009,117(2):105-112.
[18]王颖,张安波,陈晖.氟对体外培养人牙胚TGF-β1表达影响的实验研究[J].口腔医学,2009,29(11):572-575.
Wang Ying,Zhang Anbo,Chen Hui.Experimental study of effects of fluoride on expression of TGF-β1 of human tooth germ cultured in vitro[J].Stomatology,2009,29(11):572-575.
