盐生植物小花碱茅外整流K┼通道SKOR基因片段的克隆及序列分析
2012-03-12王锁民
王 茜,王 沛,王锁民
(兰州大学草地农业科技学院 草地农业系统国家重点实验室,甘肃 兰州 730020)
Na+是广泛存在于土壤以及土壤溶液中的元素。但是,不论甜土植物还是盐生植物,其细胞质酶都对Na+有高度的敏感性[1-3]。过量的Na+会对植物生长产生各种不利影响,甚至导致植物死亡[4]。盐生植物在进化过程中,形成了特殊的耐盐机制,对其耐盐机理研究以及耐盐相关功能基因的挖掘在农作物和优良牧草耐盐性的遗传改良方面有十分重要的应用价值。
小花碱茅(Puccinelliatenuiflora)为禾本科碱茅属多年生牧草,耐盐碱,能够在高浓度的Na+环境下维持体内很低的Na+水平[5-8]。Wang等[9]的研究发现,小花碱茅具有极强的K+/Na+选择性运输能力,从而能够在盐胁迫下维持地上部稳定的高K+含量,可见,限制Na+内流,同时提高地上部K+的积累,进而维持植株体内高的K+/Na+是增强植物耐盐性的关键[10]。研究表明,K+在植物地上部的积累主要是通过将根部吸收的K+经木质部装载,在蒸腾拉力作用下,随木质部流进入地上部完成的,外整流K+通道在此运输过程中发挥重要作用[11]。
外整流K+通道属于Shaker通道家族,目前针对它的研究涉及甚少。Wegner和Raschke[12]通过膜片钳技术在大麦(Hordeumvulgare)根离体的木质部薄壁细胞的原生质体中首次发现了外整流K+通道的活性,将其称为KORC(K+-selective Outwardly Rectifying Conductance)。随后,在玉米(Zeamays)根皮层及中柱细胞中也检测到了外整流K+通道,并确定其介导K+从中柱细胞外排到木质部汁液中[13-14],这一功能在大麦中也得到了验证[13]。Gaymard等[11]从拟南芥(Arabidopsisthaliana)中首次克隆到编码外整流K+通道的基因,并发现其在根中柱组织特异表达,且能被ABA抑制,将其命名为SKOR(Stelar K+Outward Rectifier),在突变体中的研究也证实了SKOR的上述功能。由此猜测,在小花碱茅体内,外整流K+通道SKOR可能在维持其体内高的K+/Na+,进而在提高植株耐盐性中发挥重要作用。本研究采用RT-PCR方法克隆拒盐型盐生植物小花碱茅SKOR基因片段并分析其序列特征,以期为小花碱茅SKOR基因全长的克隆、表达调控、RNAi等研究奠定基础。
1 材料与方法
1.1试验材料 植物材料为4周龄小花碱茅幼苗,种子采自甘肃省张掖市临泽县。大肠杆菌DH5α菌株为草地农业系统国家重点实验室保存。
1.2研究方法
1.2.1材料培养 参照王生银等[15]的方法。挑选籽粒饱满的小花碱茅种子播种在铺有吸水纸的筛网架上,然后置于白瓷盘中暗培养,25 ℃,浇蒸馏水发芽,约7 d后浇灌Hoagland营养液(5 mmol·L-1KNO3,0.5 mmol·L-1NH4H2PO4,0.25 mmol·L-1MgSO4·7H2O,1.5 mmol·L-1Ca(NO3)2·4H2O,0.5 mmol·L-1Fe-citrate,92 μmol·L-1H3BO3,18 μmol·L-1MnCl2·4H2O,1.6 μmol·L-1ZnSO4·7H2O,0.6 μmol·L-1CuSO4·5H2O,0.7 μmol·L-1(NH4)6Mo7O24·4H2O )。营养液约5 d更换一次。培养室昼/夜温度为(28±2) ℃/(23±2) ℃,光照16 h·d-1,光强约为600 μmol·m-2·s-1,空气相对湿度为60%~80%。
1.2.2总RNA的提取 参照王生银等[15]的方法。将4周龄小花碱茅幼苗经25 mmol·L-1NaCl与10 mmol·L-1KCl处理48 h,取其根系,加入液氮研磨至粉末状,按照UNIQ-10柱式Trizol总RNA抽提试剂盒的操作说明书提取根系总RNA。用1.0%甲醛变性凝胶电泳鉴定其完整性和质量。
1.2.3引物的设计与合成 参照王生银等[15]的方法。通过对其他植物SKOR核苷酸序列进行同源性比较,找出高度保守的区段,根据同源性高和简并性低的原则,利用DNAMAN和Primer 5.0软件设计一对简并性引物P1和P2,用于扩增小花碱茅SKOR基因片段,推测目的片段的长度为566 bp,引物由上海生工生物工程技术服务有限公司合成。
P1:5′-TACCTG(A/G)TCGG(C/G)AACATGACGGCG-3′;
P2:5′-GATGCT(A/G)GTCA(A/G)GGA(C/T/U)TGCTTGTC-3′。
1.2.4RT-PCR扩增 参照王生银等[15]的方法。PCR扩增反应体系:在200 μL PCR管中依次加入10×PCR Buffer 5 μL、25 mmol·L-1MgCl23 μL、2 mmol·L-1dNTP 5 μL、10 μmol·L-1P11 μL、10 μmol·L-1P21 μL、5 U·μL-1Taq DNA polymerase 0.5 μL、cDNA 4 μL,加纯水至50 μL。反应条件:94 ℃预变性2 min;94 ℃变性30 s、56 ℃退火50 s、72 ℃延伸60 s,30个循环;最后72 ℃延伸10 min。PCR扩增产物用1.2%琼脂糖凝胶检测,目的片段的回收和纯化按照UNIQ-10柱式DNA胶回收试剂盒操作说明进行。
1.2.5阳性克隆的筛选与鉴定 参照王生银等[15]的方法。将回收的PCR产物连接到pUCm-T载体,转化感受态大肠杆菌DH5α,用含有50 μg·mL-1氨苄青霉素的LB固体培养基进行蓝白斑筛选,转化白斑菌株经质粒PCR鉴定确认阳性克隆后,送至北京华大基因科技股份有限公司测序。
1.2.6序列分析 参照王生银等[15]的方法。序列的比较、翻译等在DNAMAN生物软件上进行,Blast搜索在NCBI(www.ncbi.nlm.nih.gov/BLAST)网站上进行。
2 结果
2.1RT-PCR扩增 以总RNA反转录所得到的第一链cDNA为模板,用SKOR基因的简并性引物P1和P2进行PCR扩增(图1)。扩增产物经凝胶电泳检测发现约在560 bp处有一条亮带,且上下无杂带,与目的片段的大小一致,推测可能是小花碱茅SKOR基因片段。

图1 RT-PCR产物凝胶电泳图Fig.1 Agarose gel electrophoresis of RT-PCR products

图2 阳性克隆的PCR鉴定Fig.2 PCR identification of positive clones
2.2阳性克隆的鉴定 将回收纯化的目的片段连接到pUCm-T克隆载体上,转化大肠杆菌DH5α。从转化的平板上随机挑取4个白色菌斑并提取质粒,进行PCR扩增,得到的扩增片段大小约为560 bp(图2),与RT-PCR结果一致,表明这些克隆为阳性克隆。
2.3SKOR基因片段序列分析 测序结果显示,该阳性克隆序列长度为555 bp,推测其编码185个氨基酸(图3)。Blast 比较结果表明,该片段与玉米(AY899 922.1)、拟南芥(NM_111 153.3)、葡萄(Vitisvinifera)(AJ490 336)、蓖麻(Ricinuscommunis)(XM_002 533 405)和胡杨(Populuseuph-ratica)(EU382 997.1)等植物外整流K+通道基因的核苷酸序列的同源性均在66%以上,与禾本科模式植物水稻(Oryzasativa)推测的外整流K+通道基因的(GQ355 585.1)核苷酸序列的同源性最高,达到82%。表明本研究克隆到的片段为外整流K+通道基因片段,将其命名为PtSKOR。

图3 小花碱茅PtSKOR核苷酸序列及推测的氨基酸序列Fig.3 Nucleotide and deduced amino acid sequence of PtSKOR fragment from Puccinellia tenuiflora
多重比较及系统进化分析表明,小花碱茅PtSKOR片段与禾本科植物水稻推测的外整流K+通道OsSKOR(ADF28 806.1)的进化关系非常近,氨基酸同源性高达83%;与其他单子叶植物如玉米ZKOR(AM746 987.1)的进化关系相对较远,同源性为61%;与双子叶植物如拟南芥AtSKOR(NP_186 934.1)、葡萄VvSOR(CAD35 400.1)、胡杨PeORK(ABY86 890.1)、蓖麻RcSKOR(XP_002 533 451.1)等同源性分别为61%、60%、55%和55%(图4、图5)。序列比对及疏水性分析表明,本研究得到的小花碱茅PtSKOR片段的氨基酸序列起始于最后一个跨膜区(S6)中段,与非跨膜区相比,该跨膜区在结构上高度保守(图3、图4)。

图4 PtSKOR氨基酸序列与其他植物SKOR氨基酸序列的多重比较Fig.4 Amino acid sequence alignment of PtSKOR with those from other plants
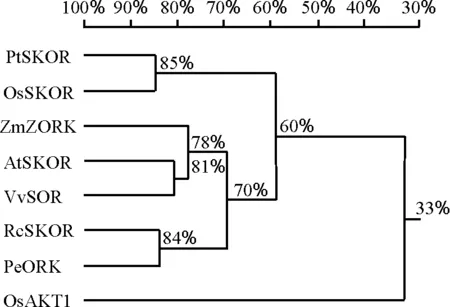
图5 PtSKOR蛋白质序列与其他植物外整流K+通道的系统进化树Fig.5 Phylogenetic tree of PtSKOR and outward rectifier K+ channel from other plants
3 讨论
长期以来,有关外整流K+通道蛋白的研究主要集中在模式植物拟南芥上。科学家们在拟南芥中提出的假说认为,盐胁迫下,随着木质部薄壁细胞中Na+不断积累,引起薄壁细胞质膜去极化,激活外整流K+通道蛋白(SKOR)或非选择性离子外整流通道蛋白(NOR)活性,进而将K+装载到木质部向地上部运输[14,16]。Gaymard等[11]从拟南芥中分离到K+外整流通道蛋白基因AtSKOR,通过非洲爪蟾卵母细胞(Xenopusoocytes)异源表达和突变体atskor试验证明,AtSKOR介导K+从木质部薄壁细胞向木质部的装载。可见,SKOR在植物地上部K+积累方面的作用不容忽视。Wang等[9]在拒盐牧草小花碱茅中的研究证明,其地上部K+的含量不受外界盐分浓度及处理时间的影响,并维持植株地上部高的K+/Na+。由此推测,小花碱茅PtSKOR作为外整流K+通道,对其耐盐性发挥着重要作用。
本研究得到的PtSKOR片段与拟南芥、葡萄、胡杨、蓖麻等双子叶植物的外整流K+通道相比同源性较低,介于55%~61%;与单子叶植物水稻推测的外整流K+通道OsSKOR同源性达到83%,但与其内整流K+通道AKT1同源性仅为33%(图5),因此推测此通道为小花碱茅外整流K+通道。PtSKOR与玉米ZORK同源性却仅有61%,这可能是由于玉米ZORK基因主要表达于根外皮层及保卫细胞中[17],与已知的其他植物的外整流K+通道分属不同类。
植物外整流K+通道SKOR结构与KAT1、AKT1等内整流K+通道类似,具有6个疏水性跨膜区域(S1~S6)[11]。本试验克隆获得的PtSKOR片段起始于最后一个跨膜区(S6)中段。S6跨膜区及其细胞内扩展区域具有高度的序列保守性(图4),与通道阻断剂的相互作用是K+通道电压门控的重要机制[18]。此外,PtSKOR与已报道的AtSKOR一致,在近C端含有环核苷酸结合序列(Cyclin Nucleotide-Binding Site,CNBS),与环核苷酸的调控有关[19]。然而,各类K+通道在C端的结构差异较大,如KAT1与SKOR在跨膜区具有很高的同源性,但C端比SKOR少约200个氨基酸及6个锚蛋白重复基序(Ankyrin Repeat Motif,AR)[20-21]。因此,KAT1对于细胞内的K+没有响应,而SKOR的C端非跨膜区对于其感受细胞内K+信号起着关键作用。可见,PtSKOR基因的研究为阐明盐生植物小花碱茅K+、Na+选择性运输机制提供分子层面的依据,对于改良作物耐盐碱性奠定了理论基础。
[1] Flowers T J,Troke P F,Yeo A R.The mechanism of salt tolerance in halophytes[J].Annual Review Plant Physiology,1997,28:89-121.
[2] Flowers T J,Hajibagheri M A,Clipson N J W. Halophytes[J].The Quarterly Review of Biology,1986,61:313-337.
[3] Greenway H,Munns R.Mechanisms of salt tolerance in nonhalophytes[J].Annual Review of Plant Physiology,1980,31:149-190.
[4] Pardo M J,Quintero F J.Plants and sodium ions:Keeping company with the energy[J].Genome Biology,2002(3):1017-1021.
[5] 王锁民,朱兴运,舒孝喜.碱茅离子吸收与分配特性的研究[J].草业学报,1994,3(1):39-43.
[6] 朱兴运,王锁民,阎顺国,等.碱茅属植物抗盐性与抗盐机制的研究进展[J].草业学报,1994,11(3):9-15.
[7] 李剑,赵常玉,吴永娜,等.小花碱茅HKT1;4基因片段的克隆与序列分析[J].草业科学,2011,28(6):969-973.
[8] 任伟,王志峰,徐安凯.碱茅耐盐碱基因克隆研究进展[J].草业学报,2010,19(5):260-266.
[9] Wang C M,Zhang J L,Liu X S,etal.Puccinelliatenuifloramaintains a low Na+level under salinity by limiting unindirectional Na+influx resulting in a high selectivity for K+over Na+[J].Plant,Cell and Environment,2009,32:486-496.
[10] Zhu J K.Regulation of ion homeostasis under salt stress[J].Current Opinion in Plant Biology,2003(6):441-445.
[11] Gaymard F,Pilot G,Lacombe B,etal.Identification and disruption of a plant shaker-like outward channel involved in K+release into the xylem sap[J].Cell,1998,94:647-655.
[12] Wegner L H,Raschke K.Ion channels in the xylem parenchyma of barley roots:A procedure to isolate protoplasts from this tissue and a patch-clamp exploration of salt passageways into xylem vessels[J].Plant Physiology,1994,105:799-813.
[13] Roberts S K,Tester M.Inward and outward K+-selective currents in the plasma membrane of protoplasts from maize root cortex and stele[J].The Plant Journal,1995,8:811-825.
[14] Roberts S K,Tester M.Permeation of Ca2+and monovalent cations through outwardly rectifying channel in maize root stelar cells[J].Journal of Experimental Botany,1997,48:839-846.
[15] 王生银,马清,王锁民.盐生植物盐地碱蓬质膜Na+/H+逆向转运蛋白基因片段的克隆及其序列分析[J].草业科学,2012,29(6):918-923.
[16] Wegner L H,De Boer A H.Properties of two outward-rectifying channels in root xylem parenchyma cells suggest a role in K+homeostasis and long-distance signaling[J].Plant Physiology,1997,115:1707-1719.
[17] Büchsenschütz K,Marten I,Becker D,etal.Differential expression of K+channels between guard cells and subsidiary cells within the maize stomatal complex[J].Plant Physiology,2005,222:968-976.
[18] Ding S,Horn H.Effect of S6 tail mutations on charge movement in shaker potassium channels[J].Biophysical Journal,2003,83(1):295-305.
[19] Chérel I,Daram P,Gaymard F,etal.Plant K+channels:Structure activity and function[J].Biochemical Society transactions,1996,24:964-971.
[20] Mäser P,Thomine S,Schroeder J I,etal.Phylogenetic relationships within cation transporter families ofArabidopsis[J].Plant Physiology,2001,126:1646-1667.
[21] Zimmermann S,Sentenac H.Plant ion channels:From molecular structures to physiological functions[J].Current Opinion in Plant Biology,1999(2):477-482.
